胍基乙酸对肉牛生长性能、血浆抗氧化和糖代谢指标及血液相关基因表达的影响
2022-01-10王子苑陈光吉舒健虹马广智何廷章王小利
王子苑 陈光吉 舒健虹 张 蓉 马广智 何廷章 王小利*
(1.贵州省农业科学院草业研究所,贵阳 550006;2.安徽万合佳尔生物科技有限公司,滁州 239000;3.绥阳县枧坝镇农业服务中心,绥阳 563307)
肌酸是体内能量代谢的重要物质,主要存在于肌细胞中,当机体的能量供应不足时,能在无氧条件下快速合成三磷酸腺苷(adenosine triphosphate,ATP),这种补充作用比直接由食物氧化释放能量快,因此可满足动物肌肉快速生长以及在应激条件下对能量的需要。Wyss等[1]研究发现,人和动物每天大约有1.7%的肌酸会不可避免地转化为肌酐(creatinine,CRE),并随尿液排出体外,机体必须持续补充肌酸才得以维持平衡。然而动物营养学家发现,植物性饲料原料中并不含有肌酸[2],反刍动物采食纯植物饲粮极易造成机体对肌酸的缺乏。虽有研究表明饲粮中添加肌酸能提高动物生长性能[3-5],但外源性补充肌酸稳定性差、利用率低[6]。
胍基乙酸(guanidine acetic acid,GAA)是合成肌酸的唯一前体物,是精氨酸和甘氨酸在精氨酸-甘氨酸咪基转移酶(arginine-glycine amidinotransferse,AGAT)作用下生成的,已证实GAA在不同条件下的稳定性优于肌酸[7],补充GAA能提高磷酸肌酸(phosphocreatine,PCr)和ATP等高能量物质的存贮量或利用效率。研究发现,GAA在提高肉仔鸡胸肌重和三元杂交育肥猪平均日增重方面有显著功效[8-9],可改善育肥猪肌肉组织能量代谢,延缓糖酵解的发生,从而改善肉品质[10]。由于GAA在国内动物生产中的应用仍处于起步阶段,关于其作为饲料添加剂的研究大多数集中于家禽和育肥猪上,在反刍动物饲粮中的研究报道甚少。因此,本研究以肉牛为试验对象,旨在研究GAA对提升肉牛生长性能和改善能量代谢的作用效果,并探究其对血液中相关基因表达的影响,以期为GAA在肉牛饲粮中的生产应用提供依据和参考。
1 材料与方法
1.1 试验设计
选取平均体重为(473.58±64.40) kg的健康西门塔尔牛24头,随机分为3组,每组8个重复,每个重复1头牛。对照组(CON组)饲喂基础饲粮,试验组分别在基础饲粮中添加400(G1组)和800 mg/kg(G2组)的GAA。GAA由安徽某公司提供,有效物质含量90%。预试期7 d,正试期49 d。
1.2 试验饲粮及饲养管理
饲粮配方参照《肉牛饲养标准》(NY/T 815—2004)进行配制,基础饲粮组成及营养水平见表1。试验饲粮按照配方要求,将GAA按0、400和800 mg/kg的添加量预先拌入精料预混料中,再逐级与所有精料混匀。试验前对牛只进行统一称重、编号,按牛场常规操作进行消毒免疫。每天08:00、16:00各饲喂1次,采用先精后粗的饲喂方法,自由采食粗料,自由饮水,保证每天饲料有少量剩余。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
1.3 样品采集
试验结束时,每组随机选取4头牛,由颈静脉采集血液。乙二胺四乙酸(EDTA)抗凝管先采集2 mL血样,置于干冰盒运回实验室提取RNA,测定血液中相关基因表达量;另用肝素抗凝管采集10 mL血样,室温下倾斜放置30 min,3 500 r/min离心15 min后获取上层血浆,分装于200 μL离心管中,-80 ℃冷冻保存,用于血浆抗氧化和糖代谢指标的测定。
1.4 指标测定与方法
1.4.1 生长性能
分别于正式试验开始和结束当天晨饲前对每头牛进行空腹称重,记录初重(IW)和末重(FW),计算平均日增重(ADG);以组为单位,记录每日各组肉牛的总饲喂量和剩料量,计算每头牛的平均日采食量(ADFI),最后根据ADFI和ADG计算料重比(F/G)。
1.4.2 血浆抗氧化指标
血浆总抗氧化能力(T-AOC)和谷胱甘肽过氧化物酶(GSH-Px)活性采用比色法测定,血浆超氧化物歧化酶(SOD)活性采用羟胺法测定,血浆过氧化氢酶(CAT)活性采用钼酸铵法测定,血浆丙二醛(MDA)含量采用硫代巴比妥酸法测定。以上试剂盒均购于南京建成生物工程研究所。
1.4.3 血浆糖代谢指标
血浆肌酸激酶(CK)和丙酮酸激酶(PK)活性采用比色法测定,血浆葡萄糖-6-磷酸脱氢酶(G-6-PDH)活性采用高铁血红蛋白还原法测定,血浆CRE含量采用肌氨酸氧化酶法测定,血浆磷酸果糖激酶(PFK)活性采用分光光度法测定。以上试剂盒均购于南京建成生物工程研究所。
1.4.4 血液相关基因表达
1.4.4.1 总RNA提取及cDNA合成
收集细胞,加入1 mL Trizol和0.2 mL氯仿,漩涡振荡混匀,4 ℃ 15 000 r/min离心5 min;取上清加400 μL异丙醇,振荡混匀,4 ℃ 15 000 r/min离心20 min;弃上清,加1 mL 75%乙醇,4 ℃ 15 000 r/min离心5 min;弃上清,加1 mL无水乙醇,4 ℃ 15 000 r/min离心5 min;弃上清,空气干燥5~10 min;溶于40 μL 1‰焦碳酸二乙酯(DEPC)水中,-70 ℃保存待用。cDNA的合成按Toyobo公司Rever Tre Ace-a-逆转录试剂盒说明书进行。
1.4.4.2 实时荧光定量PCR检测
利用Applied Biosystems 7500 PCR仪(ThermoFisher公司,美国)检测肌酸转运蛋白(CrT)、腺苷酸活化蛋白激酶(AMPK)、γ-氨基丁酸转运蛋白2(GAT2)和β-肌动蛋白(β-actin)的mRNA相对表达量,所有引物由上海生物工程有限公司合成,引物序列见表2。PCR反应体系:cDNA 2 μL,上、下游引物各0.3 μL,2×SYBRGreen 10 μL,ddH2O 7.4 μL,PCR反应的总体积20 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,40个循环。以β-actin为内参基因,利用Gene Study软件分析基因的mRNA相对表达量。

表2 引物序列Table 2 Primer sequence
1.5 结果统计与分析
试验数据用SPSS 18.0软件进行单因素方差分析(one-way ANOVA),多重比较采用Duncan氏法,试验结果以“平均值±标准差”表示。
2 结 果
2.1 GAA对肉牛生长性能的影响
由表3可知,与对照组相比,G1组和G2组的平均日增重分别提高了12.19%(P>0.05)、28.05%(P<0.05),G1组和G2组的料重比分别下降了9.92%(P>0.05)、21.13%(P<0.05);G1组和G2组的末重和平均日采食量有所升高,但差异不显著(P>0.05)。
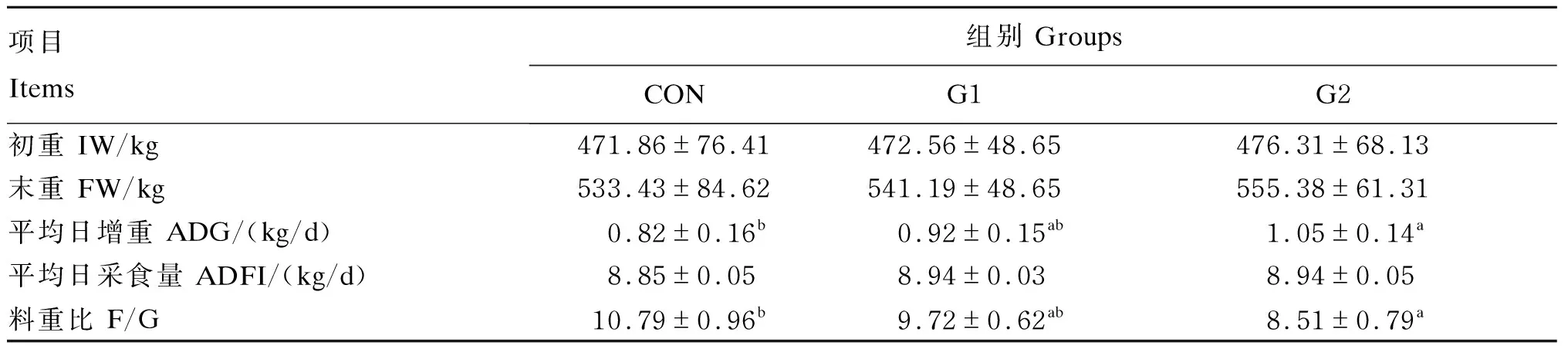
表3 GAA对肉牛生长性能的影响Table 3 Effects of GAA on growth performance of beef cattle
2.2 GAA对肉牛血浆抗氧化指标的影响
由表4可知,与对照组相比,G1组和G2组的血浆T-AOC和GSH-Px活性显著升高(P<0.05),G1组和G2组的血浆T-AOC分别提高了44.63%和108.26%,G1组和G2组的血浆GSH-Px活性分别提高了27.86%和25.72%;G1组和G2组的血浆CAT活性极显著升高(P<0.01),G1组和G2组的血浆CAT活性分别提高了47.14%和62.14%;G1组和G2组的血浆MDA含量极显著降低(P<0.01),且G1组的血浆MDA含量极显著低于G2组(P<0.01)。各组间血浆SOD活性差异不显著(P>0.05),但随着GAA添加量的增加有所升高。

表4 GAA对肉牛血浆抗氧化指标的影响Table 4 Effects of GAA on plasma antioxidant indexes of beef cattle
2.3 GAA对肉牛血浆糖代谢指标的影响
由表5可知,与对照组相比,G1组和G2组的血浆G-6-PDH活性极显著降低(P<0.01),G1组和G2组的血浆PK活性显著降低(P<0.05),G2组的血浆PKF活性显著降低(P<0.05);G1组和G2组的血浆CK活性显著升高(P<0.05),G1组和G2组的血浆CK活性分别提高了37.04%、62.96%。各组间血浆CRE含量差异不显著(P>0.05),但随着GAA添加量的增加有所升高。

表5 GAA对肉牛血浆糖代谢指标的影响Table 5 Effects of GAA on plasma glycometabolism indexes of beef cattle
2.4 GAA对肉牛血液相关基因表达的影响
由表6可知,G1组和G2组血液中CrT、AMPK和GAT2 mRNA相对表达量均极显著低于对照组(P<0.01),且G1组血液中CrT、AMPK和GAT2 mRNA相对表达量均极显著低于G2组(P<0.01)。对照组血液中CrTmRNA相对表达量分别是G1组和G2组的4.54和2.03倍,血液中AMPKmRNA相对表达量分别是G1组和G2组的6.51和2.23倍,血液中GAT2 mRNA相对表达量分别是G1组和G2组的6.37和2.74倍。

表6 GAA对肉牛血液相关基因表达的影响Table 6 Effects of GAA on blood related genes expression of beef cattle
3 讨 论
3.1 GAA对肉牛生长性能的影响
肌酸是一类自然存在于脊椎动物体内、能够快速为肌肉和神经细胞提供能量的物质。GAA作为机体合成肌酸的重要内源物,以甲基化的形式最终形成肌酸,其中有95%的肌酸经过血液运输到肌肉组织,通过与高能磷酸基团结合以储备能量[11]。本试验在饲粮中外源性添加400和800 mg/kg GAA,能提高肉牛平均日增重,降低料重比,而对平均日采食量没有影响,这与赵元等[12]、潘宝海等[13]研究结果一致。
研究发现,饲粮中添加GAA能显著提高肌肉中肌酸含量[14],同时血浆CK活性也相应升高[15],在CK催化下促使肌酸吸收多余ATP的磷酸根基团形成PCr,从而提升磷酸原系统的能量储备,为机体蛋白质沉积提供保障。同时,GAA作为氨基酸衍生物能促进肌肉的生长。宋阳[16]用20 mmol/L GAA处理C2C12成肌细胞,发现GAA可以提高肌源性分化基因肌肉转录调节因子(MyoD)和肌细胞生成素(MyoG)的表达水平,增加肌管融合率,同时GAA能通过miR-133a-3p和miR-1a-3p激活蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)/核糖体S6蛋白激酶(S6K)信号通路,从而促进肌细胞的分化和骨骼肌生长。目前,精氨酸被认为是畜禽营养中的条件性必需氨基酸[17],具有促进骨骼肌蛋白合成,刺激生长激素分泌[18]以及增强机体抗应激能力等功能,由于精氨酸是合成GAA的前体物,外源添加GAA可以有效节约饲粮中的精氨酸[19],这一节约作用能促使更多精氨酸参与机体的蛋白质合成,从而提高畜禽生长性能[20]。此外,GAA可作用于胰腺导致胰岛B细胞电位变化,并通过蛋白激酶A和蛋白激酶C来增强靶细胞膜表面胰岛素受体的活性,刺激胰岛素和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)分泌[21-22],间接促进机体生长。
GAA在脊椎动物体内经由血液循环运输到肝脏,在胍乙酸-N-甲基转移酶(guanidinoacetate N-methyltransferse,GAMT)的催化下,将S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)的甲基转移到GAA上,最终合成肌酸。由此可见,外源性补充GAA势必会增加机体对甲基供体的需求[23],若甲基供体缺乏则会增加同型半胱氨酸血症的发生率。赵景鹏等[24]研究发现,当全期(1~42日龄)饲喂肉鸡高剂量GAA时,无需额外补充蛋氨酸也能获得较好的末重和胴体质量,但若要阶段性使用GAA则适宜在饲养后期(22~42日龄)搭配蛋氨酸高剂量添加。本试验中,饲粮添加400和800 mg/kg GAA能不同程度提高肉牛生长性能,但关于GAA的适用阶段、最低有效量、最大耐受量以及与饲粮甲基供体的配套强化效果等问题,需待进一步研究解析。
3.2 GAA对肉牛血浆抗氧化指标的影响
生物体天然拥有一套复杂的抗氧化体系,包括抗氧化酶系和抗氧化非酶系,前者是以微量元素为中心,如SOD、GSH-Px、CAT和谷胱甘肽-S-转移酶(glutathione S-transferase,GST)等;后者主要包括维生素、氨基酸、金属蛋白质以及中草药提取物等。该体系通过清除和利用机体内的氧化物质,以应对生命活动过程中不断产生的自由基,维持机体动态平衡[25]。如果该系统失衡,机体可能会产生过多的活性氧(reactive oxygen species,ROS),如超氧阴离子自由基、羟自由基、过氧化羟自由基等。在ROS作用下,生物膜、蛋白质及核酸等大分子结构遭到破坏[26],诱发动物体产生一系列疾病[27],从而影响生长性能[28]。T-AOC是反映机体抗氧化作用的重要指标之一,SOD、CAT和GSH-Px是机体内重要的抗氧化酶,SOD能够催化超氧化物阴离子自由基转化成过氧化氢和氧,过氧化氢又在CAT的作用下生成水,以解除自由基氧化而造成的机体损害。GSH-Px的作用底物是谷胱甘肽和过氧化物,能促使有毒的过氧化物生成无毒的羟基化合物,以保护细胞膜的结构和功能免受干扰。MDA被认为是膜脂质过氧化(membrane lipid peroxidation,LPO)最重要的产物之一,通常用来反映机体LPO程度,它与膜蛋白结合会增加膜通透性,导致膜蛋白酶失活,细胞代谢发生紊乱。
李子平等[29]研究表明,在循环热应激条件下,肉鸡饲粮中添加0.5 g/kg GAA提高了血清SOD和GSH-Px活性,改善了热应激引起的氧化损伤,提高了肉鸡的抗氧化状态。本试验研究发现,饲粮中添加GAA能提高肉牛血浆中抗氧化酶活性和T-AOC,同时降低血浆MDA含量,其中GAA添加量为400 mg/kg时能获得较低的血浆MDA含量和较高的血浆GSH-Px活性。这说明GAA可在一定程度上能通过增加内源性抗氧化酶活性达到提高机体抗氧化能力的效果,这可能与间接补充肌酸有关。有研究表明,磷酸肌酸可以保护丙酮醛或脂多糖刺激人脐静脉的内皮细胞,影响核因子-κB(NF-κB)和磷脂酰肌醇3-激酶(PI3K)/Akt/内皮型一氧化氮合成酶(eNOS)通路,抑制p65核转位,减少ROS产生[30-31]。李晓斌等[32]研究补喂肌酸对伊犁马血浆中的抗氧化酶活性的影响,结果发现血浆抗氧化酶活性随补饲的进行逐渐升高,尤其在试验后期,GSH-Px、SOD活性和T-AOC明显提高,说明肌酸对提高伊犁马抗氧能力有促进作用。然而有研究认为,外源性条件GAA后,血清GAA浓度(约5 μmol/L)较低时才体现出其抗氧化作用,反之GAA则会作为强氧化剂诱导氧化应激[21,33]。
3.3 GAA对肉牛血浆糖代谢指标的影响
动物体内糖分解代谢途径主要有糖原分解、无氧分解、有氧分解和戊糖磷酸途径(PPP)等,G-6-PDH是PPP的关键限速酶,葡萄糖-6-磷酸可经此途径代谢产生核糖-5-磷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)+氢离子(H+)和二氧化碳。核糖-5-磷酸是合成核酸和核苷酸的原料,NADPH+H+能为生物合成提供还原当量,同时还能将氧化型谷胱甘肽还原为氧化型[34]。PFK和PK则是糖酵解途径(EMP)中的2个关键限速酶,PFK参与无氧分解过程中第2个限速反应,催化果糖-6-磷酸转变为果糖-1,6-二磷酸,而PK是无氧分解的第3个限速步骤,将磷酸烯醇式丙酮酸催化为丙酮酸。本试验中,饲粮中添加GAA降低了肉牛血浆G-6-PDH、PFK和PK活性,说明GAA能减少机体葡萄糖的分解代谢,这一结论与洑琴等[35]的研究结果一致,GAA是合成肌酸的唯一前体物,能直接增加生命活动所需的ATP,使葡萄糖更多的以糖原形式贮存起来。
CRE是肌肉中的肌酸通过不可逆的非酶脱水反应产生的代谢物,以恒定速度释放入血后随尿排出,有学者认为CRE含量的高低能够反映机体的肌肉总量[36]。本试验中,饲粮中添加GAA提高了肉牛血浆中CRE含量,说明GAA作为肌酸的潜在来源,能提高机体的肌肉代谢,同时外源添加GAA能促进蛋白质沉积以及骨骼肌的生长,由此印证GAA对生长性能的促进作用。CK主要存在于细胞质和线粒体中,能可逆地催化PCr和ATP之间高能磷酸键的转化,当机体代谢旺盛ATP供应不足时,PCr在CK催化作用下快速脱去磷酸根与二磷酸腺苷(ADP)结合生成ATP供能,同时释放出肌酸,因此CK在肌酸代谢中具有能量缓冲作用。同时,还认为CK能通过ADP再利用循环机制抑制ROS的产生,提高动物在应激条件下的抗氧化能力[37]。李蛟龙[38]研究发现,在育肥猪饲粮中补充0.8%一水肌酸和0.1%GAA可显著提高背最长肌中CK活性以及肌酸、PCr含量。本试验结果表明,饲粮中添加GAA提高了肉牛血浆中CK活性,可能是GAA的添加促进了高能磷酸化合物的储备,以此增强肌酸代谢中的能量缓冲。有报道,肌肉中PCr的大量储备能延缓宰后糖酵解的发生以及pH的下降速度,进而改善胴体肉品质[39]。
3.4 GAA对肉牛血液相关基因表达的影响
肝脏合成的肌酸进入血液后,需在钠离子(Na+)和氯离子(Cl-)依赖的CrT的作用下,通过血液循环逆浓度差将肌酸转运到肌纤维和其他组织中[40],因此细胞内肌酸或总肌酸含量是影响CrT表达的重要因素。有学者者认为,长时间暴露在高肌酸含量环境下或外源补充肌酸,可能会降低CrT活性从而部分抑制肌酸摄取[41]。Loike等[42]将L6成肌细胞置于肌酸含量为1 mmol/L的培养基24 h,发现该组细胞的CrT活性较培养基不含肌酸的对照组下降了2/3,当把肌酸孵育的L6成肌细胞转移至缺少肌酸的培养基中24 h,其下调的CrT活性会部分回升。本研究发现,饲粮中添加GAA显著下调肉牛血液中CrTmRNA相对表达量,然而有研究表明,饲粮中添加一水肌酸能显著上调育肥猪背最长肌、肝脏和肾脏中CrTmRNA相对表达量;饲粮中添加GAA可以显著上调背最长肌中CrTmRNA相对表达量,但对其他组织中的CrTmRNA相对表达量没有影响[38]。上述结果与本研究结果不一致的原因可能是样品采集部位不同,基因表达存在组织差异性。
AMPK被称为“细胞能量感受器”,当机体代谢增强时,ATP过量消耗,一磷酸腺苷(AMP)含量升高,从而激活AMPK途径,抑制糖原合成,加快糖酵解代谢,达到调节机体能量代谢的目的。本研究结果显示,饲粮中添加GAA极显著下调了肉牛血液中AMPKmRNA相对表达量,可能是外源补充GAA能为动物生长提供直接能量,从而节约了机体葡萄糖的分解供能,此时细胞能量充盈,AMPK处于相对沉默状态。前人研究结果表明,饲粮中添加一水肌酸能降低大鼠腓肠肌中糖酵解酶活性以及肌球蛋白重链(MyHC)Ⅱx mRNA相对表达量,进而改变了腓肠肌肌纤维类型,即由酵解型向氧化型转变[43],肌肉纤维类型的改变能提高蛋白质溶解度,加强蛋白质水合作用,进而增加动物体重,这一结论可从另一方面解释本试验的部分结果。然而也有研究表明,AMPK途径的激活能抑制糖酵解代谢,增加葡萄糖在细胞间的转运作用,改善糖代谢效率[44],可能由于AMPK是内含α、β、γ 3个亚单位的异源复合物,其各个亚型组合在机体的不同组织或相同组织的不同代谢状态中有不同表达[45]。有研究表明,GAT2参与了肝细胞摄取GAA过程[46]。本试验结果发现,饲粮中添加GAA极显著降低了肉牛血液中GAT2 mRNA相对表达量,其变化趋势与CrT和AMPKmRNA相对表达量一致,并且均在G1组获得最低相对表达量,该结果暗示了外源补充GAA可能会对肉牛转运和摄取GAA有一定的抑制作用。
4 结 论
本试验条件下,饲粮中添加400和800 mg/kg GAA可不同程度改善肉牛的生长性能,提高抗氧化能力,并降低血浆糖代谢相关酶活性以及血液中CrT、AMPK、GAT2 mRNA相对表达量,改善能量代谢途径。
