饲粮不同非纤维性碳水化合物/中性洗涤纤维对高原型育肥藏羊生长性能、瘤胃发酵及微生物多样性的影响
2022-01-10李蒋伟桂林生侯生珍王志有杨葆春马博妍
李蒋伟 桂林生 周 力 侯生珍 王志有 杨葆春 马博妍
(青海大学农牧学院,西宁 810016)
藏羊是高海拔地区特有的肉羊种质资源,具有耐粗饲、抗逆性强等特点,主要分布于青海、甘肃以及西藏等地区。由于高海拔地区特有的气候环境,枯草期长达9个月之久,长时间的营养物质摄入匮乏导致放牧藏羊生长发育缓慢,严重制约了藏羊养殖产业发展[1-2]。基于此,藏羊养殖逐渐由传统放牧向舍饲或半舍饲过度。精料补饲则是舍饲或半舍饲过程极为重要的环节,精料水平过高会引起瘤胃内环境紊乱,诱导藏羊代谢疾病的发生;但精料水平过低则不利于藏羊的生长发育,失去舍饲或半舍饲的意义。
反刍动物瘤胃中含有数量庞大的细菌、真菌以及原虫,这些微生物群落时刻处于动态平衡状态,通过厌氧发酵将瘤胃中的食物降解为营养物质,满足宿主的生长发育需求。瘤胃真菌占瘤胃内总生物量的8%~20%,尽管比例不高,但其可通过产生多种高活性酶对饲料中纤维素、半纤维素和木质素等难降解的高分子化合物进行降解利用,进而提高瘤胃的消化效率[3-5]。近年来,关于反刍动物饲粮结构影响瘤胃微生物的研究主要集中于瘤胃细菌和原虫方面,而对瘤胃真菌的相关研究鲜有报道。占今舜等[6]研究发现,饲喂精粗比为60∶40的饲粮可显著提高湖羊瘤胃中氨态氮、丙酸、丁酸和戊酸含量;而饲喂精粗比为70∶30的饲粮可促进瘤胃发酵,提高瘤胃细菌多样性,增加瘤胃放线菌门和螺旋体菌门的相对丰度。张洁等[7]利用内转录间隔区(ITS)rDNA高通量测序技术发现,舍饲降低了滩羊瘤胃真菌的多样性,但提高了瘤胃真菌物种丰度的均匀度;优势菌群比例发生变化,对纤维素、半纤维素降解菌和葡萄糖降解菌的影响明显。谢明欣等[8]研究不同精粗比条件下复合益生菌对蒙古绵羊瘤胃微生物菌群的影响发现,饲喂低水平精料可显著提高绵羊瘤胃中溶纤维丁酸弧菌和黄色瘤胃球菌的数量,同时提高瘤胃中反刍兽新月形单胞菌、白色瘤胃球菌和总产甲烷菌的数量;而饲喂高精料水平则显著降低绵羊瘤胃中白色瘤胃球菌、反刍兽新月形单胞菌和总产甲烷菌的数量。
瘤胃中的细菌通过发酵作用,可将高纤维饲粮进行有效分解,形成挥发性脂肪酸(VFA)为宿主吸收,同时可以将植物性蛋白质和非蛋白氮转化为微生物蛋白,满足宿主必需的营养需求,进而与宿主的生长发育和免疫应答密切关联[9]。Wang等[10]研究发现,高精料水平饲粮可通过促进瘤胃中琥珀酸辅酶α合成酶(EC 6.2.1.5)和丙酰辅酶α羧化酶(EC 2.8.3.1)的合成,有效提高瘤胃中的pH、挥发性脂肪酸含量,同时有助于瘤胃杆菌、普雷沃菌等细菌的编码。通过开展体外发酵试验,张建勋等[11]发现高精料水平饲粮对南江黄羊体外发酵有显著影响,随着精料水平的升高,微生物蛋白合成量增加,瘤胃发酵的能量利用效率提高。上述研究证实,适当的精料水平能够改善反刍动物瘤胃内环境,进而促进生长性能。
当前,借助高通量测序技术鉴定反刍动物瘤胃微生物菌群结构应用广泛[12],但不同饲粮组成对藏羊瘤胃微生物菌群分布影响的相关研究较少。基于此,本研究拟探讨饲粮不同非纤维性碳水化合物/中性洗涤纤维(NFC/NDF)对藏羊生长性能、瘤胃发酵及微生物多样性的影响,筛选出适宜藏羊生长发育且有利于藏羊瘤胃内环境稳态的饲粮结构。
1 材料与方法
1.1 试验时间和地点
动物饲养试验于2019年5月15日至2019年8月25日在青海省海南州共和县切吉乡哇玉村青海香咔梅朵牧业有限公司进行。
1.2 试验设计和饲养管理
选择健康、体况相近且体重[(22.14±0.02) kg]无显著差异(P<0.05)的3月龄早期断奶高原型藏羊母羔共210只,随机分成7组,每组30只。7组羔羊分别饲喂NFC/NDF为2.86(Ⅰ组)、2.69(Ⅱ组)、2.42(Ⅲ组)、2.06(Ⅳ组)、1.88(Ⅴ组)、1.63(Ⅵ组)、1.43(Ⅶ组)的全混合日粮,其精粗比分别为80∶20、70∶30、60∶40、50∶50、40∶60、30∶70和20∶80。饲养试验预试期10 d,正试期90 d。试验饲粮组成及营养水平见表1。

表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets (DM basis) %
试验羔羊全舍饲分栏饲养,每日分别于08:30和18:30各饲喂1次,自由饮水,每天饲喂前清扫残留饲料并称重。
1.3 样品采集和处理
饲养试验结束后,每组中随机抽取3只试验羊于清晨空腹屠宰,4层纱布过滤取瘤胃液于冻存管中,投入液氮保存,并参照Kang等[14]的取样方法分别于不同位点取瘤胃内容物于离心管中(合计2 g),加入7.5 mL磷酸盐缓冲液(phosphate buffered saline,PBS),充分振荡后室温静置2.5 h,350×g离心15 min,取上清液转移至无菌离心管中,10 000×g离心15 min,取沉淀溶于2.5 mL TE缓冲液中,进而对固相黏附微生物进行洗脱。
1.4 指标测定
1.4.1 饲粮营养水平测定
饲粮粗蛋白质(CP)含量采用凯氏定氮法测定(K9840型自动凯氏定氮仪,上海海能公司),具体方法参考GB/T 6435—2006;酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)含量采用范氏(Van Soest)洗涤纤维分析法测定,具体方法参照袁翠林等[15];钙(Ca)含量采用高锰酸钾检测法测定,磷(P)含量采用钼黄比色法测定(UV-1780紫外分光光度计,日本岛津公司),分别参照GB/T 6436—2002、GB/T 6437—2002。
1.4.2 生长性能测定
分别于试验开始和结束时对每组试验羊称重并记录数据,计算平均日采食量和平均日增重。
1.4.3 瘤胃发酵参数测定
瘤胃液氨态氮(NH3-N)含量使用721型分光光度计在700 nm波长下比色测定[16];pH采用便携性pH酸度计(CY-PH-60,北京恒奥德仪器仪表有限公司)测定;挥发性脂肪酸含量采用气相色谱仪(GC-2014,日本岛津公司)测定,测定方法参照王加启[17]关于气相色谱测定羊瘤胃液中挥发性脂肪酸的研究方法。
1.4.4 瘤胃微生物多样性测定
本试验微生物检测中,细菌采用16S rDNA测序,扩增区域为V3+V4;真菌采用ITS测序,扩增区域为ITS1。测序均由百迈客生物科技有限公司完成,对采集到的21个瘤胃液及内容物样品使用DNA提取试剂盒(InvitrogenTM,美国)提取瘤胃微生物基因组DNA,根据保守区设计得到引物,其中真菌上游引物:5′-CTTGGTCATTTAGAGGAAGTAA-3′,下游引物:5′-GCTGCGTTCTTCATCGATGC-3′;细菌上游引物:5′-CCTACGGGNGGCWGCAG-3′,下游引物:3′-GGACTACHVGGGTATCTAAT-5′。测序基于Illumina HiSeq测序平台,采用双末端测序(paired-end)的方法,构建小片段文库进行测序,进一步对Reads拼接过滤,使用RDP Classifier 2.2软件进行操作分类单元(OTU)物种注释;使用SILVA 128软件进行16S物种注释,使用UNITE 7.0软件进行真菌ITS物种注释;使用Metastats 20090414软件分析组间差异分析。
1.5 数据处理
采用Excel 2019整理初始数据,用SPSS 20.0中的one-way ANOVA程序进行单因素方差分析,结果用平均值±标准误(mean±SE)表示,差异显著的评断标准为P<0.05。Alpha多样性指数分析软件为Mothur 1.30,在主坐标分析(principal coordinates analysis,PCoA)中,计算距离矩阵的方法是利用各样品序列间的进化信息来计算样品间距离。
2 结 果
2.1 饲粮不同NFC/NDF对育肥藏羊生长性能的影响
由表2可知,各组之间初始体重差异不显著(P>0.05)。经过90 d的正试期后,Ⅰ、Ⅱ、Ⅲ、Ⅳ组终末体重显著高于Ⅴ、Ⅵ、Ⅶ组(P<0.05);Ⅰ、Ⅱ组平均日增重显著高于Ⅳ、Ⅴ、Ⅵ、Ⅶ组(P<0.05);各组之间平均日采食量差异不显著(P>0.05)。

表2 饲粮不同NFC/NDF对育肥藏羊生长性能的影响Table 2 Effects of dietary different NFC/NDF on growth performance of fattening Tibetan sheep
2.2 饲粮不同NFC/NDF对育肥藏羊瘤胃发酵参数的影响
由表3可知,瘤胃内NH3-N含量有随饲粮NFC/NDF的降低而降低的趋势,且Ⅰ、Ⅱ组瘤胃内NH3-N含量显著高于Ⅴ、Ⅵ、Ⅶ组(P<0.05)。瘤胃内乙酸含量有随饲粮NFC/NDF的降低而升高的趋势,且Ⅰ组瘤胃内乙酸含量显著低于Ⅴ、Ⅵ、Ⅶ组(P<0.05)。Ⅰ、Ⅱ组瘤胃内丙酸含量显著高于Ⅶ组(P<0.05),Ⅲ组瘤胃内丁酸含量显著高于Ⅶ组(P<0.05);Ⅱ组瘤胃内总挥发性脂肪酸(TVFA)含量最高,显著高于其他各组(P<0.05)。各组之间瘤胃内异丁酸、异戊酸和戊酸含量无显著差异(P>0.05)。瘤胃内乙酸/丙酸有随饲粮NFC/NDF的降低而升高的趋势,且Ⅰ组瘤胃内乙酸/丙酸显著低于Ⅵ、Ⅶ组(P<0.05)。

表3 饲粮不同NFC/NDF对育肥藏羊瘤胃发酵参数的影响Table 3 Effects of dietary different NFC/NDF on rumen fermentation parameters of fattening Tibetan sheep
2.3 饲粮不同NFC/NDF水平对育肥藏羊瘤胃真菌多样性的影响
2.3.1 测序数据质量评估
21个样品测序共获得1 673 531对Reads,双端Reads拼接、过滤后共产生1 532 284条Clean tags,每个样品至少产生64 397条Clean tags,平均产生72 966条Clean tags,被分配至295个OTU,有210个为共有OTU。本试验覆盖率大于99%,表明测序深度能够准确反映羔羊瘤胃真菌微生物组成。
2.3.2 饲粮不同NFC/NDF对育肥藏羊瘤胃真菌Alpha多样性的影响
由表4可知,各组之间Shannon、Simpson指数差异不显著(P>0.05)。Ⅲ组Ace指数显著高于Ⅳ、Ⅵ和Ⅶ组(P<0.05);Ⅲ组Chao1指数最高,且Ⅲ、Ⅵ组Chao1指数显著高于其他各组(P<0.05)。
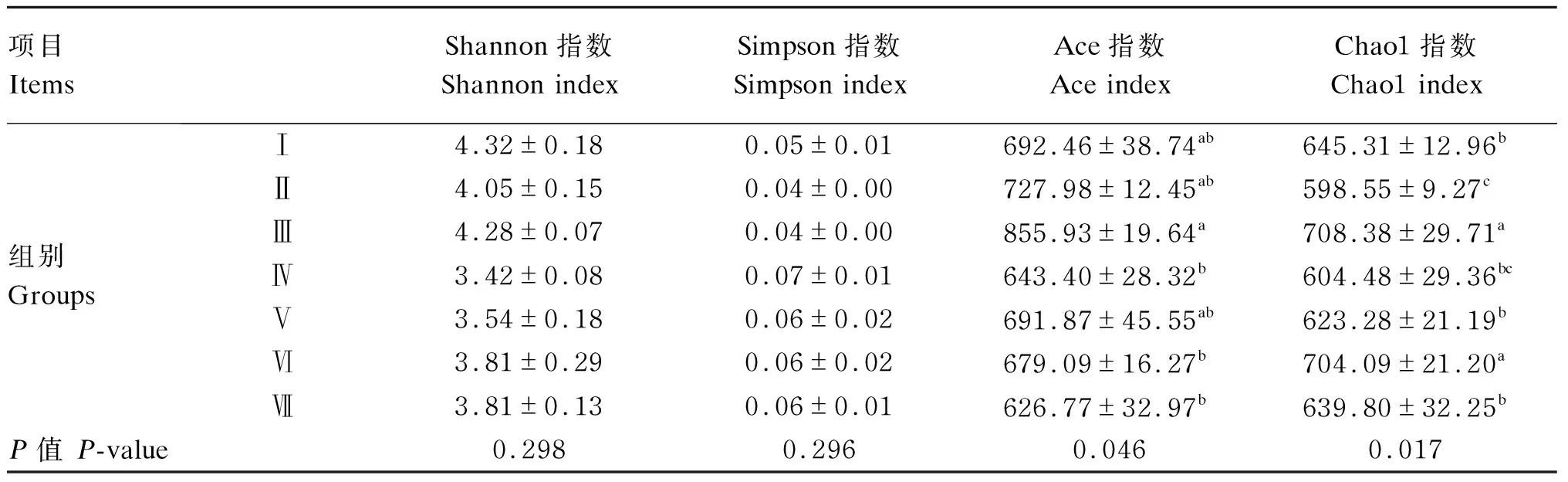
表4 饲粮不同NFC/NDF对育肥藏羊瘤胃真菌Alpha多样性指数的影响Table 4 Effects of dietary different NFC/NDF on rumen fungi Alpha diversity indexes of fattening Tibetan sheep
2.3.3 饲粮不同NFC/NDF对育肥藏羊瘤胃真菌Beta多样性的影响
通过PCoA可以实现多个样品的分类,进一步展示样品间物种多样性差异。由图1可知,Ⅰ、Ⅱ、Ⅲ组在主成分1(贡献率为25.94%)上与Ⅳ、Ⅴ、Ⅵ、Ⅶ组之间分布距离较远。这说明各组之间的真菌Beta多样性差异较大,Ⅰ、Ⅱ、Ⅲ组瘤胃真菌群落差异要小于Ⅳ、Ⅴ、Ⅵ、Ⅶ组。

图1 饲粮不同NFC/NDF下育肥藏羊瘤胃真菌区系PCoA图Fig.1 PCoA diagram of rumen fungal flora in fattening Tibetan sheep with dietary different NFC/NDF
2.3.4 饲粮不同NFC/NDF对育肥藏羊瘤胃真菌科水平下菌群分布的影响
由表5可知,育肥藏羊瘤胃内被孢霉科(Mortierellaceae)和丛赤壳科(Nectriaceae)为优势菌科,相对丰度分别大于3.17%和2.01%。Ⅵ组瘤胃内被孢霉科相对丰度最高,但因组内差异较大而表现为各组之间差异不显著(P>0.05)。Ⅳ、Ⅴ、Ⅵ和Ⅶ组瘤胃内丛赤壳科、隔孢伏革菌科(Peniophoraceae)和毛球壳科(Lasiosphaeriaceae)相对丰度显著低于Ⅱ组(P<0.05)。Ⅴ组瘤胃内曲霉科(Aspergillaceae)和黏毛菌科(Myxotrichaceae)相对丰度显著高于Ⅱ、Ⅲ组(P<0.05)。Ⅲ组瘤胃内蜡壳耳科(Sebacinaceae)相对丰度显著高于其余各组(P<0.05)。

表5 饲粮不同NFC/NDF对育肥藏羊瘤胃真菌科水平下相对丰度的影响Table 5 Effects of dietary different NFC/NDF on relative abundance of rumen fungi at family level of fattening Tibetan sheep %
2.4 饲粮不同NFC/NDF对育肥藏羊瘤胃细菌多样性的影响
2.4.1 饲粮不同NFC/NDF对育肥藏羊瘤胃细菌Beta多样性的影响
由图2可知,各组在主成分2(贡献率为9.18%)和主成分3(贡献率为4.88%)上的细菌多样性无明显差异,各组样本未存在明显分区。

图2 饲粮不同NFC/NDF下育肥藏羊瘤胃细菌区系PCoA图Fig.2 PCoA diagram of rumen bacteria flora in fattening Tibetan sheep with dietary different NFC/NDF
2.4.2 饲粮不同NFC/NDF对育肥藏羊瘤胃细菌属水平下菌群分布的影响
由表6可知,Ⅴ、Ⅶ组瘤胃内奎因菌属(Quinella)相对丰度显著高于Ⅰ、Ⅱ组(P<0.05)。

表6 饲粮不同NFC/NDF对育肥藏羊瘤胃细菌属水平下相对丰度的影响Table 6 Effects of dietary different NFC/NDF on relative abundance of rumen bacterial at genus level of fattening Tibetan sheep %
Ⅵ组瘤胃内克里斯滕菌科_R-7_群(Christensenellaceae_R-7_group)相对丰度最高,显著高于其他各组(P<0.05)。Ⅴ、Ⅵ和Ⅶ组瘤胃内瘤胃球菌科_NK4A214_群(Ruminococcaceae_NK4A214_group)相对丰度较高,显著高于其他各组(P<0.05)。Ⅲ组瘤胃内普雷沃菌_1(Prevotella_1)相对丰度最高,显著高于其他各组(P<0.05)。Ⅶ组瘤胃内毛螺菌科_NK3A20_群(Lachnospiraceae_NK3A20_group)相对丰度最高,显著高于其他各组(P<0.05),Ⅴ、Ⅵ和Ⅶ组瘤胃内鞘氨醇单胞菌属(Sphingomonas)相对丰度显著低于Ⅰ、Ⅱ组(P<0.05)。
3 讨 论
3.1 饲粮不同NFC/NDF对育肥藏羊生长性能的影响
相对于粗饲料,精料中的营养成分,诸如粗蛋白质、碳水化合物、粗脂肪等含量更为丰富[18]。本试验采用同种精饲料和粗饲料,通过改变其比例而实现试验饲粮不同精粗比及NFC/NDF。高NFC/NDF的饲粮中主要营养成分含量较高,从而能够提高藏羊的生长发育速度,并在NFC/NDF为2.69时达到最佳,说明添加70%精饲料能够充分满足机体的营养需求,但当饲粮NFC/NDF达到2.86时,生长速度却有降低的趋势,可能是过高的精料水平影响了饲粮的适口性,导致采食量降低,从而影响了其生长性能。
3.2 饲粮不同NFC/NDF对育肥藏羊瘤胃发酵参数的影响
NH3-N是瘤胃微生物生长代谢的重要氮源,其含量主要受饲粮粗蛋白质水平和蛋白质降解速率的影响[19]。本试验中,瘤胃内NH3-N含量随饲粮NFC/NDF增加有升高的趋势,说明饲粮NFC/NDF直接影响了饲粮中粗蛋白质水平,从而对藏羊瘤胃氮代谢过程中外源蛋白质和内源含氮物质降解产生的NH3-N含量造成影响。鲍宏云等[20]、娜仁花等[21]、Ma等[22]的研究结果均表明随随着饲粮中精料水平的升高,瘤胃内NH3-N含量显著上升,与本研究结果一致。TVFA是由饲粮中碳水化合物发酵所产生的,饲粮精料中的非结构性碳水化合物相较于粗饲料中的结构型糖类能够在瘤胃中迅速发酵[23]。本试验结果表明,饲粮NFC/NDF达到2.69时,TVFA含量最高,而饲粮NFC/NDF达到2.86时,TVFA含量反而下降,可能是由于非结构性碳水化合物含量过多影响了瘤胃微生物生长和定植,从而影响了瘤胃发酵。杨艳[24]等研究也发现,随精料水平的升高,牛瘤胃内TVFA含量呈现升后降的趋势,与本研究结果相似。乙酸、丙酸和丁酸是TVFA的主要组成成分,瘤胃内乙酸含量有随饲粮NFC/NDF的降低而升高的趋势,而丙酸含量呈相反趋势,说明采食纤维性碳水化合物有利于瘤胃发酵生成乙酸,而非结构性碳水化合物在瘤胃中发酵易形成丙酸[25];瘤胃内乙酸/丙酸是瘤胃发酵类型的标志,一般认为乙酸/丙酸高于3为乙酸型发酵[26]。本试验中,瘤胃内乙酸/丙酸有随饲粮NFC/NDF的降低而升高的趋势,说明饲粮NFC/NDF的降低使瘤胃发酵模式由丙酸发酵逐渐过渡为乙酸发酵。
3.3 饲粮不同NFC/NDF对育肥藏羊瘤胃真菌多样性的影响
付子琳等[27]研究表明,放牧组滩羊瘤胃真菌的相对丰度显著高于舍饲组。王彩蝶等[28]在绵羊上的研究证实,高浓度醋酸棉酚能促进瘤胃真菌的生长,随着饲喂时间的延长瘤胃真菌对高浓度的棉酚会产生一定的耐受性,使得瘤胃真菌重新达到动态平衡的状态。本试验中,饲粮NFC/NDF水平为2.69时,Ace指数较高,表明此时瘤胃真菌群落的相对丰度最高。
科水平上,被孢霉科和丛赤壳科为优势菌科,且高NFC/NDF饲粮组的丛赤壳科、隔孢伏革菌科和毛球壳科相对丰度低于低NFC/NDF饲粮组。前期研究发现,被孢霉科能够产生多不饱和脂肪酸,进而显著影响瘤胃发酵参数[29]。于伽等[30]在饲粮中添加多不饱和脂肪酸后发现,饲粮中精粗比为20∶80时适合瘤胃微生物的发酵。丛赤壳科在自然界通常以寄生或腐生的方式生存,一般寄生于衰退或即将死亡的动植物上,对维持微生物生态平衡发挥一定作用[31]。目前,瘤胃中曲霉科的功能尚无报道,但子囊菌门占比最高,结合子囊菌门的功能以及曲霉科的在其比例,我们推测曲霉科也有促进降解植物细胞壁、分解纤维素等难以降解的结构性碳水化合物的作用。
3.4 饲粮不同NFC/NDF对育肥藏羊瘤胃细菌多样性的影响
研究表明,瘤胃球菌属与纤维降解直接相关,其降解产生的短链脂肪酸可供宿主使用,因而其相对丰度理论上与饲粮精粗比有关[32]。在本试验中,瘤胃球菌科_NK4A214_群广泛存在于低NFC/NDF(1.88、1.63和1.43)组中,与上述研究结果一致。普雷沃菌属_1被证实为多糖降解菌属,尽管无法直接降解纤维素,却可以通过与纤维降解菌结合,进而高效降解木聚糖和果胶[33]。韩旭峰[34]以不同精粗比饲粮饲喂陕北绒山羊发现,高精料水平组瘤胃中普雷沃菌属_1的相对丰度显著高于低精料水平组。本试验证实,适宜的精料水平可促进普雷沃菌属_1生长,当NFC/NDF水平在2.42时普雷沃菌属_1相对丰度达到峰值,可能是由于含大量的低聚果糖以及淀粉物质的饲粮能够诱导普雷沃菌属_1的快速增长。
4 结 论
饲粮NFC/NDF对高原型育肥期藏羊生长发育、瘤胃挥发性脂肪酸含量以及微生物多样性有一定影响,当饲粮NFC/NDF为2.69时,不仅能够促进高原型藏羊生长发育,而且也能够促进瘤胃发酵并提高微生物多样性。
