云南省4个主栽马铃薯品种叶片内生细菌多样性研究
2022-01-10杨金睿王文倩李俊逸肖关丽
杨金睿,王文倩,王 玥,姚 遥,吉 泽,李俊逸,陈 斌,肖关丽
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.云南农业大学 植物保护学院,云南 昆明 650201)
内生菌(Endophyte)是指长期定殖于植物各种组织内但不引起该植物表观症状的一类微生物[1],包括内生细菌、真菌和放线菌,在各类植物中普遍存在[2],广泛分布于植物的各种组织和器官内。植物内生细菌能产生植物激素、自身固氮等直接参与促进植物生长,增强植物抵御病原菌侵染的能力[3],也可通过生成代谢产物或是借助信号转导途径来影响宿主的生长发育[4],也有一些内生细菌能通过生成某些功能性代谢物而提高宿主对环境的适应性[5]。此外,有些植物内生细菌的代谢产物对昆虫具有毒杀或抑制作用[6]。随着内生细菌在植物生物防治和生理生态方面作用的认识,植物内生细菌已成为国内外农业等多个领域研究的重点[7]。马铃薯作为云南省主要粮食作物之一,其种植面积和产量位居全国前列[8],且栽培品种较多,其中青薯9号、会-2、合作88和丽薯6号等为云南省马铃薯主栽品种。云南地形地貌复杂,环境多变,不同地区栽培品种不同,所受逆境胁迫、病虫害等危害也不相同,研究云南省主栽品种马铃薯叶片内生细菌的种类组成和差异,可为马铃薯内生菌资源及其与马铃薯互作关系研究提供理论依据。
当前研究报道的马铃薯内生细菌主要来自块茎,对于马铃薯叶片内生细菌研究与发掘鲜有报道,云南是我国马铃薯种植和产量大省,其主栽马铃薯品种叶片内生细菌种类多样性的研究尚处于空白阶段。本试验通过分子生物学鉴定并结合形态学鉴定的方法,对云南4个主栽马铃薯品种青薯9号、会-2、丽薯6号和合作88叶片内生细菌进行分离培养和种属鉴定,分析4个马铃薯品种叶片内生细菌种类组成的多样性和差异,为筛选抗虫、抗病原菌和抗旱等功能的内生细菌以及进一步应用于云南马铃薯生产奠定基础。
1 材料和方法
1.1 试验材料
供试马铃薯品种:采用青薯9号、会-2、合作88和丽薯6号一级种薯,均由云南省会泽县农技中心提供。
LB培养基:NaCl 10 g、酵母提取物5 g、胰蛋白胨10 g、琼脂20 g,蒸馏水1 000 mL,pH值调整为7.0~7.2[19]。
试剂及仪器:细菌通用引物27 F和1492 R、Taq PCR Mix 预混液(浓度为2×, 含蓝染料)、双蒸水(ddH2O)、绿色荧光核酸染料(上海生物工程股份有限公司);琼脂糖(广州赛国生物科技有限公司)。2-16R型离心机(湖南恒诺仪器设备有限公司);Mastercycler®nexus型PCR仪(德国Eppendorf公司);DYY-7C型电泳仪(北京六一生物科技有限公司)。
1.2 试验方法
1.2.1 样品采集与处理 4个品种均选用质量50 g左右并带2~3个芽眼,芽长0.5~1.0 cm,根据国标马铃薯种薯GB 18133-2012划分为一级种的优良种薯,并剔除具有病害、畸形等损伤的种薯。将挑选好的种薯种植于罩笼内花盆(口径:50 cm,高:50 cm),以防止害虫侵害。选用含沙量多、通气性能好的沙质土作为基质,所有品种栽培管理方法一致,每个品种种植10盆,放置于大棚中进行管理。待各品种生长至薯块发生期时(播种后50 d),从每个品种长势一致的植株中部展开复叶上剪取无病虫害侵害症状、完整、健康的叶片,每个品种选取5盆作为重复,取样后即放入密封袋并贴上标签,带回实验室进行内生菌的分离。
称取各品种新鲜马铃薯叶片自来水冲洗3~5次,叶片表面水分用无菌滤纸擦干,无菌水充分漂洗3次,75%的酒精充分浸泡1 min,无菌水再漂洗3次,3% NaClO溶液浸泡1 min,无菌水充分漂洗3次,75%酒精浸泡30 s,最后无菌水再漂洗3次[20]。把最后一次漂洗的无菌水涂布于LB培养基上作为空白对照,以验证叶片表面消毒是否彻底。
1.2.2 马铃薯叶片内生细菌的分离与培养 采用组织研磨法和组织切块法分离内生细菌[21]。
组织研磨法:取1 g表面消毒马铃薯叶片样品,用无菌剪刀剪碎放入无菌研钵,加适量无菌水研磨成匀浆状,吸取100 μL匀浆涂布于LB固体培养基上,5次重复。
组织切块法:将表面消毒好的叶片样品剪切为0.5 cm×0.5 cm的小块平放于LB固体培养基上,每个培养基上均匀放置5个小块,5次重复。
将上述LB培养基放置于(25±1)℃的恒温培养箱中培养72 h,每天8:00定时观察,及时挑取颜色形态不同的菌落于配置好的LB培养基上培养,再对菌落编号并统计各细菌菌落的数量,待完全纯化为单菌株后于4 ℃冰箱保存备用。统计每种菌株的数量后计算其相对多度,相对多度=某个种的株数/全部种的总株数×100%。
1.2.3 马铃薯内生细菌的菌种鉴定 细菌形态学鉴定:把分离纯化得到的菌株在LB培养基上划线培养,并参考《伯杰细菌鉴定手册》对其菌落颜色、形态和干湿程度等进行记录鉴定。并采用革兰氏染色法对各细菌染色,观察细菌细胞形态及其革兰氏阴阳性。
细菌分子鉴定:采用冻溶法提取内生细菌菌株基因组DNA[22]。具体过程为:从已纯化好菌株的LB平板上挑取适量单菌落加入装有500 μL无菌水的1.5 mL无菌离心管中,涡旋振荡1~2 min,使菌体和无菌水振荡混匀。再把混匀后装有菌液的离心管置于液氮中冰冻10 min,然后取出将其固定于漂浮盘上沸水水浴5 min,最后再12 000 r/min离心2 min,得到的上清液即可作为PCR模板备用。加入细菌16S rRNA基因扩增通用引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492 R(5′-GGTTACCTTGTTACGACTT-3′),反应体系为25 μL:引物各1 μL,模板DNA 1 μL,Taq PCR Mix 预混液(浓度为2×, 含蓝染料)12.5 μL,ddH2O 9.5 μL。PCR仪设置反应条件:94 ℃预变性5 min;94 ℃变性 1 min,53 ℃退火1 min,72 ℃延伸2 min,32个循环;72 ℃延伸10 min。取3 μL PCR产物进行凝胶电泳检测,检测合格的PCR产物由上海生物工程股份有限公司进行双向测序。
用Contigexpress软件对各菌株测序得到的2条序列进行校对、拼接,把拼接好的序列提交至NCBI查找相似度最高的典型菌株并下载序列。运行MEGA 7.0软件采用国际通用的邻位相连法(Neighbour-Joining)并设置Kimura′s 2-parameter模型构建系统发育树,重复抽样1 000次进行Bootstrap验证,分析系统进化树拓扑结构的稳定性。
2 结果与分析
2.1 4个马铃薯叶片内生细菌菌落形态及种类组成
从4个马铃薯品种叶片中共分离到内生细菌59株。青薯9号、会-2、合作88和丽薯6号分离到内生细菌分别是11,13,17和18株。根据各品种叶片内生细菌菌落形态、细胞形态特征和细菌种类组成,将其具体描述如表1。

表1 马铃薯叶片内生细菌菌落形态及种类组成Tab.1 Colony morphology and species composition of the endophytic bacteria in potato leaves
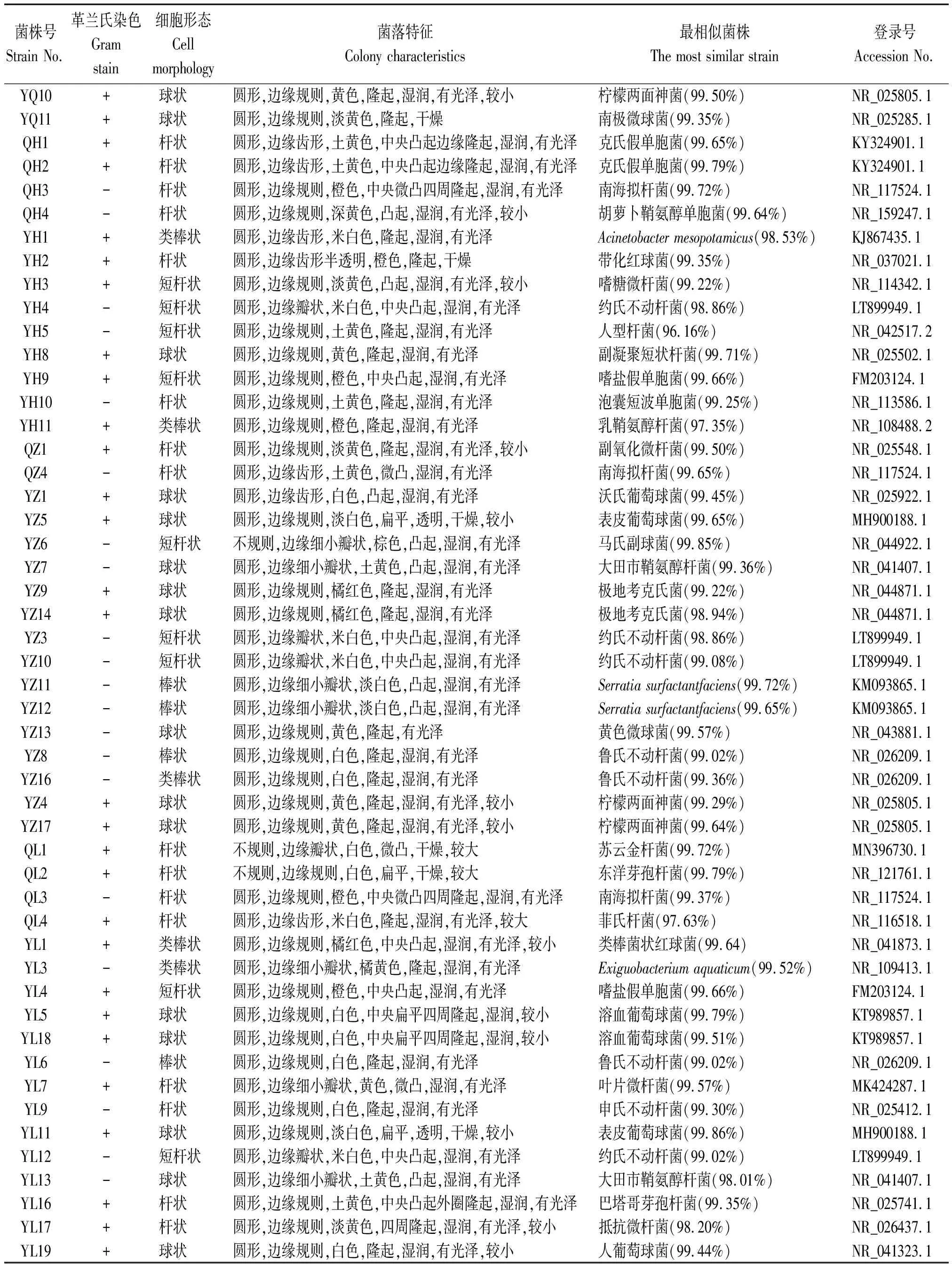
表1(续)
2.2 4个马铃薯品种叶片内生细菌的系统发育
青薯9号马铃薯叶片中内生细菌系统发育树由3个大支构成。第1大支由厚壁菌门来自葡萄球菌属、芽孢杆菌属、微小杆菌属的菌株构成;第2大支由放线菌门来自两面神菌属、考克氏菌属和微球菌属的菌株构成;第3大支由变形菌门来自假单胞菌属、短波单胞菌属和副球菌属的菌株构成(图1)。
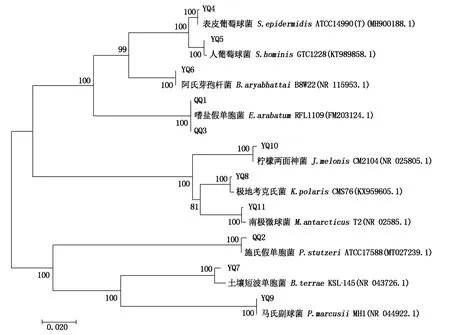
图1 基于16S rDNA序列青薯9号叶片内生细菌菌株的系统发育分析Fig.1 Phylogenetic analysis of the endophytic bacteria strains in Qingshu No.9 leaves based on 16S rDNA sequence
从系统发育树来看,考克氏菌属的菌株YQ8与微球菌属的菌株YQ11、短波单胞菌属的菌株YQ7和副球菌属的菌株YQ9分别聚为1小支,表明这些菌株之间亲缘关系较为相近。
会-2马铃薯叶片内生细菌系统发育树由4个大支构成。第1大支由变形菌门来自不动杆菌属、假单胞菌属、鞘氨醇单胞菌属、短波单胞菌属的菌株构成;第2大支由厚壁菌门来自虚构芽孢杆菌属、微小杆菌属的菌株构成;第3大支由放线菌门来自红球菌属、微杆菌属、短杆菌属的菌株构成;第4大支由拟杆菌门来自金黄色杆菌属、鞘氨醇杆菌属的菌株构成(图2)。
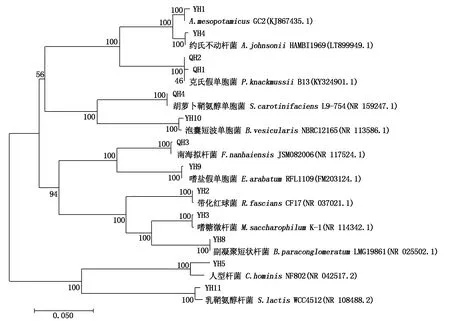
图2 基于16S rDNA序列会-2叶片内生细菌菌株的系统发育分析Fig.2 Phylogenetic analysis of the endophytic bacteria strains in Hui-2 leaves based on 16S rDNA sequence
从系统发育树来看,鞘氨醇单胞菌属的菌株QH4与短波单胞菌属的菌株YH10、微杆菌属的菌株YH3和短杆菌属的菌株YH8分别聚为1小支,表明这些不同属菌株之间的亲缘关系较为相近。
合作88马铃薯叶片内生细菌系统发育树由4个大支构成。第1大支由放线菌门来自两面神菌属、微杆菌属、微球菌属、考克氏菌属的菌株构成;第2大支由厚壁菌门来自虚构芽孢杆菌属、葡萄球菌属的菌株构成;第3大支由变形菌门来自副球菌属、沙雷氏菌属、不动杆菌属的菌株构成;第4大支由拟杆菌门来自鞘氨醇杆菌属的菌株单独构成(图3)。

图3 基于16S rDNA序列合作88叶片内生细菌菌株的系统发育分析Fig.3 Phylogenetic analysis of the endophytic bacteria strains in Hezuo No.88 leaves based on 16S rDNA sequence
从系统发育树来看,两面神菌属的菌株YZ17、YZ4和微杆菌属的菌株QZ1、微球菌属的菌株YZ13和考克氏菌属的菌株YZ9、YZ14分别聚为1小支,表明这些不同属菌株之间亲缘关系较为相近。
丽薯6号马铃薯叶片内生细菌系统发育树由4个大支构成。第1大支由厚壁菌门来自葡萄球菌属、芽孢杆菌属、虚构芽孢杆菌属、微小杆菌属的菌株构成;第2大支由放线菌门来自红球菌属、微杆菌属的菌株构成;第3大支由变形菌门来自不动杆菌属的菌株单独构成;第4大支由拟杆菌门来自鞘氨醇杆菌属的菌株单独构成(图4)。

图4 基于16S rDNA序列丽薯6号叶片内生细菌菌株的系统发育分析Fig.4 Phylogenetic analysis of the endophytic bacteria strains in Lishu No.6 leaves based on 16S rDNA sequence
从系统发育树来看,芽孢杆菌属的菌株YL16与虚构芽孢杆菌属的菌株QL3、QL4先聚为一支,而不是先与同一芽孢杆菌属的菌株QL1、QL2聚为1支,表明了即使同一个属中也存在不同种的菌株之间亲缘关系不相近的情况,而这些菌株可能与其他属的菌株亲缘关系更为接近。
2.3 4个马铃薯品种叶片内生细菌种类组成差异
从4个马铃薯品种叶片中分离培养获得可培养内生细菌37种。其中青薯9号马铃薯叶片中可培养细菌共3门8科9属10种,会-2叶片中可培养细菌共4门11科11属12种,合作88叶片中可培养细菌共4门9科10属13种,丽薯6号叶片中可培养细菌共4门7科8属17种。
从门级水平来看,4个马铃薯品种叶片分离到的内生细菌属于厚壁菌门、放线菌门、变形菌门和拟杆菌门。青薯9号叶片中可培养内生细菌属于厚壁菌门、放线菌门和变形菌门,其相对多度分别是45.45%,27.27%,27.27%。会-2叶片中可培养内生细菌属于厚壁菌门、放线菌门、变形菌门和拟杆菌门,其相对多度分别是15.38%,23.08%,46.15%,15.38%。合作88叶片中可培养内生细菌属于厚壁菌门、放线菌门、变形菌门和拟杆菌门,其相对多度分别是17.65%,35.29%,41.18%,5.88%。丽薯6号叶片中可培养内生细菌属于厚壁菌门、放线菌门、变形菌门和拟杆菌门,其相对多度分别是61.11%,16.67%,16.67%,5.56%。试验表明,厚壁菌门、放线菌门和变形菌门的细菌均占了4个品种中可培养细菌的绝大多数,为优势门类;拟杆菌门的细菌只在会-2、合作88和丽薯6号中存在,且相对多度均很小(图5)。

图5 4个马铃薯品种叶片内生细菌在门级水平上的相对多度Fig.5 Relative abundances of the endophytic bacteria at the phylum levels in four potato varieties leaves
从科级水平来看,4个马铃薯品种叶片共有的可培养内生细菌为芽孢杆菌科的菌株;耶尔森菌科的菌株仅在合作88叶片中获得,皮杆菌科、鞘脂单胞菌科、周蝶菌科的菌株仅在会-2叶片中获得。葡萄球菌科、微球菌科在青薯9号叶片中相对多度达到最高,均为18.18%;莫拉菌科和假单胞菌科在会-2叶片中相对多度达到最高,均为15.38%;莫拉菌科在合作88叶片中相对多度达到最高,为23.53%;芽孢杆菌科在丽薯6号叶片中相对多度达到最高,为27.78%(图6)。

图6 4个马铃薯品种叶片内生细菌在科级水平上的相对多度Fig.6 Relative abundances of the endophytic bacteria at the family levels in four potato varieties leaves
从属级水平来看,除沙雷氏菌属的菌株仅在合作88品种叶片中分离到,短杆菌属、鞘氨醇单胞菌属、金黄色杆菌属的菌株仅在会-2中获得之外,其他属的菌株均存在于2个或3个马铃薯品种叶片中。本研究从4个马铃薯品种叶片中共分离到18个属的细菌,葡萄球菌属和微小杆菌属是青薯9号的优势菌属,相对多度均为18.18%;不动杆菌属和假单胞菌属是会-2的优势菌属,相对多度均为15.38%;不动杆菌属是合作88的优势菌属,相对多度为23.53%;葡萄球菌属是丽薯6号的优势菌属,相对多度为22.22%(图7)。

图7 4个马铃薯品种叶片内生细菌在属级水平上的相对多度Fig.7 Relative abundances of the endophytic bacteria at the genera levels in four potato varieties leaves
3 讨论与结论
本研究从云南省4个主栽马铃薯品种青薯9号、会-2、合作88和丽薯6号叶片中分别分离培养获得内生细菌10,12,13,17种,均属于厚壁菌门、放线菌门、变形菌门和拟杆菌门细菌,与马铃薯块茎内生细菌门水平上组成有一定相似,如戴超[23]从山东省潍坊市的马铃薯块茎中分离获得11门50个属的内生细菌,主要为厚壁菌门、拟杆菌门、放线菌门和软壁菌门,其中厚壁菌门为最丰富的门类。Liu等[24]从内蒙古马铃薯块茎中分离到3门18属37种内生细菌,优势菌门为厚壁菌门、变形菌门。Sessitsch等[25]从奥地利马铃薯块茎中分离到内生细菌15属21种,优势菌门为变形菌门。除细菌门类组成外,从属的水平上来看其内生细菌组成与马铃薯块茎内生细菌也存在相同之处,如戴超[23]发现芽孢杆菌属是马铃薯块茎中内生细菌较为丰富的内生菌属,该属细菌也在本研究中青薯9号和丽薯6号分离培养到。其次,Sessitsch等[25]从成熟马铃薯块茎中分离到假单胞菌属和鞘氨醇单胞菌属细菌,本研究也从供试的马铃薯品种叶片中分离培养得到该2个菌属的菌株,而对于这2个属的细菌在马铃薯其他生育期是否同样存在还值得进一步探究。Liu等[24]从4 ℃冷藏保存的马铃薯块茎中分离到微杆菌属、红球菌属和短杆菌属细菌,本研究中从合作88、会-2和丽薯6号马铃薯叶片中也分离到这3个菌属的细菌,因此,马铃薯叶片中的这些内生细菌有可能在低温响应中发挥着重要作用,从而适应4 ℃或更低温度的胁迫,这也将是进一步深入研究的内容。此外,不同内生细菌分离方法分离到的细菌种类和数量也存在差异。本研究采用组织研磨法和组织切块法分离马铃薯叶片内生细菌。组织研磨法是对马铃薯叶片组织进行充分研磨并涂布于LB培养基上;其优点在于能使叶片中的内生细菌充分与培养基接触,进而分离到更多的可培养内生细菌,但也容易在研磨和涂布过程中因操作处理时间较长而损失部分内生细菌。组织切块法则将表面消毒好的叶片组织剪成小块,使组织块切面与培养基表面接触,一定时间后内生菌沿切面长出;该方法相对简便易行,操作时间短,且沿切面长出的菌生长快,适应性强,但因菌落只能沿切面长出,导致该方法分离出的细菌数量较少。因此,本研究采用2种方法相结合,使其尽可能分离到更多的可培养内生细菌。
本研究发现,云南省4个主栽马铃薯品种叶片中分离到的内生细菌多数为厚壁菌门和变形菌门,这2个门类的细菌同时也广泛存在于取食马铃薯的寡食性害虫马铃薯块茎蛾幼虫肠道中[26]。从属和种水平上来看,虽然各马铃薯品种叶片中可培养内生细菌的种类组成和丰度存在差异,即不同品种的优势菌属和细菌种类不同,但是从4个马铃薯品种中分离到的部分菌属,如微杆菌属、肠杆菌属、芽孢杆菌属和假单孢菌属等的菌株也存在于很多不同种类植物中[27-28];沙雷氏菌属、假单胞菌属、微杆菌属、芽孢杆菌属和葡萄球菌属的细菌则是当前应用较多的生防及促生细菌,具有调节植物内源激素水平、抑制植物病原菌和抵御虫害等的作用[28-30]。因此,本研究供试马铃薯品种叶片中存在的沙雷氏菌属、假单胞菌属、微杆菌属、芽孢杆菌属和葡萄球菌属的内生细菌,可能就是不同马铃薯品种在生长发育、抗病虫害和抗逆等方面存在差异的重要原因之一。
植物内生菌在植物生长发育以及对环境的适应性中发挥着重要作用,不同内生菌所具有的生理功能也不相同[31],如Kocuriapolaris具有异养氨氧化降解氮素的作用[32],南极微球菌能产生低温淀粉酶降解和转化有机污染物[33],克氏假单胞菌能增强拟南芥耐盐性[34],带化红球菌能通过影响植物细胞分裂素的代谢增强糖和氨基酸转运蛋白和细胞壁转化酶的表达[35],约氏不动杆菌能够对重要的环境污染物萘进行生物降解[36],副凝聚短状杆菌可以增强作物对盐分胁迫的耐受性[37],Serratiasurfactantfaciens能通过次级代谢产物对各种病原细菌和真菌产生强大的抗菌活性[38],东洋芽孢杆菌通过增加对氧化应激的保护达到促进植物生长的作用[39],嗜盐假单胞菌能通过其分泌蛋白调控养分吸收和代谢[40],这些种类细菌也在供试的4个马铃薯品种中被分离到。然而,本研究供试马铃薯叶片中的上述细菌在马铃薯生长发育及抗逆方面是否也具有类似功能,有待进一步研究验证。
此外,本研究仅是对云南省4个主栽马铃薯品种合作88、会-2、丽薯6号和青薯9号薯块发生期马铃薯叶片可培养内生细菌分离鉴定及其种类组成结构进行分析,而对于这些品种马铃薯块茎中内生细菌组成结构同样也值得研究,以弄清云南省4个主栽马铃薯品种内生细菌组成结构及多样性,从而为系统研究马铃薯通过内生细菌介导其抗逆性及抗逆机理研究提供理论依据。
云南省4个主栽马铃薯品种青薯9号、会-2、合作88和丽薯6号叶片内生细菌丰富,各品种叶片内生细菌种类组成有明显差异,每个品种均有其特有内生菌种类,但部分不同马铃薯品种间也存在相同菌属和种类的内生细菌。该结果可为研究马铃薯内生菌多样性及其抗虫、抗病和抗旱等抗性功能内生菌筛选提供依据。
