大白菜抗干烧心病分子标记的开发与验证
2022-01-10徐莹莉王超楠黄志银范伟强
张 红,徐莹莉,王超楠,黄志银,范伟强,李 梅,张 斌
(1.天津科润蔬菜研究所,蔬菜种质创新国家重点实验室,天津市蔬菜遗传育种企业重点实验室,天津 300381;2.天津市农业科学院 蔬菜研究所,天津 300384)
大白菜(BrassicarapaL.ssp.pekinensis)是一种两年生叶用蔬菜,隶属十字花科芸薹属芸薹种,其最早源于我国,并在我国栽培历史久远,属于目前我国蔬菜栽培中分布最广、种植面积最大的蔬菜作物之一。据不完全统计,中国每年大白菜的播种面积约达266.7 万hm2,占蔬菜总播种面积的15%左右[1],产值超过600亿元,是我国的主要出口创汇蔬菜之一。但近年来在大白菜栽培中由于土壤缺钙或栽培管理不当等因素的影响下,一种白菜的生理性病害-干烧心病频发且呈现日趋严重的趋势,俨然已成为继三大病害之后,又一严重阻碍大白菜生产的病害之一。该病发病后于外表难以察觉,但剖开后内部球叶呈现“夹叶烂”现象,对大白菜的产量及其结球品质均造成极大影响,严重的甚至导致品种完全丧失商品性,进而损害农户的利益。
在实际栽培中对常见病害的防治措施主要分为3种,即物理防治、化学防治和抗病育种防治[2-6]。干烧心病是由缺钙引起的生理性病害,属于不可逆的生理紊乱,农耕等物理防治无法有效控制干烧心的发生,且改变复杂的栽培环境难度较大,使用化学药剂防治成本高且易导致农业环境污染,相较而言,抗病育种无疑是最经济、有效、环保的预防措施。但采用传统的育种方法培育抗病品种,选育周期相对较长,耗费人力地力,且大白菜干烧心病受环境影响较大,因此,单纯依靠主观经验和田间观察来筛选育种材料会相对困难。随着分子生物学的发展,将表型鉴定与分子鉴定相结合来探究干烧心病抗病遗传规律,挖掘相关的抗病基因,开发连锁紧密的分子标记,进而选育性状优良的抗病品种显然是开展干烧心抗病育种的最佳途径。本试验探究了青麻叶H227中抗干烧心基因的遗传规律,并设计开发了紧密连锁的抗干烧心病分子标记,同时结合F2及BC1F1的表型鉴定结果验证了标记的适应性,既为抗病筛选提供了有效工具,也为今后开展干烧心病的高效抗病育种奠定了基础。
1 材料和方法
1.1 试验材料及分子标记
以白麻叶大白菜的高代自交系G83作为干烧心感病亲本和轮回亲本,青麻叶H227作为抗病亲本,两亲本材料均经过3 a以上的田间表型严格筛选获得,干烧心病抗感差异显著。同步构建200株样本量的F2群体和100株样本量的BC1F1群体,材料均由天津科润蔬菜研究所提供。
分子标记基于已发表的抗干烧心分子标记文章[7-13]和大白菜基因组数据库。引物由华大基因公司合成。
1.2 大白菜干烧心病表型鉴定方法
大白菜的室内鉴定方法采用离体叶片扦插法[14-16],即:将花泥均匀打孔,待大白菜生长至五叶期时,采集植株自生长点起的第2片真叶。用2% NaClO对离体叶片的叶柄消毒5 s,再用蒸馏水冲洗2遍。消毒后的叶片插入浸满鉴定液(2 mmol/L EDTA-Na2,10 mg/L GA3(pH=6.0))的花泥中(图1)。

图1 大白菜干烧心病离体扦插鉴定Fig.1 Identification of Chinese cabbage dry burning heart disease in vitro cuttings
室温下放置3 h后即转入25 ℃人工气候培养箱中,暗培养48 h后统计观察每个叶片枯边程度及1个视野中小黑点数。试验重复3次,选取稳定表型进行统计。
白菜干烧心病病情调查方法和分级标准参考金秀卿等[7]所述,划分为5个等级(表1),按照0~7级标准评价单株发病情况(图2),再对病情分级加以整理,采用SPSS软件对数据进行统计分析,计算遗传参数并绘制频数分布直方图。

表1 大白菜干烧心病病情分级标准Tab.1 The grade standards of dry burning heart disease symptoms in Chinese cabbage

图2 大白菜干烧心病离体叶片的病情分级标准Fig.2 The disease grading standard of isolated leaves of Chinese cabbage with dry burning heart disease
1.3 大白菜干烧心病的分子鉴定方法
采用改良后的碱裂解法[17]批量提取亲本、F1、F2等待测大白菜基因组的DNA,利用分光光度计的OD260/280值对提取得到的大白菜基因组DNA质量进行评价。DNA呈现明显单峰曲线,且OD260/280值介于1.8~2.0,表明DNA质量较好。合格的DNA样品浓度即可统一稀释到50 ng/μL,-20 ℃保存备用或采用10 μL的PCR反应体系进行扩增,扩增产物通过8% 非变性聚丙烯酰胺凝胶电泳和快速显影法即可统计检测电泳条带多态性。
基于上述表型鉴定及分子鉴定方法,利用Join Map 4.0软件整理统计数据,将LOD设定为3.0,分析目标基因与分子标记间的连锁关系,构建连锁图谱,完成基因的初步定位,并在定位区间内开发筛选与目标基因紧密连锁的分子标记。
2 结果与分析
2.1 大白菜干烧心室内表型鉴定结果与遗传学分析
利用离体叶片扦插法对干烧心抗感亲本H227和G83以及F1、F2群体,BC1F1群体进行表型鉴定,根据表2的病情分级标准,观察小黑点和枯边性状在各单株中的表现情况,通过室内表型的统计结果(表2)并利用病情级数绘制频率分布直方图(图3),发现H227和G83构建的F1趋向于抗病,F2群体和BC1F1群体病情分级呈现出明显的单峰分布,接近于正态分布,因此,分析大白菜干烧心抗病遗传规律为数量性状遗传,与金秀卿等[7]的结论相符合。

表2 大白菜干烧心病室内表型鉴定统计结果Tab.2 Statistical results of laboratory phenotypic identification of dry burning heart disease in Chinese cabbage
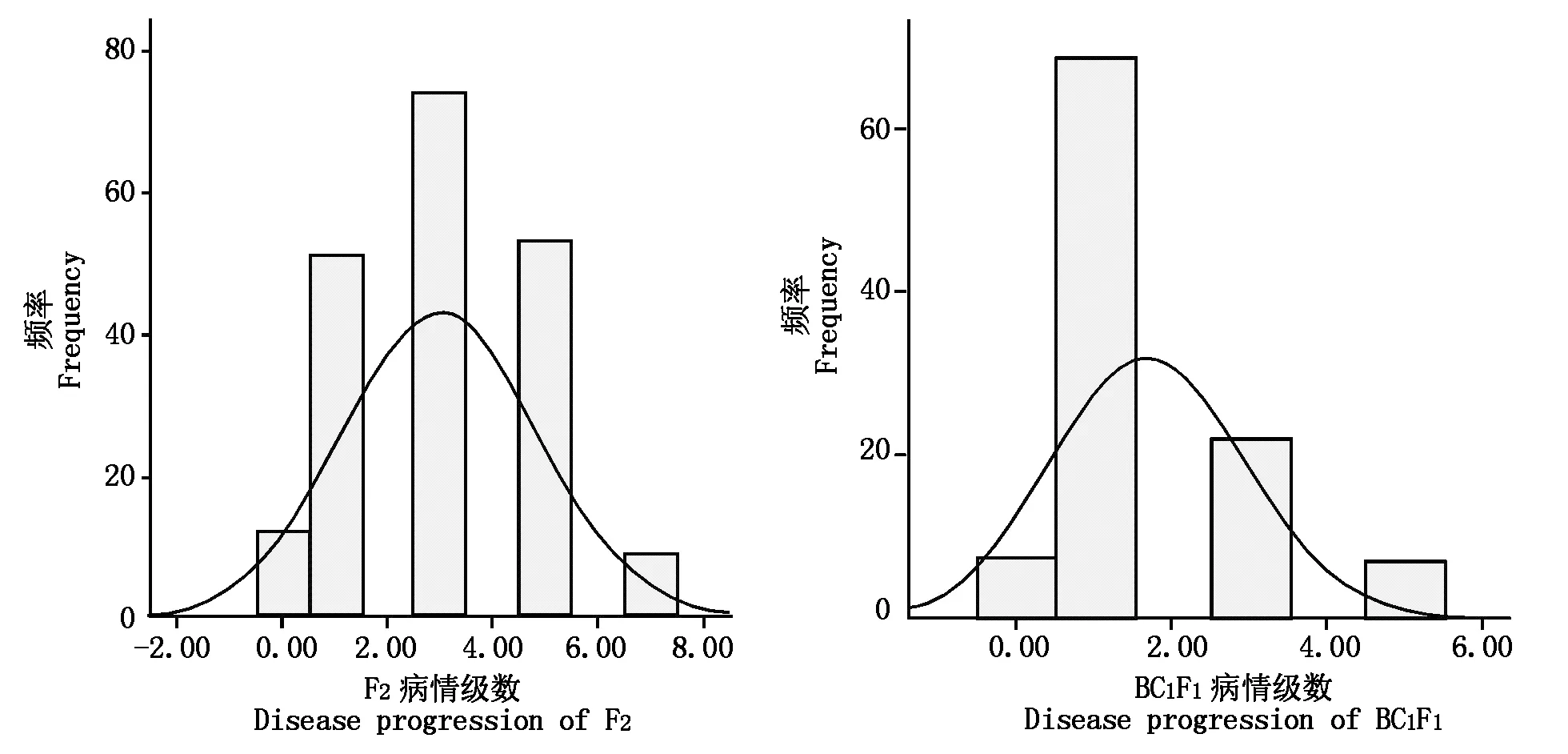
图3 大白菜干烧心病病情级数在F2和BC1F1中的频率分布Fig.3 Frequency distribution of the dry burning heart diseaseprogression of Chinese cabbage in the F2 and BC1F1 generations
2.2 干烧心病抗性基因分子标记的开发
根据室内表型鉴定结果,从F2分离群体中选择极抗(0级)和极感(7级)各12株构建抗感池。天津科润蔬菜研究所大白菜课题组前期开展了大量干烧心病相关研究,金秀卿[18]针对干烧心抗感双亲H227和B120构建了DH群体,结合2 a的田间干烧心表型鉴定数据,利用MapQTL 5.0软件进行了QTL分析,初步获得了贡献率大于10%的主效QTL位点,且位点位于A07染色体上,得到与抗干烧心病共分离的分子标记BrID10343和紧密连锁的标记BrID10349,因此,试验首先基于前期试验基础及已公布的抗干烧心分子标记在本试验父母本及F1间进行多态性验证,结果发现标记在本试验双亲间缺乏多态性,分析可能标记与基因的连锁性稍差,需继续对大白菜基因组开展分子标记筛选(图4)。

图4 分子标记BrID10343对B120、H227、G83的电泳检测Fig.4 Detection results of molecular marker BrID10343 on B120,H227,G83
首先确定抗病基因的染色体位置,根据大白菜基因组数据库(http://brassicadb.cn/)的信息,选择平均分布于10条染色体上的30对分子标记在双亲H227和G83及F1间进行多态性分子标记的初步筛选,结果仅在A07染色体上获得1对分子标记BrID101105具有多态性,多态性标记在24株极端抗感池验证,仍表现稳定多态性。表明试验材料H227的抗源基因的确位于A07染色体上,与金秀卿等[7]的染色体定位结果相符(图5)。

图5 多态性分子标记的筛选Fig.5 Screening of polymorphic molecular markers
根据A07染色体上的大白菜序列信息,参考标记BrID10343、BrID10349及多态性标记BrID101105的位置,瞄定在物理区间25~27 cM设计紧密连锁的分子标记,利用Primer Primier 5.0软件开发设计引物4对(表3),将新设计的引物在双亲、F1和极端抗感池中进行筛选验证,结果发现,分子标记BrIDCRT07具有稳定多态性。采用JoinMap 4.0和Mapchart软件对BrID10343、BrID10349、BrIDCRT07等标记构建遗传图谱(图6),显示该分子标记介于BrID10343 和BrID10349之间,与BrID10343的遗传距离为0.13 cM,与BrID10349的遗传距离为0.78 cM。

图6 分子标记BrIDCRT07在A07染色体上的遗传位置Fig.6 Genetic location of the molecular marker BrIDCRT07 on the A07 chromosome

表3 干烧心病引物序列信息Tab.3 Molecular marker sequence information of dry burning heart disease
2.3 干烧心病抗性基因分子标记的验证
利用离体叶片扦插法和新设计的连锁标记BrIDCRT07对F2群体及BC1F1群体分别进行分子鉴定和表型鉴定,结果如表4,5,F2群体内各单株的分子鉴定与表型鉴定统计结果基本一致,吻合率可达86.8%,BC1F1群体内分子鉴定与表型鉴定统计结果吻合率可达94.9%,表明该分子标记今后可用于抗病材料H227抗病基因的筛选。
3 结论与讨论
天津青麻叶类型是我国大白菜家族中一个具有代表性的类型,属于天津特有的类型,本课题组多年的田间调查也发现青麻叶大白菜不仅自身优良性状众多,对干烧心病也具有稳定的抗性,因此,适于作为抗原材料研究。

表4 F2干烧心病分子鉴定和表型鉴定Tab.4 Molecular identification and phenotypic identification of F2 dry burning heart disease
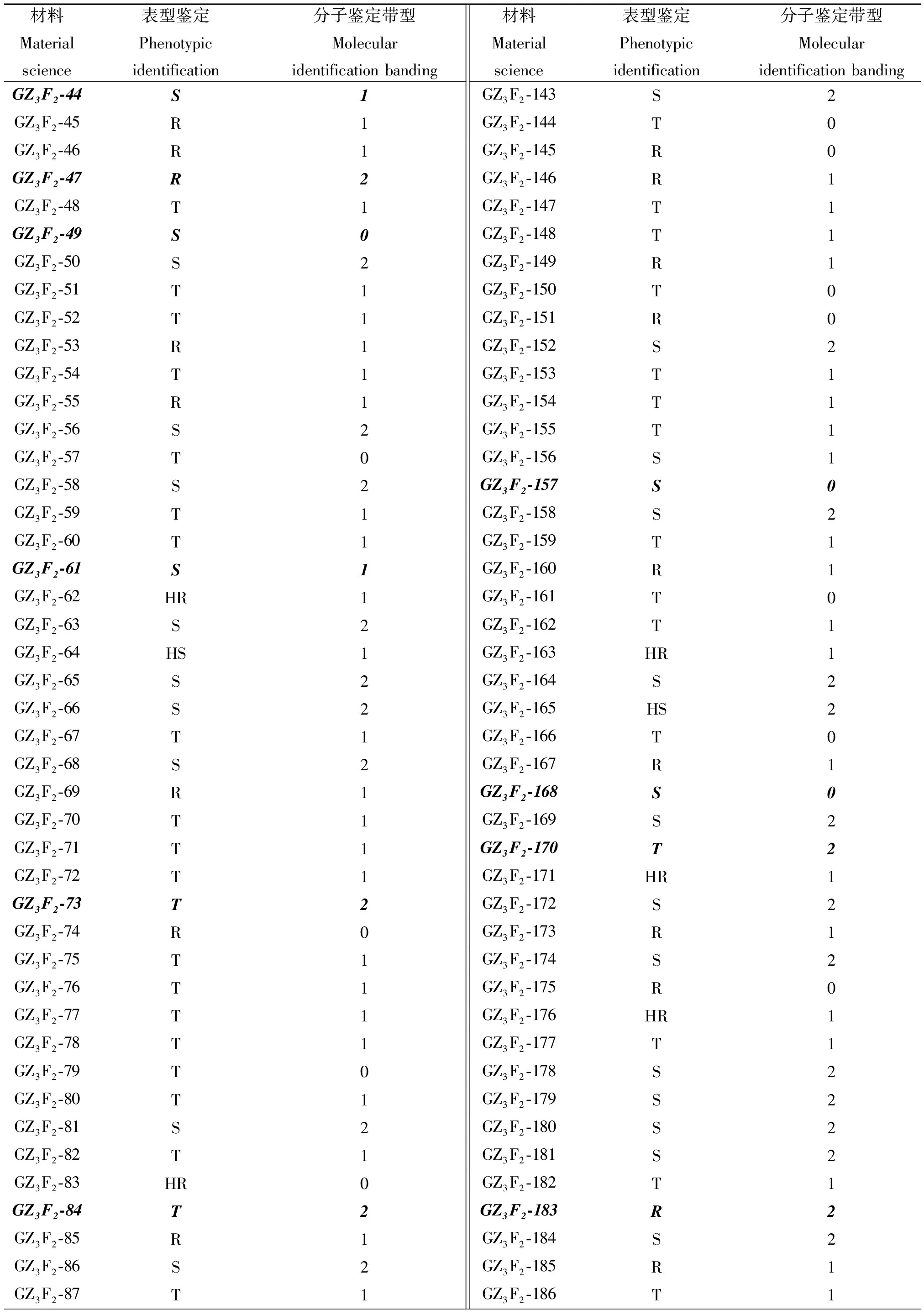
表4(续)

表4(续)

表5 BC1F1干烧心病分子鉴定和表型鉴定Tab.5 Comparison of in vitro cutting and molecular identification results of BC1F1 dry burning heart

表5(续)
本研究利用纯合抗干烧心病的青麻叶骨干系材料H227作为母本,感病的白麻叶材料G83作为父本和轮回亲本,分别构建F2及BC1F1群体,为了解遗传特征,采用离体叶片溶液扦插法作为干烧心病表型鉴定方法,进行了重复试验,经统计学分析发现,病情级数的频数分布表现出明显的单峰分布,接近于正态分布,遗传规律表现为数量性状遗传特征,获得的结果与前人[19-20]的研究结果一致。
而自1946 年Shafer 等首次报道大白菜干烧病的症状表现及病因以来,国内外学者针对此病开展了大量研究,也普遍认为干烧心病受到多基因控制[9-10],抗病育种研究相对复杂。本研究相对金秀卿等[7]对干烧心基因采取的QTL定位方式不同,首次将植物中复杂的数量性状通过分级转化为简单的质量性状进行考虑分析,以F2和BC1F1作为定位和验证群体,定向定位并开发了相对连锁的分子标记,标记普遍适用于本试验双亲所构建的回交后代,可以为大白菜干烧心抗病育种提供有力的筛选工具。
但考虑到不同类型不同品种间抗病基因或抗病性会存在一定的差异[6-8]。若试验材料改变,可能会导致现有标记的通用性降低,例如在开发多态性标记过程中,本试验基于前人[7]对同一抗病亲本H227所开发标记BrID10343 和 BrID10349进行多态性验证,发现标记在抗感亲本H227和G83中不具有多态性。可能由于前人的标记与抗性基因之间的连锁尚不够紧密,标记的通用性有限,因此,在应用分子标记辅助育种时首先进行通用性的验证十分必要。下一步也将对标记的通用性持续进行验证,并在本试验基础上不断开发更紧密连锁的分子标记。
