基于网络药理学研究莲子心化学成分防治阿尔茨海默病的作用机制
2022-01-10孟雪莲刘晓娜陈长兰
孟雪莲,刘晓娜,张 欣,陈长兰
(辽宁大学 药学院,辽宁 沈阳 110036)
0 引言
莲子心是《中国药典》收录的草药,药用来源为睡莲科植物莲(NelumbonuciferaGaertn)的成熟种子中间的绿色胚芽[1],从莲子心中分离的活性成分有类黄酮、萜类、类固醇、糖苷和生物碱等,尤其是苄基异喹啉生物碱(BIA)是莲子心生物碱的主要生物活性成分.现代药理学对莲子心的研究主要集中在其抗癌、降压、抗心律失常、抗氧化、抗自由基、抗纤维化、抗糖尿病、神经保护、抗炎等方面[2-6].
阿尔茨海默病(AD)是一种不可逆的进行性神经退行性疾病.AD是全世界痴呆的最常见原因,并且其发病率随着人口老龄化而增加.AD的主要病理学特征是Aβ斑块的细胞外聚集和神经原纤维缠结(Neurofibrillary Tangles)的细胞内聚集,导致神经元功能障碍[7-10].目前尚无治愈阿尔茨海默病的方法.
基于系统生物学理论的网络药理学是一门新兴学科,旨在分析生物网络并筛选出特别感兴趣的节点,以设计多靶点药物分子[11].中医的整体理念与新兴的网络药理学和网络生物学的关键思想有很多共同点,网络药理学是最近已应用于防治诸如癌症、AD等复杂疾病的中医药研究[12].为了预测中药化合物的靶标特征和药理作用,揭示药物-基因-疾病共模块关联,以高通量方式从中草药配方中筛选出协同多化合物,并解释草药配方的组合规则和网络调节效果,当前的研究模式发生了改变,从“一种靶标,一种药物”模式更新为“网络靶标,多组分”模式,建立了一种新颖的中药网络药理方法[13-14].这些研究表明,中医网络药理学方法为中医从经验医学到循证医学系统的转化提供了新的研究范式,这将加速中医药物的发现,并改善当前的药物发现策略[15].因此本研究通过网络药理学来研究莲子心化学成分防治阿尔茨海默病的作用机制,初步探究其抗阿尔茨海默病的药效物质及其潜在的作用靶点和作用通路,为之后的实验验证提供理论依据.
1 实验用数据库及软件
本研究所用的数据库及软件见表1.

表1 实验用数据库及软件
2 实验方法
2.1 数据库构建
2.1.1 构建莲子心化学成分相关靶点数据库
以“LIAN ZI XIN”“NelumbonuciferaGaertn”为关键词,在TCMSP[16]、BATMAN-TCM数据库[17]中检索莲子心的化学成分.以生物利用度(OB)≥30%,类药性(DL)≥0.18为筛选条件,以便筛选出口服利用度高的化学成分作为研究对象[18].利用PubChem数据库得到化学成分的Canonical Smile号,将Canonical Smile号导入Swiss Target Prediction数据库[19]中,选择人类(Homo sapiens)作为研究物种,预测得到相关的潜在作用靶点,合并多个化学成分的搜索结果,去除重复项,得到莲子心化学成分相关靶点数据库.
2.1.2 构建阿尔茨海默病相关靶点数据库
以阿尔茨海默病常用的英文表达方式“Alzheimer′s disease”为关键词在Gene Cards 数据库中搜索,查找与阿尔茨海默病相关的基因,得到阿尔茨海默病的8 718个相关潜在基因靶点.
2.1.3 构建“药物成分-疾病”交集靶点数据库
分别将2.1.1构建得到的莲子心生物碱化学成分相关靶点数据库与2.1.2构建得到的阿尔茨海默病相关靶点数据库导入到Venny2.1.0软件中,取两者交集,得到“药物成分-疾病”交集靶点数据库.
2.2 构建蛋白相互作用(PPI)网络
将2.1.3构建得到的交集靶点导入String 数据库,选取人类(Homo sapiens)为研究物种,设置置信度为0.95,以确保数据的可靠性,保存结果.将结果中的node 1、node 2以及结合分数(Combined score)等信息导入到Cytoscape 3.7.2软件中构建蛋白相互作用网络.
2.3 京都基因与基因组百科全书(KEGG)通路富集分析
打开DAVID数据库,选择6.7版本,将2.1.3得到的交集靶点导入DAVID数据库中,选择Identifier为Office gene symbol,选择List Type为Gene list,选取人类(Homo sapiens)为研究物种,选择Pathways下的KEGG_PATHWAY进行KEGG分析,设置阈值P<0.05,筛选排名靠前的通路,利用Omishare Tools 对结果进行可视化处理.
2.4 构建“药物成分-交集靶点-作用通路”网络
在KEGG分析中,筛选具有统计学意义(P<0.01)的通路,得到关键核心靶标参与的关键通路,将上述莲子心的化学成分、“药物成分-疾病”交集靶点、通路分析、阿尔茨海默病在Excel中分别建立成分-靶点、靶点-通路、通路-疾病之间的对应关系,导入到Cytoscape 3.7.2中,构建“药物成分-交集靶点-作用通路”网络图.
3 实验结果
3.1 构建“药物成分-疾病”交集靶点数据库
3.1.1 构建莲子心化学成分相关靶点数据库
将筛选后得到的莲子心中13种化学成分(图1)的Canonical Smile号导入Swiss Target Prediction数据库中,选择人类(Homo sapiens)作为研究物种,预测得到相关的潜在作用靶点.将13种化学成分的相关潜在作用靶点合并,去重复后最终得到95个莲子心化学成分相关潜在作用靶点.对“13种活性化合物-化合物靶标”网络的总体特征进行分析(图2),发现13种活性成分既存在一个化合物与多个靶蛋白结合的作用,也存在多个化合物与同一个靶蛋白相互作用的现象,表明莲子心抗阿尔茨海默病作用存在多活性成分、多靶标的作用特点.
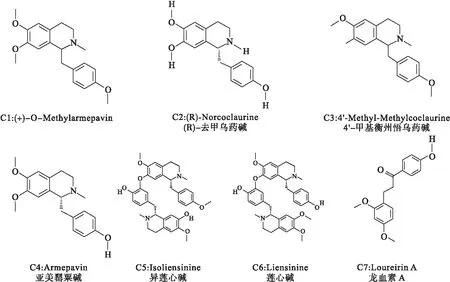
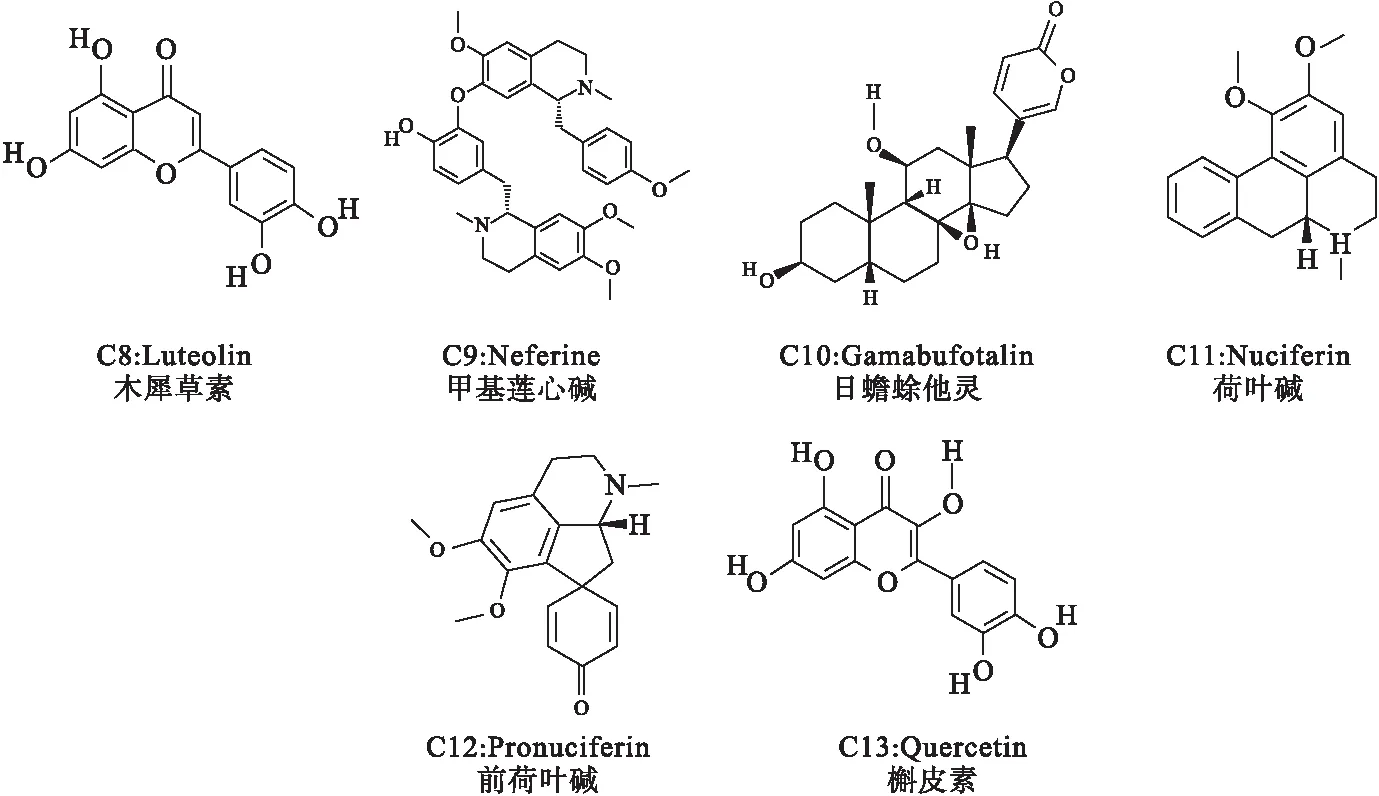
图1 莲子心中筛选出的13种化学成分
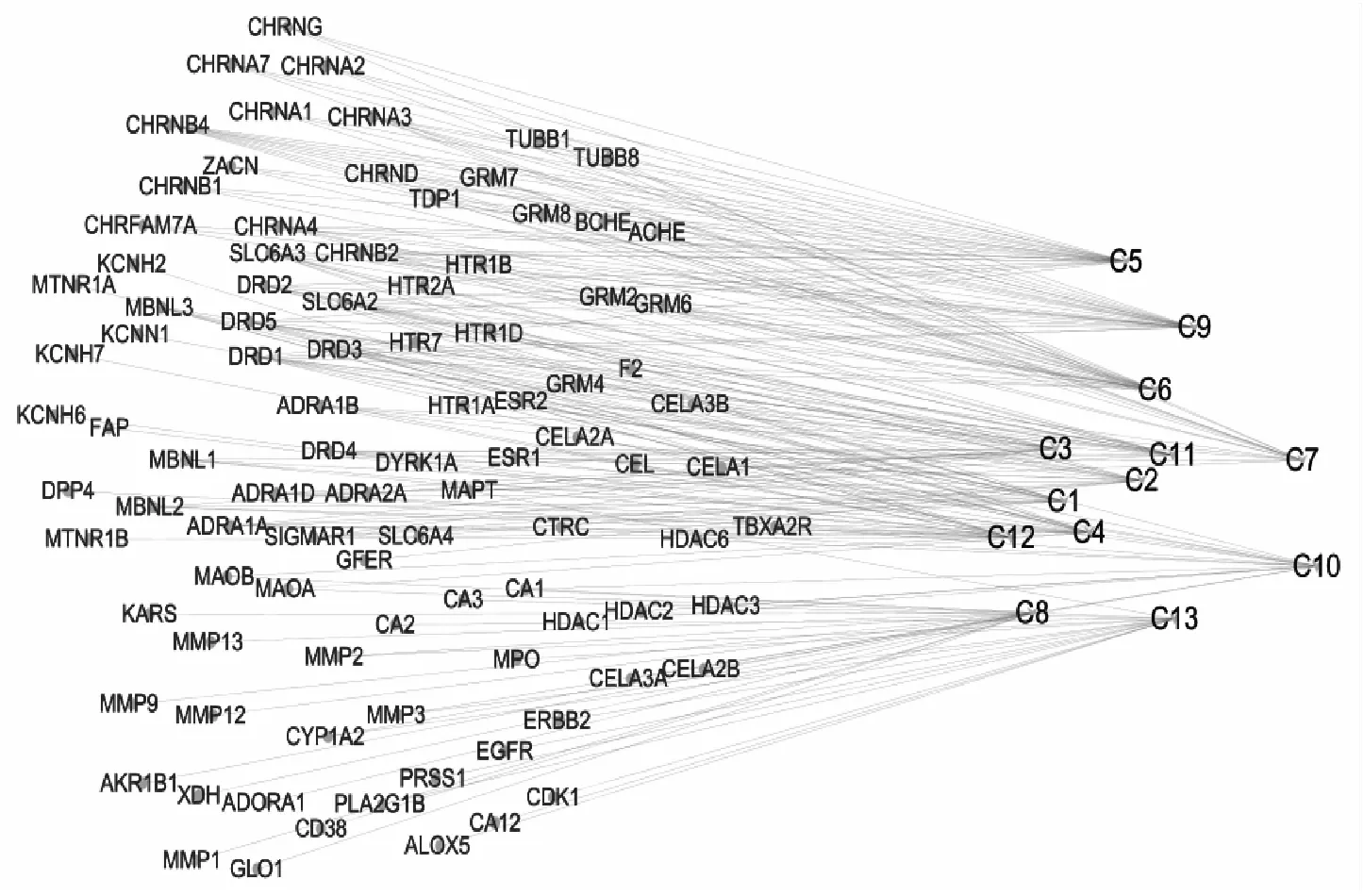
图2 “13种活性化合物-化合物靶标”网络
3.1.2 构建阿尔茨海默病相关靶点数据库
以阿尔茨海默病常用的英文表达方式“Alzheimer′s disease”为关键词在Gene Cards 数据库中搜索,查找与阿尔茨海默病相关的基因,得到阿尔茨海默病的8 718个相关潜在基因靶点(图3).
3.1.3 构建“药物成分-疾病”交集靶点数据库
分别将3.1.1构建得到的莲子心生物碱化学成分相关靶点数据库与3.1.2构建得到的阿尔茨海默病相关靶点数据库导入到Venny2.1.0软件中,取两者交集,得到“药物成分-疾病”交集靶点数据库(图3).分析发现,13种药物成分相关靶点(95个靶点)与阿尔茨海默病相关靶点(8 718个靶点)之间有73个交集靶点.
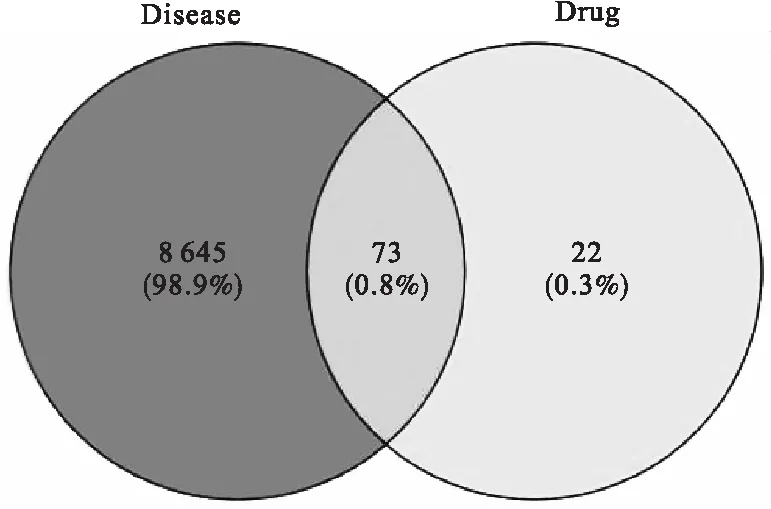
图3 13种药物成分相关靶点与阿尔茨海默病疾病相关靶点的交集靶点数
3.2 构建蛋白相互作用(PPI)网络
将73个“药物成分-疾病”交集靶点输入到String数据库中,选取物种为人类(Homo sapiens),筛选置信区间大于0.95的靶点,得到23个“药物成分-疾病”交集靶点之间的蛋白相互作用信息.将String数据库导出的靶点蛋白相互作用关系数据(node1、node2、combined score)导入到Cytoscape 3.7.2软件中构建蛋白相互作用(PPI)网络图(图4),同时利用Cytoscape3.7.2软件的内置插件Network Analyzer plugin进行网络拓扑参数分析计算.结果表明,GRM2(代谢性谷氨酸受体2)、HDAC1(组蛋白去乙酰酶1)、CHRNB4(神经乙酰胆碱受体β4)、CHRNB2(神经乙酰胆碱受体β2)为度值排名前4的靶点蛋白,为4个关键靶点.
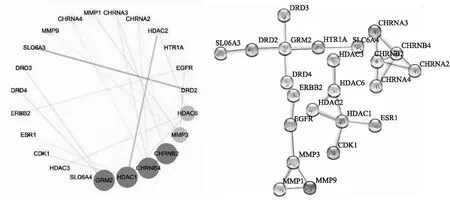
……图4 “药物成分-疾病”交集靶点蛋白相互作用(PPI)网络图
3.3 京都基因与基因组百科全书(KEGG)通路富集分析
将73个“药物成分-疾病”交集靶点输入到DAVID数据库中进行KEGG通路富集分析.通过KEGG分析富集到莲子心13种化学成分与50个关键核心靶标相关,这50个靶点相关的基因通路共20条,其中,具有显著意义的(P<0.01)有11条通路(表2).将KEGG信号通路按P值进行排序,绘制气泡图(图5).由表2和图5可见,莲子心中13种关键化学成分抗阿尔茨海默病的潜在作用途径主要包括神经活动配体-受体相互作用通路、5-羟色胺能突触信号通路、钙离子信号通路等.其中“神经活动配体-受体相互作用通路”涉及的化合物作用靶标最多(30个),该通路可能为莲子心活性成分抗阿尔茨海默病作用的关键通路.

表2 莲子心化学成分防治阿尔茨海默病作用靶点的KEGG通路分析
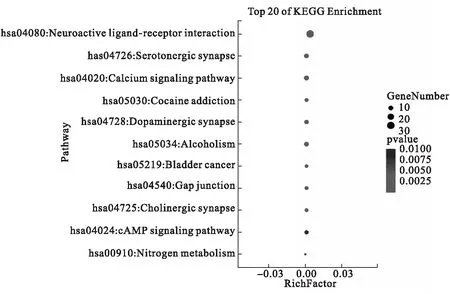
图5 莲子心化学成分防治阿尔茨海默病作用靶点的KEGG富集气泡图
3.4 构建“药物成分-交集靶点-作用通路”网络
在KEGG分析中,共得到20条通路,选取其中具有统计学意义的(P<0.01)通路,最终得到13个活性化合物与50个关键核心靶标相关,参与的关键通路11条.
利用Cytoscape 3.7.2软件构建了“药物成分-交集靶点-作用通路”网络模型图(图6)并用Cytoscape 3.7.2软件中的内置插件Network Analyzer进行分析(表3).该网络中有75个节点(包括1个药材、13个化学成分、50个交集靶点、11条通路和1个疾病)和282条边.图中八边形代表阿尔茨海默病疾病,三角形代表作用通路,椭圆形代表“药物成分-疾病”交集靶点,四边形代表莲子心中的化学成分,度值(Degree)越大表明与之相连的节点数越多,在整个网络中调控作用越大.结果表明,度值较大的化学成分有C9(甲基莲心碱,17)、C6(莲心碱,17)、C5(异莲心碱,16)等.度值较大的靶点蛋白有DRD1(多巴胺受体D1)、DRD2(多巴胺受体D2)、DRD5(多巴胺受体D5)等,可能是莲子心干预阿尔茨海默病的作用靶点.这些靶点涉及的通路有Neuroactive ligand-receptor interaction(神经活动配体-受体相互作用通路)、Calcium signaling pathway(钙离子信号通路)、Dopaminergic synapse(多巴胺神经突触通路)、Alcoholism(酒精依赖代谢通路)、cAMP signaling pathway(cAMP信号通路)等.所有的信号通路中神经活动配体-受体相互作用通路涉及的靶标最多,该通路与50个关键核心靶标中的30个靶标相关.通过分析网络发现CHRNA1(神经乙酰胆碱受体α1)、CHRNA2(神经乙酰胆碱受体α2)、CHRNA3(神经乙酰胆碱受体α3)、CHRNB4(神经乙酰胆碱受体β4)、CHRNA7(神经乙酰胆碱受体α7)仅与莲子心中的双苄基异喹啉类生物碱如C5、C6、C9相互作用.而靶点DRD1、DRD2可以与莲子心中的大多数化学成分相互作用.
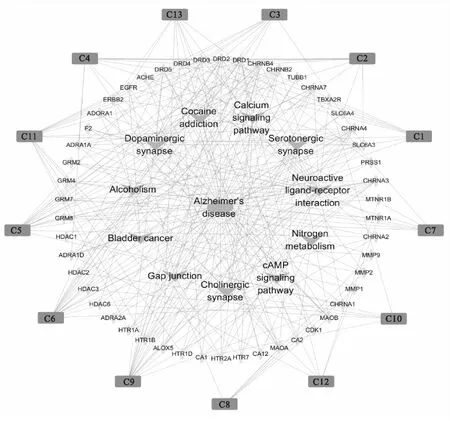
图6 “药物成分-交集靶点-作用通路”网络模型图
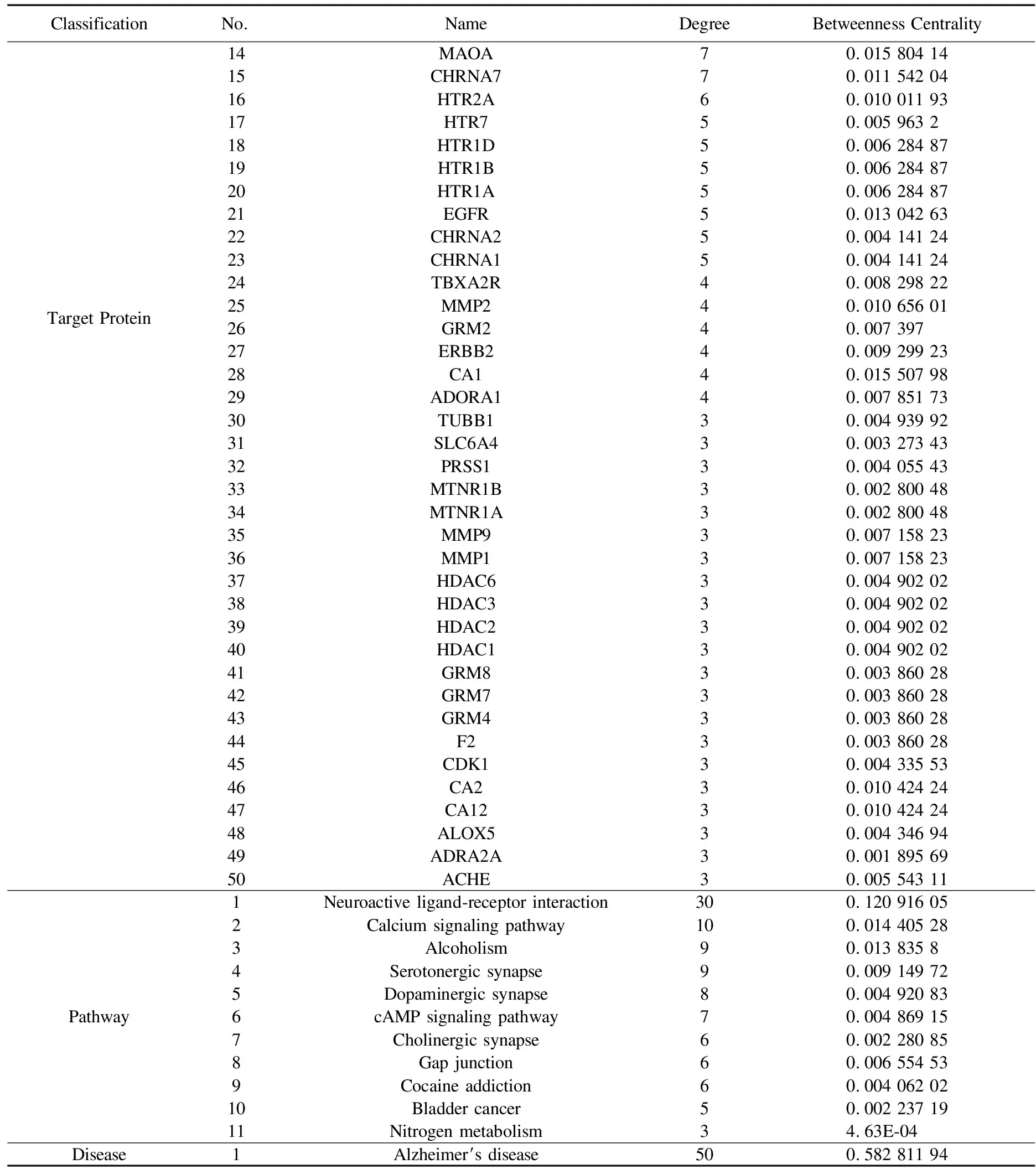
表3(续表)
4 分析与讨论
中医是中华文化中最伟大的宝藏之一,在东亚和东南亚有着悠久的历史,自古以来就被广泛使用.传统上,大多数新药的发现都集中在识别或设计与单个靶标特异性相互作用的药物上,但是,作用于单个分子靶标的药物通常在治疗某些疾病(例如糖尿病,炎症和癌症)时效果不令人满意[20].鉴于药物研发的瓶颈,药物研究与开发已逐渐从“单一目标,单一药物”模式转变为“网络目标,多成分治疗”模式[21-22].网络药理学方法已用于研究“蛋白/基因-疾病”途径,该途径能够从网络角度描述生物系统、药物和疾病之间的复杂性,并具有与中医相似的整体哲学观念[12,23].中医网络药理学开创了一种新的研究范式,旨在将中医药从基于经验的医学转变为基于证据的医学.
本研究利用网络药理学对莲子心的化学成分干预阿尔茨海默病的作用机制进行研讨,以期发现莲子心中的活性成分及其潜在的抗阿尔茨海默病作用靶点及作用通路.采用网络药理学的方法,筛选得到莲子心的13种主要活性成分,并预测得到上述药物化学成分的潜在作用靶点95个;在这95个潜在作用靶点中,与阿尔茨海默病相关的交集靶点有73个,即“药物成分-疾病”交集靶点;进一步的分析表明,莲子心这13个活性化合物与50个阿尔茨海默病关键核心靶标相关,并参与关键信号通路11条.分析发现,莲子心的13种主要活性成分最有可能通过 Neuroactive ligand-receptor interaction(神经活动配体-受体相互作用通路)发挥抗阿尔茨海默病作用.该通路是质膜上所有与细胞内外信号通路相关的受体配体的集合[24],涉及神经元乙酰胆碱受体(CHRNA1、CHRNA2、CHRNA3、CHRNA7)、肾上腺素能受体(ADRA1D、ADRA1A)、血清素受体(HTR2A、HTRlB)、多巴胺受体(DRD5、DRD1)等多种配体-受体信号转导途径,与生理节律、内分泌、心血管控制、情绪、学习和记忆等功能有关,研究表明,CHRNA7其异常程度与认知功能相关[25];DRD5属于G蛋白偶联受体超家族成员,可能参与奖赏和强化机制、认知和情感以及运动的调节;HTRlB基因敲除,小鼠冲动、过激行为增加[26],这与阿尔茨海默病的发生、发展密切相关.除了该通路以外,莲子心的13种主要药效成分还可以通过5-羟色胺能突触信号通路、钙离子信号通路、多巴胺能突触信号通路等发挥药效作用.从构建的“药物成分-交集靶点-作用通路”网络的总体特征分析,发现莲子心化学成分抗阿尔茨海默病作用存在多活性成分、多靶标以及通过不同的作用通路发挥作用的特点.
通过构建蛋白相互作用(PPI)网络,发现了GRM2、HDAC1、CHRNB4、CHRNB2为13种莲子心药效成分抗阿尔茨海默病作用关键靶点蛋白.CHRNB4、CHRNB2是乙酰胆碱受体,广泛表达于中枢神经系统.病理学上,阿尔茨海默病相关脑区烟碱乙酰胆碱受体的减少和胆碱能神经元的丢失是阿尔茨海默病的主要神经化学特征之一,乙酰胆碱介导的神经传递是神经系统功能的重要组成部分.在阿尔茨海默病晚期,胆碱能神经元丢失,从而逐渐导致阿尔茨海默病的记忆丧失和认知功能下降[27].乙酰胆碱酯酶抑制剂(AChEIs)是一种基于胆碱能假说的治疗药物,可以防止乙酰胆碱酯酶的降解,恢复突触乙酰胆碱酯酶的活性,改善症状.GRM2(代谢型谷氨酸受体2,mGluR2)是一种G-蛋白偶联受体,通过调节细胞内第二信使的产生而导致代谢改变.谷氨酸是中枢神经系统中主要的兴奋性神经递质,mGluR2通过控制释放兴奋性氨基酸谷氨酸来调节中枢神经系统中快速的突触传递[28].谷氨酸能突触传递改变是阿尔茨海默病发生的关键.组蛋白去乙酰酶(HDACs)是一种去除组蛋白和非组蛋白赖氨酸残基乙酰基的酶.HDACs可调节许多细胞过程,包括转录、染色质重塑和DNA修复.有研究表明,HDAC1是脑内的一种OGG1(8-羟基鸟嘌呤糖苷酶)去乙酰化酶,可能通过促进AP部位切割来刺激OGG1活动.研究发现,HDAC1和OGG1与大脑衰老和神经退行性疾病中的氧化DNA损伤、神经元基因表达、突触可塑性和认知功能有关,并强调了药理HDAC1激活在衰老和神经疾病中的治疗潜力[29].
从构建的“药物成分-交集靶点-作用通路”网络模型分析发现几种乙酰胆碱受体靶点(CHRNA1、CHRNA2、CHRNA3、CHRNB4、CHRNA7)仅可与莲子心的双苄基异喹啉类生物碱(异莲心碱、莲心碱、甲基莲心碱)相互作用,而多巴胺受体靶点(DRD1、DRD2)可以与莲子心的大多数化学成分相互作用.这表明,莲子心不同结构类型化学成分的作用机制可能存在明显差异,可为进一步研究化合物构效关系、药效物质基础及作用机制提供思路.
