远端缺血预处理对对乙酰氨基酚诱导急性肝损伤小鼠氧化应激和炎症反应的保护作用
2022-01-09郑伟党珊张智勇万永刘司南常虎林
郑伟,党珊,张智勇,万永,刘司南,常虎林
(陕西省人民医院,陕西 西安 710068,1.肝胆外科,2.老年消化科;3.西安交通大学第一附属医院 肝胆外科,陕西 西安 710061)
近年来,由对乙酰氨基酚(acetaminophen,APAP)的不当使用所致的重度肝损伤、肝衰竭在临床上呈上升趋势[1]。如何减轻以APAP为代表的急性药物性肝损伤是现阶段肝脏损伤控制领域的研究热点。远端缺血预处理(remote ischemic preconditioning,RIPC)即通过对一个组织或器官进行一次或数次非致命性的缺血再灌注处理,可以保护一个远隔器官免受致命性的缺血再灌注损伤[2]。目前已证实,RIPC可缓解肝脏缺血再灌注损伤,保护肝移植受体术后肝功能[3]。但RIPC对于APAP诱导的药物性肝损伤是否有效,鲜有报道。本研究旨在通过构建APAP诱导的小鼠药物性肝损伤模型,观察RIPC对模型小鼠肝功能、氧化应激水平、炎症因子水平、组织病理学方面的影响,探讨可能的作用机制。
1 材料和方法
1.1 主要材料和试剂
6~8周龄、体质量22~25 g的C57BL/6雄性小鼠,由西安交通大学医学院实验动物中心提供[许可证号:SYXK(陕)2016-006]。血红素加氧酶-1(HO-1)抗体,美国Abcam公司。Kelch样环氧氯丙烷相关蛋白-1(Keap1)、核因子E2相关因子2(Nrf2)抗体,美国Santa Cruz公司。血清肿瘤坏死因子-α(TNF-α)与白介素-6(IL-6)检测试剂盒,深圳达科为生物技术有限公司。谷胱甘肽酶(GSH)测试盒、超氧化物歧化酶(SOD)测试盒和丙二醛(MDA)测试盒,南京建成生物工程研究所。RIPA裂解液,上海碧云天生物技术有限公司。APAP溶液的配制:将0.6 g APAP粉剂溶于100 mL生理盐水中,在40 ℃水浴锅中晃动充分溶解、混匀,按300 mg/kg即50 mL/kg的剂量给药准备,每只小鼠约20 g,平均给药剂量约1 mL。
1.2 实验方法
1.2.1 实验分组和模型制作
实验分组:40 只BALB/c雄性小鼠按随机数字表法平均分为4组:(1)空白对照组(C组,不做任何处理);(2)假手术组(S组,小鼠远端缺血预处理后,间隔5 min,腹腔注射1 mL生理盐水);(3)肝损伤组(A组,腹腔注射1 mL APAP溶液);(4)远端缺血预处理组(R组,小鼠远端缺血预处理后,间隔5 min,腹腔注射1 mL APAP溶液)。各组小鼠均在处理后16 h后摘眼取血,脱颈处死后获取肝组织样本。
模型制作:(1)首先麻醉小鼠,将25 mg氯胺酮和2.5 mL甲苯噻嗪混合比例配制好麻醉药,每只小鼠腹腔注射(5 mL/kg)。(2)远端缺血预处理:于小鼠的右后肢中上部,取无弹性棉质绳带捆绑结扎5 min造成肢体缺血后,再松开绳带,让血液再灌注5 min;重复上述操作4 个循环,完成造模。通过足部颜色及下肢股动脉搏动情况来显示血液流动情况,评价远端局部缺血的效果。(3)S组为远端缺血预处理后,间隔5 min,腹腔注射1 mL生理盐水。R组为远端缺血预处理后,间隔5 min,腹腔注射1 mL APAP溶液。
1.2.2 血清ALT、AST、TNF-a、IL-6水平的测定:根据检测试剂盒说明书,进行相关指标的测定。
1.2.3 肝脏活性氧(ROS)含量检测:取出分离后的肝脏组织制作冰冻切片,根据DHE-ROS活性氧检测试剂盒说明书行荧光定性分析,蓝色荧光为细胞核,红色荧光为ROS阳性表达。
1.2.4 氧化应激程度的测定:根据检测试剂盒说明书指示,测定肝组织MDA、GSH、SOD含量。
1.2.5 Keap1、Nrf2和HO-1蛋白的测定:根据RIPA裂解液使用说明书制备肺组织匀浆,肝组织与RIPA裂解液的比例为1 mg∶7.5 μL,用玻璃匀浆器上下、旋转充分碾磨。在冰上裂解25 min后,以12 000 r/min离心20 min,离心半径7 cm,取上清,利用Western blotting检测各组小鼠肝组织Keap1、Nrf2和HO-1表达的变化,应用β-actin作为内参校正。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,正态分布的计量资料以()表示,组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 血清ALT、AST水平变化
与C组血清ALT[(87.85±9.19)U/L]和AST[(50.93±11.94)U/L]、S组血清ALT[(88.26±3.58)U/L]和AST[(51.88±10.94)U/L]比较,A组血清[ALT(5 643.20±688.21)]U/L、AST[(4 479.10±834.46)U/L]水平和R组血清[ALT(3 730.12±599.33)U/L]、AST[(3 592.52±646.13)U/L]水平均明显升高,差异均有统计学意义(均P<0.05);R组血清ALT和AST水平低于A组,差异有统计学意义(均P<0.05)。具体见图1。
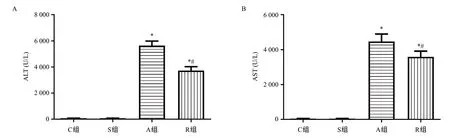
图1 RIPC对APAP诱导急性药物性肝损伤小鼠血清ALT、AST水平的影响
2.2 血清TNF-α、IL-6水平变化
与C组血清TNF-α[(43.98±5.66)pg/mL]和IL-6[(71.55±9.74)pg/mL]、S组血清TNF-α[(47.80±9.54)pg/mL]和IL-6[(73.88±8.66)pg/mL]比较,A组血清TNF-α[(337.75±48.57)pg/mL]和IL-6[(938.03±160.90)pg/mL]水平均明显升高,差异有统计学意义(均P<0.05);R组血清TNF-α[(235.55±65.77)pg/mL]和IL-6[(713.48±87.78)pg/mL]水平明显高于C组和S组,低于A组,差异均有统计学意义(均P<0.05)。具体见图2。

图2 RIPC对APAP诱导急性药物性肝损伤小鼠血清TNF-α和IL-6水平的影响
2.3 肝脏ROS含量变化
荧光显微镜下观察发现,与C组和S组对比,A组可见较多红色荧光,ROS产生较多。与A组相比,R组红色荧光明显减少,ROS产生减少。具体见图3。
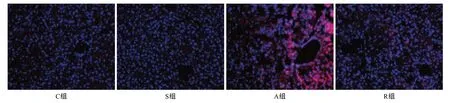
图3 RIPC对APAP诱导急性药物性肝损伤小鼠肝组织ROS的影响(×200)
2.4 肝组织GSH、SOD水平变化
与C组肝组织GSH[(14.30±1.21)mg/g protein]和SOD[(17.06±1.64)U/mg protein]、S组肝组织GSH[(14.19±2.96)mg/g protein]和SOD[(18.27±1.58)U/mg protein]比较,A组肝组织GSH[(7.13±0.89)mg/g protein]和SOD[(8.15±0.65)U/mg protein]活性降低,差异有统计学意义(均P<0.05);R组肝组织GSH[(10.36±0.96)mg/g protein]和SOD[(11.14±1.61)U/mg protein]活性较A组明显升高,但仍低于C组和S组,差异均有统计学意义(均P<0.05)。具体见图4。
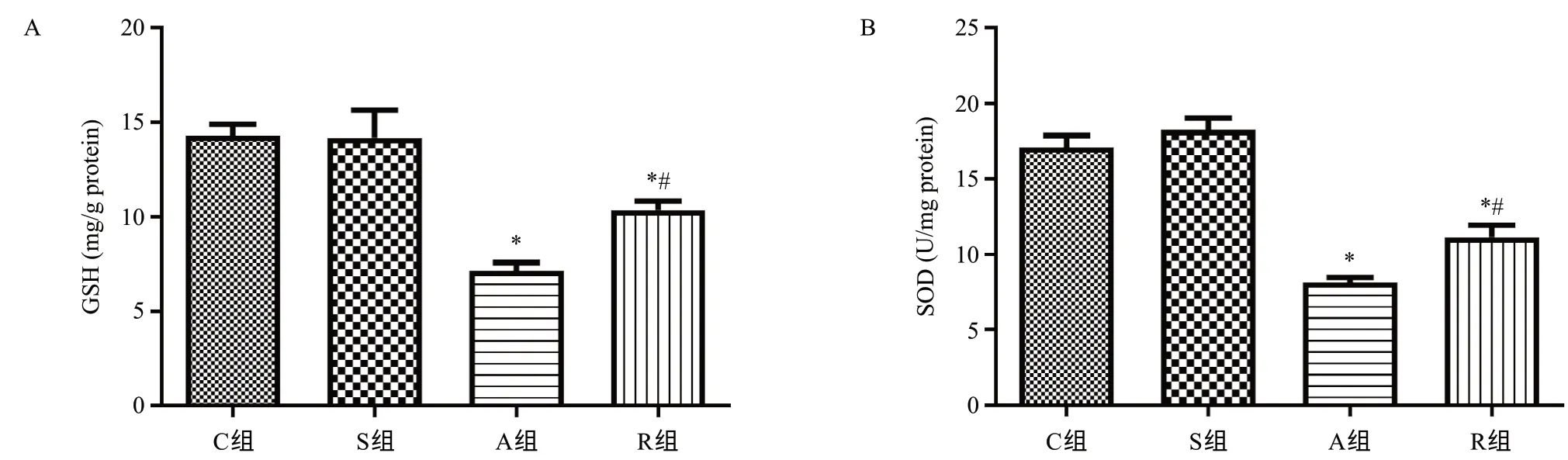
图4 RIPC对APAP诱导急性药物性肝损伤小鼠肝组织GSH、SOD活性的影响
2.5 肝组织MDA水平变化
与C组肝组织MDA[(2.88±0.87)nmol/g protein]和S组肝组织MDA[(2.70±0.59)nmol/g protein]比较,A组肝组织MDA[(13.20±1.94)nmol/g protein]含量增高,差异有统计学意义(均P<0.05);R组肝组织MDA[(8.50±0.82)nmol/g protein]活性较C组和S组明显上升,较A组明显降低,差异均有统计学意义(P<0.05)。具体见图5。
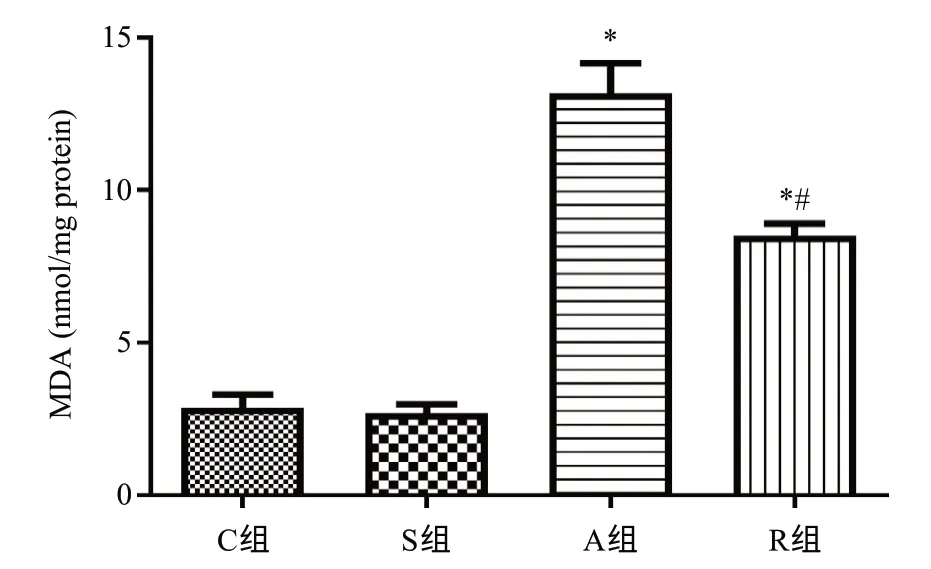
图5 RIPC对APAP诱导急性药物性肝损伤小鼠肝组织MDA含量的影响
2.6 肝组织Keap1、Nrf2和HO-1表达变化
A组肝脏Keap1、Nrf2和HO-1蛋白相对表达量分别为0.75±0.06、0.56±0.04和0.85±0.07,显著低于C组的1.08±0.09、1.06±0.12和1.07±0.14,以及S组的1.19±0.22、1.16±0.32和1.22±0.24,差异均有统计学意义(均P<0.05)。R组肝组织Keap1、Nrf2和HO-1蛋白相对表达量分别为1.47±0.26、1.94±0.22和1.66±0.18,较前三组均明显上升,差异有统计学意义(均P<0.05)。如图6所示。

图6 RIPC对APAP诱导急性药物性肝损伤小鼠Keap1、Nrf2和HO-1蛋白表达的影响
3 讨论
因APAP滥用而导致的急性肝损伤逐年上升,已成为欧美国家急性肝衰竭的首要病因[4]。随着近年来加速康复外科理念在国内的广泛推进,APAP等非甾体类药物在围术期疼痛管理中的应用也越来越广泛[5]。APAP不破坏胃黏膜,对血小板功能也不产生影响,但其潜在的肝损伤、肾损伤等相关不良事件日益受到关注[6],引发了研究人员对非甾体类药物安全性的担忧。对以APAP为代表的药物性肝损伤,目前仍缺乏特异性的治疗手段,病情严重的患者往往需要进行血液灌流、血液透析以及大剂量保肝利胆药物的应用,必要时还需要进行肝移植。对于如何预防和治疗APAP源性肝损伤已逐渐成为目前国内外研究的热点。
缺血预处理最早由Murry等[7]于1986 年提出,后经Przyklenk等[8]的改进,1993年正式提出RIPC的概念。研究人员发现,对冠状动脉旋支进行短暂的缺血再灌注可以显著减少冠脉左前降支阻塞引起的心肌梗死面积。在肝损伤方面,Zoltán等[9]在动物实验中发现,RIPC可显著缓解肝脏缺血再灌注损伤。Jung等[3]发现,在肢体远端行袖带加压来实现RIPC可显著降低肝移植受体术后肝功能的异常增高。RIPC发挥保护作用的机制十分复杂,有研究认为可能是通过体液通路、神经通路及机体系统性的应答来实现的[10]。
本研究以APAP诱导的肝损伤小鼠为模型,分别从肝功能水平、氧化应激程度、炎症因子水平等方面进行研究,并探讨RIPC有效减轻APAP药物性肝损伤的可能途径。结果发现,APAP可导致小鼠肝内产生大量ROS,抑制抗氧化酶GSH、SOD的活性,造成机体脂质过氧化产物MDA的异常堆积,释放TNF-α和IL-6 等炎性因子。而通过对APAP肝损伤小鼠进行远端缺血预处理,结果发现,RIPC可以显著改善小鼠血清ALT、AST水平,起到明显的保护肝脏的作用。此外,我们通过ELISA检测血清中炎症因子TNF-α和IL-6的水平发现,经过RIPC处理后,小鼠的炎症因子水平显著降低,说明RIPC可减轻APAP导致的药物性肝损伤的炎症过程及炎性因子的释放。而对氧化应激产物ROS、MDA和抗氧化系统主要酶类GSH和SOD的检测发现,在RIPC的作用下,ROS含量、MDA水平明显降低,脂质过氧化程度减轻,抗氧化物质GSH、SOD的消耗也明显减少,证明RIPC可通过减轻氧化应激过程,减少体内抗氧化物质的消耗,对药物性肝损伤发挥保护性作用。对于上述改变,本研究通过Western blotting初步发现RIPC对APAP肝损伤的上述保护作用有Keap1、Nrf2和HO-1的参与。
Keap1-Nrf2信号通路由于可抵抗内外界氧化和化学物质等刺激导致的氧化应激反应,在机体应对各种外来损伤的防御中起着非常重要的作用,是机体内最重要的内源性抗氧化信号通路[11]。生理状态下,Keap1与Nrf2相结合存在于包浆中,当细胞受到活性氧(ROS)等刺激后,Nrf2与Keap1解偶联,活化的Nrf2 转入细胞核内,激活其下游包括HO-1 在内的多种靶蛋白的表达来调节机体内氧化还原平衡,使机体恢复到正常的生理状态[12]。HO-1作为血红素降解的限速酶,其广泛分布于哺乳动物的多种组织细胞中,可由多种刺激因子诱导表达,如氧化应激、内毒素等[13]。HO-1的激活,可明显抑制氧化应激反应、炎症反应和肿瘤的生长[14],现有研究证实其在APAP肝损伤中具有保护作用[15]。本研究中,Western blotting结果显示Keap1、Nrf2和HO-1在A组中的蛋白相对表达量明显低于S组和C组,在R组中明显回升,说明Keap1、Nrf2和HO-1分子很可能参与了RIPC的保护机制。
综上所述,RIPC可通过减轻氧化应激和炎症反应对急性药物性肝损伤发挥保护作用。RIPC在临床中具有便捷易操作的巨大优势,其发挥肝脏保护功能的调控机制值得未来进一步深入研究。
利益冲突 所有作者均声明不存在利益冲突。
