捻转血矛线虫锌金属蛋白酶NAS-31的表达特性及功能初步研究
2022-01-08黄艳张惠童丹妮周静茹吴飞陈学秋杨怡马光旭杜爱芳
黄艳,张惠,童丹妮,周静茹,吴飞,陈学秋,杨怡,马光旭,杜爱芳
(浙江大学动物科学学院动物预防医学研究所,杭州 310058)
捻转血矛线虫(Haemonchus contortus)是一种重要的牛羊寄生虫,其感染性3 期幼虫(L3)常附着于牧草之上,通过消化道入侵宿主,最终寄生于小反刍兽的皱胃中,以宿主血液为食,导致宿主出现贫血、消化不良等症状,严重降低感染动物的生产性能[1-2]。目前,我国各地绵羊/山羊捻转血矛线虫的感染情况均较为严重[3-4],常用治疗药物的耐药性报道屡见不鲜[5-7];同时,寄生性线虫比其他胞内或组织内寄生虫更易逃避宿主的免疫机制,通过注射疫苗很难达到理想的保护效果[8-9]。因此,我国目前小反刍兽捻转血矛线虫病的防治工作亟待加强。L3 入侵宿主发育至4 期幼虫(L4)的过程,是其从自由生活阶段转变为宿主寄生阶段的重要时期,研究L3与L4转录差异基因的功能对于探明该寄生虫的入侵机制至关重要。LAING 等[10]和SCHWARZ 等[11]于2013年同时完成了捻转血矛线虫的基因组和转录组测序工作,为该寄生虫的研究奠定了重要的数据基础。
我们从以上转录组数据中筛选得到捻转血矛线虫锌金属蛋白酶NAS-31,蛋白功能预测分析显示其属于线虫虾红素样蛋白。虾红素样蛋白家族是一类广泛存在于细菌、无脊椎动物和脊椎动物体内的锌金属蛋白酶,最早发现于十足螯虾[12],其另一个重要的家族成员是骨形成蛋白1(bone morphogenetic protein 1, BMP-1),该蛋白的果蝇同系物是Tolloid和Tolloid-like蛋白,主要参与细胞外基质组成成分的加工[13-15],此外,某些转化生长因子β(transforming growth factor-β, TGF-β)抑制因子也是BMP-1/Tolloid的作用底物,它们的降解可激活TGF-β信号通路[16-17]。虾红素样蛋白的生理功能有很多,包括在孵化、食物消化、肽酶加工以及在形态发生过程中发挥作用等。在模式生物秀丽隐杆线虫(Caenorhabditis elegans)中,编码线虫虾红素样蛋白的基因总共有40个[18],但是只有少数几种基因的功能是明确的,如:hch-1/nas-34表达于虫卵中,参与虫卵孵化过程[19];DPY-31/NAS-35表达于上皮细胞中,是胶原蛋白加工和表皮形成过程中发挥重要功能的蛋白酶之一[20];nas-36/37基因突变株存在蜕皮缺陷,主要表现为旧皮无法脱落,说明这2个基因与旧皮降解、脱落有关[21]。在寄生性线虫中,有关虾红素样蛋白功能的研究比较少。马来丝虫(Brugia malayi)和捻转血矛线虫中均存在dpy-31的同源基因。STEPEK 等[20]发现:马来丝虫dpy-31的启动子能在秀丽隐杆线虫中启动报告基因的表达,且报告基因的分布情况与Ce-dpy-31的表达特征一致,均在肠道和排泄分泌系统中分布及表达;另外,Ce-dpy-31突变株虫体表现为与角质层相关的温度敏感致死表型,异源表达Hc-dpy-31能实现对该突变株的拯救。这些结果证明,寄生性线虫的虾红素样蛋白基因可能与秀丽隐杆线虫同源基因发挥类似的生物学功能。
为研究锌金属蛋白酶NAS-31 的生物学功能,本实验首先通过cDNA 末端快速扩增(rapid amplification of cDNA ends, RACE)、基因步移(genome walking)克隆得到Hc-nas-31的全基因序列并分析其基因结构,随后构建原核表达载体,以制备多克隆抗体用于免疫组织定位,进而分析Hc-NAS-31蛋白在感染性幼虫(L3)和成虫体内的表达情况,为进一步探明该基因在捻转血矛线虫入侵及寄生过程中发挥的功能奠定基础。
1 材料与方法
1.1 虫株、菌株和质粒
捻转血矛线虫浙江株由本实验室传代并保存;表达质粒pET-30a、大肠埃希菌TOP10 和BL21(DE3)菌株由本实验室冻存。
1.2 试剂与仪器
LATaq酶、限制性内切酶、pMD19-T载体、DNA标志物、RACE 试剂盒、基因步移试剂盒购自日本TaKaRa 公司;2×Taq主混合物购自上海近岸生物科技有限公司;反转录试剂盒购自日本TOYOBO 公司;基因组提取试剂盒购自天根生化科技(北京)有限公司;质粒抽提试剂盒、琼脂糖凝胶回收试剂盒购自浙江易思得生物科技有限公司;His 标签鼠多克隆抗体购自美国Proteintech 公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠IgG购自北京鼎国有限公司;封闭用驴血清购自北京索莱宝科技有限公司;Alexa Fluor®488 nm荧光二抗购自英国Abcam公司;细胞核染料4′,6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole, DAPI)购自上海碧云天生物技术有限公司;4%多聚甲醛溶液、抗原修复液、0.1 mol/L 磷酸盐缓冲溶液(phosphate buffer solution,PBS)、封闭液等由实验室配制;聚合酶链反应(polymerase chain reaction,PCR)仪购自德国Eppendorf 公司;凝胶成像系统购自上海培清科技有限公司;实时荧光定量聚合酶链反应(real-time quantitative PCR,qRT-PCR)仪(美国Bio-Rad公司)为浙江大学动物科学学院大型仪器平台仪器;Zeiss LSM-780 激光共聚焦显微成像系统(德国Zeiss 公司)为浙江大学农生环测试中心平台仪器。
1.3 引物设计与合成
根据Ce-nas-31(GenBank登录号:NM_001028 822.4)的氨基酸序列,经tBlastn在捻转血矛线虫基因组数据库(http://www.sanger.ac.uk)中得到相似度最高的序列片段(HCISE00439000.t1),命名为Hc-nas-31,以此为模板设计特异性引物用于RACE 和基因步移扩增。根据RACE 结果设计融合PCR、原核表达及荧光定量PCR实验所需引物。所有引物序列见表1,由生工生物工程(上海)股份有限公司合成。

表1 引物信息Table 1 Primer information
1.4 捻转血矛线虫总RNA 提取与反转录
总RNA 提取方法参照TriZol 试剂(美国Invitrogen 公司)说明书进行。取适量捻转血矛线虫成虫虫体于玻璃研磨器中,加入1 mL 的TriZol试剂在冰上充分研磨后转移至离心管中,于室温下静置5 min;加入200 μL 三氯甲烷振荡混匀15 s,室温静置15 min;在4 ℃条件下,以1.2×104r/min离心15 min,转移上层液体至新的离心管中;加入500 μL 异丙醇,轻轻吹打混匀,室温静置10 min;在4 ℃条件下,以1.2×104r/min 离心10 min,弃上清液,加入1 mL 75%乙醇漂洗沉淀;在4 ℃条件下,以8 000 r/min 离心5 min,弃上清液,室温干燥5~10 min;加入10 μL 的RNase-free dH2O 溶解沉淀,即得总RNA。向总RNA 中加入1 μL 的Oligo(dT),65 ℃变性处理5 min,随后迅速置于冰上冷却。按照说明书配制反转录反应液,在PCR 仪上设置反转录程序:30 ℃孵育10 min,42 ℃反转录60 min,85 ℃孵育5 min,4 ℃冷却5 min,反应结束后于-80 ℃冰箱中保存,备用。
1.5 Hc-nas-31 基因的3′-全长RACE 反应
用TriZol 提取RNA 后,按照3′-全长RACE 试剂盒(日本TaKaRa公司)说明书将其配制成反转录溶液,反应液在42 ℃条件下延伸1 h,70 ℃条件下孵育15 min,所得产物用于后续实验。按照上述说明书中巢式PCR 的Outer PCR 体系配制反应液,扩增步骤如下:94 ℃预变性3 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min,必要时可进行2 轮PCR 扩增。以最后一轮Outer PCR产物为模板进行Inner PCR扩增,步骤如下:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸70 s,30 个循环;72 ℃延伸10 min。产物经1%琼脂糖凝胶电泳进行检测,将回收片段连接至pMD19-T 克隆载体上,转化TOP10 感受态细胞,挑选A+抗性Luria-Bertani(LB)平板上的阳性克隆送至浙江尚亚生物技术有限公司进行测序,对结果进行拼接及做比对分析。
1.6 基因步移扩增
提取捻转血矛线虫基因组后,使用纳米微量核酸分析仪(台湾省Maestrogen 公司)测定模板浓度,按照基因步移试剂盒说明书,取50~100 ng RNA进行第1轮PCR。将反应产物根据需要稀释1~1 000倍后,取1 μL 作为第2 轮PCR 的模板,以相同的兼并引物(AP primer)为上游引物。若第1 轮PCR 以SP1 为上游引物,则此次可用SP2 或SP3 作为下游引物,若第1 轮PCR 以SP2 为上游引物,则此次用SP3 作为下游引物,按照相同比例配制反应液进行第2轮PCR,反应条件参考上述说明书。用1%琼脂糖凝胶电泳进行分离并检测每一轮PCR产物,割下清晰的电泳条带,经凝胶回收试剂盒回收纯化后连接到pMD19-T载体上,并进行测序分析。
1.7 不同时期的转录水平检测
收集感染宿主的粪便,通过饱和食盐水漂浮法分离虫卵,转到含D-Hanks溶液的琼脂平板中进行体外培养,得到L1~L3 虫体。对4—6 月龄湖羊连续注射免疫抑制剂3 d后,经口感染6 000~8 000条L3虫体,分别于感染后第11天和第45天剖杀湖羊,分离其皱胃中的L4和成虫[22][本实验得到浙江大学实验动物中心实验动物使用和管理委员会的批准(ZJU201308-1-10-072)]。提取各时期虫体RNA后反转录得到cDNA,用荧光定量PCR 引物进行转录水平的检测。采用2-ΔΔCT值比较法、t检验法及单因素方差分析法对转录水平进行相对定量分析,以P<0.05表示差异有统计学意义。
1.8 Hc-NAS-31 原核表达及多克隆抗体的制备
根据RACE 结果设计2 对分段引物Hc-nas-31F1/R1 和Hc-nas-31F2/R2,以捻转血矛线虫反转录产物cDNA 为模板,通过融合PCR 扩增得到Hcnas-31的全长cDNA 序列。用Hc-nas-31F/R 扩增带有BamHⅠ和HindⅢ酶切位点的全长序列,与经过相同限制性内切酶处理的表达载体pET-30a连接过夜,转化TOP10感受态细胞后挑取阳性克隆进行测序。将测序正确的重组质粒pET-30a-Hc-nas-31转化BL21 感受态细胞,挑选阳性克隆进行菌液PCR 和双酶切鉴定。鉴定为阳性的菌液进行诱导表达实验,以摸索最佳诱导条件;扩大培养后经1 mmol/L 的异丙基-β-D-硫代半乳糖苷诱导5 h,利用亲和镍柱纯化重组蛋白。用Bradford 法测定蛋白浓度后,根据常规免疫程序对新西兰大白兔免疫,共进行3 次,末次免疫后第7 天在耳缘静脉采血并分离血清,测定多克隆抗体滴度,以满足后续实验需求;3 d 后实施心脏采血并分离血清,经蛋白质印迹法(Western blotting)检测抗体结合能力,于-80 ℃条件下分装、保存。
1.9 间接免疫荧光分析
1.9.1 L3 全虫间接免疫荧光
收集L3 虫体,加入1%次氯酸钠溶液处理30 min 以进行人工脱鞘,采用PBS 充分洗涤,加入4%多聚甲醛溶液于4 ℃条件下固定7 d以上;经PBS充分洗涤后,按照体积比1∶100 加入蛋白酶K,于55 ℃条件下消化45 min;用PBS 洗涤后,加入0.1%的Triton X-100,室温透化过夜[23];用PBS 洗涤后,加入1.5%牛血清蛋白(bovine serum albumin,BSA)的封闭液,室温过夜孵育;用PBS洗涤后,加入稀释200倍的Hc-NAS-31兔多克隆抗体,于37 ℃条件下孵育1 h;用PBS 充分洗涤后,加入1∶1 000 稀释的Goat Anti-Rabbit IgG H&L(Alexa Fluor®488 nm)荧光二抗,于37 ℃条件下避光孵育1 h;用PBS避光洗涤后,加入DAPI 染色液,在室温避光下孵育30 min;用PBS 洗涤后,在Zeiss LSM-780 激光共聚焦显微镜下观察并拍照。
1.9.2 捻转血矛线虫石蜡切片的制作
收集捻转血矛线虫成虫虫体,加入4%多聚甲醛溶液,在4 ℃条件下固定7 d 以上,用PBS 漂洗3~5次后进行梯度乙醇脱水:50%乙醇10 min,75%乙醇10 min,80%乙醇10 min,95%乙醇10 min,100%乙醇10 min,100%乙醇10 min。将虫体转移至100%乙醇-二甲苯(体积比1∶1)溶液中处理10 min,用二甲苯浸泡10 min(2 次);透明结束后,浸入融化的石蜡中包埋1~2 h 后,蜡块凝固后可在4 ℃条件下长期保存[24]。利用组织切片机,将石蜡块切成4 μm 的蜡片,在42 ℃水浴锅中展开后用黏附载玻片捞起,转移至50 ℃烘箱中进行干燥后,室温保存。
1.9.3 免疫组织荧光分析
在显微镜下选取合适的石蜡切片放置到切片架中,依次将切片浸入二甲苯Ⅰ6 min,二甲苯Ⅱ6 min,无水乙醇Ⅰ4 min,无水乙醇Ⅱ4 min,90%乙醇3 min,80%乙醇3 min,70%乙醇3 min,蒸馏水3 min;锅中盛适量自来水,放入装有抗原修复液的烧杯,煮沸,将水化完成后的切片浸入烧杯中,20 min 后转移至蒸馏水中冷却。滴加10%驴血清,37 ℃封闭1 h;用PBS 润洗3 次,滴加稀释200 倍的血清抗体,37 ℃孵育1 h;用PBS 润洗3 次,加入Alexa Fluor®488 nm 荧光二抗(用PBS 按体积比1∶1 000 稀释),37 ℃孵育1 h;用PBS 润洗3 次,DAPI 染核30 min;用PBS 润洗后,滴加适量50%丙三醇封片,在Zeiss LSM-780 激光共聚焦显微镜下观察并采集图片。
2 结果与分析
2.1 全基因序列获得及结构分析
以HCISE00439000.t1 为模板设计特异性扩增引物,按照说明书进行RACE 实验未扩增得到目的条带,将Outer PCR 和Inner PCR 均进行2 轮,用1%琼脂糖凝胶电泳分析扩增产物,结果发现,Inner PCR 第2 轮产物在500 bp 左右有一条疑似条带(图1A),回收后连接T载体进行测序,经拼接比对后确定为Hc-nas-31基因片段,并成功获得该基因的3′端非编码区(untranslated region, UTR)。5′基因步移扩增得到1 500 bp 左右片段,3′基因步移扩增得到1 000 bp 左右片段,回收后连接T 载体进行测序,结果显示2 个片段均为目的基因序列(图1B~C)。结合RACE、基因步移及Sanger 数据库信息,成功获得捻转血矛线虫浙江株Hc-nas-31基因的全长mRNA 和DNA 序列:其mRNA 序列(GenBank登录号:MW142213)全长1 982 bp,包括1 617 bp的编码区和365 bp的3′UTR,其中3′UTR与编码区之间无内含子;Hc-nas-31基因DNA(GenBank 登录号:MW142214)全长15 519 bp,由15个外显子和14个内含子组成(图1D)。

图1 Hc-nas-31基因扩增与结构示意图Fig.1 Hc-nas-31 gene amplification and structural schematic diagram
2.2 Hc-nas-31 全长编码序列(coding sequence,CDS)扩增
根据获得的Hc-nas-31mRNA序列设计2对引物,分别扩增得到该基因的2段基因片段,再经过融合PCR方法扩增Hc-nas-31全长CDS。如图2所示,最终在1 500 bp左右可以看到清晰的条带,与目的基因大小相符。回收目的片段并连接T载体后,转化到TOP10 感受态细胞中,将阳性菌斑送至浙江尚亚生物技术有限公司测序,结果与所得到的mRNA序列相似性为100%。用InterProScan 和PredictProtein 软件对基因编码的氨基酸序列功能域进行预测,结果显示:Hc-NAS-31有1个虾红素样蛋白结构域、1个CUB结构域和1个SXC结构域,在分类上属于虾红素样金属肽酶,该蛋白N端还有一段信号肽(图2)。
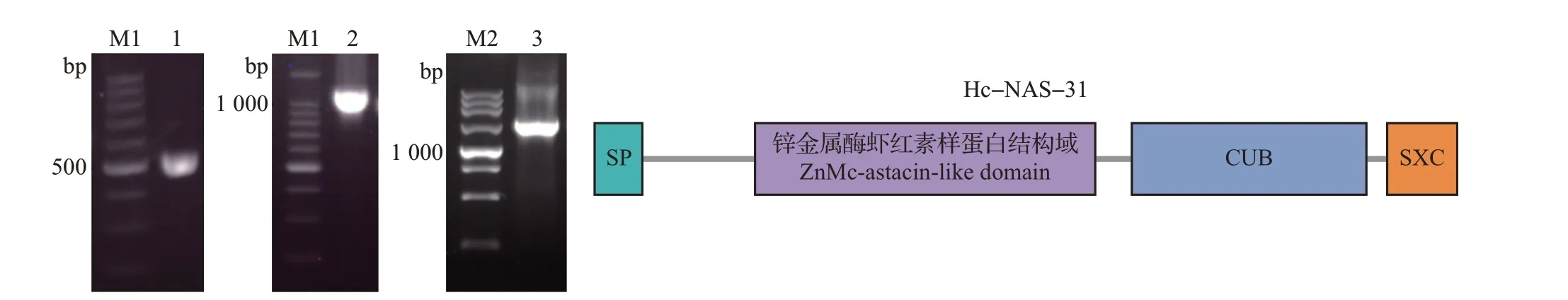
图2 Hc-nas-31全长CDS扩增及蛋白质结构示意图Fig.2 Amplification of Hc-nas-31 full-length CDS and structural schematic diagram of Hc-NAS-31 protein
2.3 捻转血矛线虫各时期Hc-nas-31的转录水平
捻转血矛线虫各时期虫体中Hc-nas-31基因均有不同水平转录,其中L2 和L3 幼虫中转录水平较高,而虫卵和雌性成虫(FA)体内转录水平较低(图3)。在自由生活阶段,该基因转录水平逐渐升高,在L3期时达到峰值,但当捻转血矛线虫入侵宿主后出现断崖式下降。

图3 捻转血矛线虫各时期Hc-nas-31转录水平Fig.3 Transcription levels of Hc-nas-31 at different stages of H.contortus
2.4 Hc-NAS-31原核表达及多克隆抗体制备结果
将编码区序列插入表达载体pET-30a,重组质粒测序正确后转化至BL21 感受态细胞中,挑选单克隆培养并提取质粒进行鉴定,结果发现,3 号和4号菌斑为阳性(图4A)。选取3 号菌斑进行诱导以摸索最佳诱导时间,发现在37 ℃条件下诱导5 h 即能成功表达足够量的蛋白(图4B)。扩大培养后诱导5 h,收集菌体并纯化重组蛋白用于多克隆抗体制备,发现制备的多克隆抗体能与捻转血矛线虫L3和成虫全虫蛋白特异性结合(图4C),可用于后续实验。
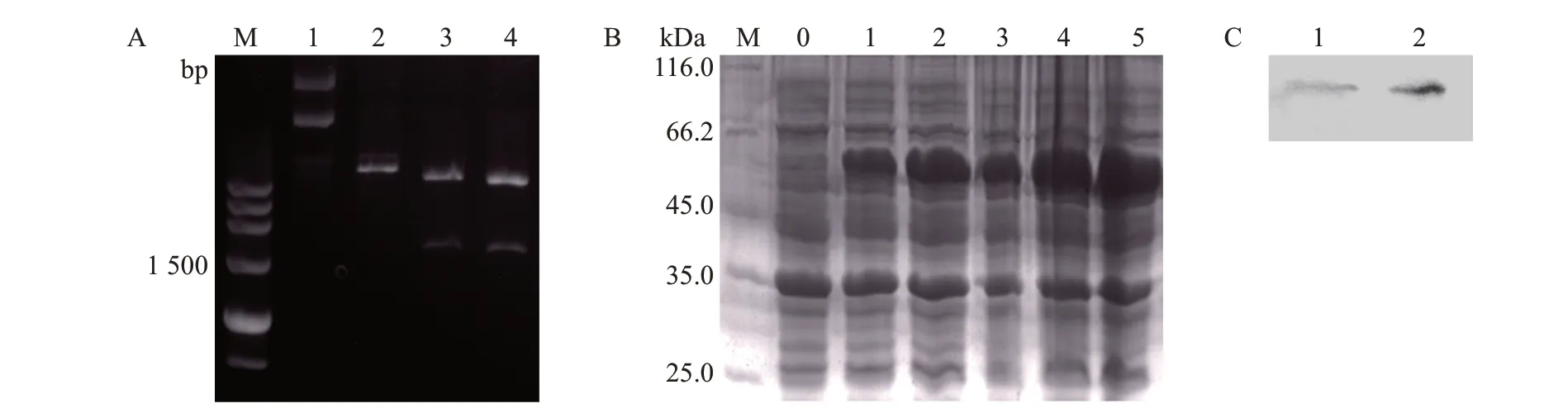
图4 重组质粒鉴定、诱导表达及多克隆抗体蛋白质印迹法检测Fig.4 Identification of the recombinant plasmid,induction expression and Western blotting analysis of polyclonal antibodies
2.5 L3 全虫间接免疫荧光结果
根据各时期转录水平检测结果,基因在L3虫体内的转录水平显著高于其他时期,因此,收集洁净的L3 虫体人工脱鞘后,进行全虫间接免疫荧光分析。结果显示,Hc-NAS-31蛋白主要分布于虫体的上皮细胞合胞体中(图5)。

图5 L3全虫间接免疫荧光分析Fig.5 Indirect immunofluorescence analysis of whole worm of L3
2.6 Hc-NAS-31 在成虫体内的分布
制备捻转血矛线虫成虫切片,通过免疫组织荧光染色观察Hc-NAS-31 蛋白在成虫体内的表达情况。结果表明:Hc-NAS-31蛋白主要分布于雄性成虫的生殖腺(性腺)、肠道和肌肉中(图6),雌性成虫的肠道、性腺和虫卵早期胚胎中也有较高水平的表达(图7),而阴性对照无荧光信号。

图6 捻转血矛线虫Hc-NAS-31在雄性成虫中的表达分布Fig.6 Expression locations of Hc-NAS-31 in male adults of H.contortus

图7 捻转血矛线虫Hc-NAS-31在雌性成虫中的表达分布Fig.7 Expression locations of Hc-NAS-31 in female adults of H.contortus
3 讨论
捻转血矛线虫虫卵随宿主粪便排出体外,在适宜的条件下孵化并发育至披鞘的感染性3 期幼虫(L3),该时期的幼虫在外界环境下一般可存活3 个月,对恶劣环境具有较强的抵抗能力,并可通过休眠延长存活时间,最长可达1 年[25-26],是捻转血矛线虫防治的重点和难点。对该寄生虫L3 期高表达基因的功能进行研究,寻找可能的药物靶点,降低感染性幼虫在外界环境中的存活率,可能成为捻转血矛线虫病防控的新思路。
本实验对Hc-nas-31在捻转血矛线虫各时期的转录丰度进行荧光定量PCR检测,发现该基因在除虫卵以外的其他自由生活阶段的转录水平均高于寄生阶段(L4和成虫),其中L3期的转录水平最高,与转录组测序结果一致[11]。该基因在捻转血矛线虫L3 中的大量转录可能与虫体抵抗恶劣的外界环境有关,也可能与感染性幼虫入侵宿主有关。
Hc-nas-31基因编码538个氨基酸,功能域预测分析结果显示,该蛋白具有1 个虾红素样蛋白结构域、1个CUB结构域和1个SXC结构域,在分类上属于虾红素样金属肽酶,N 端信号肽的存在说明Hc-NAS-31合成后可被分泌至细胞外。捻转血矛线虫与秀丽隐杆线虫在进化关系上同属于第5 分支,很多研究证明这2种线虫的同源基因可能发挥类似的生物学功能[20,27-28]。而在秀丽隐杆线虫中,虾红素样蛋白参与的功能包括虫卵孵化、表皮成分合成与加工、蜕皮等[18-21]。众所周知,蛋白质的表达特性对于进一步研究基因的生物学功能至关重要,为探究Hc-NAS-31是否也参与以上生命过程,本研究对该基因在捻转血矛线虫中的表达特性进行了分析。
通过RACE 和融合PCR 扩增,得到Hc-nas-31的编码区序列,构建了Hc-NAS-31 的原核表达载体,并经诱导及纯化得到重组蛋白,将其免疫新西兰大白兔以制备多克隆抗体。蛋白质印迹法结果显示:获得的抗体可以特异性结合Hc-NAS-31的重组蛋白和天然蛋白,可用于免疫荧光分析该蛋白在虫体内的表达情况。对捻转血矛线虫脱鞘3期幼虫和成虫切片进行间接免疫荧光分析,结果发现:Hc-NAS-31 主要表达于L3 虫体的上皮细胞合胞体中,而上皮细胞是表皮组成成分及蜕皮期间参与皮质溶离的蛋白合成的重要场所[29],说明Hc-NAS-31跟某些虾红素样蛋白一样可能参与捻转血矛线虫的蜕皮过程[20,27];L3需要面临复杂的外界环境,其表皮成分可能与其他时期的表皮成分不同,Hc-NAS-31也有可能参与特殊表皮成分的合成过程。在雌性成虫中,该蛋白主要表达于肠道、性腺、早期虫卵中,而在雄性成虫体内,该蛋白主要分布于肠道、生殖腺以及肌肉组织中。Hc-NAS-31 在幼虫和成虫体内的表达情况存在差异,说明该蛋白可能具有多种生物学功能,在幼虫时期参与皮质层合成、虫体的蜕皮,当虫体发育至成虫时,蜕皮不再发生,但表皮在成虫生长发育的过程中仍会不断变大[30],此时上皮组织中并无Hc-NAS-31 表达,说明该蛋白不参与成虫表皮的合成,而在肠道、性腺(生殖腺)、早期虫卵及肌肉组织中检测到绿色荧光,表明该蛋白可能还参与了食物消化、能量转化、生殖系统发育、虫卵形成等生物过程。另外,Hc-NAS-31在雄虫肌肉中的表达可能与交配行为有关[31]。
4 结论
本研究通过实时荧光定量PCR检测Hc-nas-31在捻转血矛线虫不同时期的转录水平,结果表明,该基因可能是捻转血矛线虫L3 生存和入侵的关键基因。间接免疫荧光分析发现,Hc-NAS-31主要表达于L3上皮细胞合胞体和成虫的性腺(生殖腺)、早期虫卵、肠道中,在肌肉中也有少量表达。捻转血矛线虫锌金属蛋白酶NAS-31的表达特性分析结果对进一步解析该基因在虫体生长发育及宿主入侵过程中发挥的功能具有重要意义,为Hc-nas-31之后的功能研究指明了方向。
