七氟烷预处理及后处理对心肌缺血再灌注损伤的保护作用及其机制的研究进展
2022-01-08万子琳综述王小燕审校
万子琳 综述 王小燕 审校
(昆明医科大学附属延安医院 心外科,云南 昆明 650051)
体外循环(Cardiopulmonary bypass,CPB)下心脏手术极易诱发心肌缺血-再灌注损伤(Myocardial ischemia-reperfusion injury,MIRI),为对抗MIRI,临床上已进行了大量研究。1986年Murry等[1]进行犬实验发现预先反复、多次、短暂地阻断犬的冠脉血供,可提高心肌细胞对未来长时间缺血的耐受性,从而减轻组织器官损伤,定义为“缺血预处理”。2003年Zhao 等[2]发现对心肌细胞进行单次或多次阻断-灌注-再阻断-再灌注处理,也具有良好的长期保护作用,称为“缺血后处理”。此后研究发现应用药物预处理及后处理,也具有相似的心肌保护效果,且具有更好的可操作性、可控性及安全性。作为目前临床应用最广的吸入性麻醉药,七氟烷本身具有麻醉诱导迅速、深度易控制等优点,其预处理和后处理均能有效减轻心肌细胞损伤。现就近年来七氟烷预处理及后处理的心肌保护作用及机制进行综述。
1 心肌保护作用
1.1 对血流动力学的影响
既往研究发现,七氟烷能改善心肌舒缩功能,减少梗死面积,显著改善心脏血流动力学,促进冠脉循环及心功能的恢复[3,4]。但七氟烷对血流动力学及心功能的影响并不一定,与其浓度、剂量密切相关。Harkin 等[5]给予犬不同浓度(1.0、1.25、1.5 和1.75 MAC) 七氟烷发现随着浓度升高,犬的动脉血压、心输出量及冠脉血管阻力均显著降低。李琼等[6]发现吸入七氟烷MAC<1.0 时,患者心收缩力显著增加,后负荷降低,组织血流灌注和氧供均得到显著改善,MACP>1.5 时心功能却受到抑制,也证实了七氟烷的剂量依赖性。在心瓣膜置换术中郭圣东等[7]发现2%浓度七氟烷预处理减轻MIRI 的作用优于1%和3%浓度,而张新科等[8]在小儿先心病矫治术中则观察到3%浓度七氟烷全程吸入对心肌的保护作用最佳。因此,不同浓度七氟烷的心肌保护作用可能不同,既往报道仍存在争议,与手术类型、研究对象及处理方法等不同有关,还需进一步探讨。
1.2 对炎症因子的影响
CPB 下心脏手术中,缺血再灌注(Ischemiareperfusion,I/R)过程、血液与非生理性异物接触及操作的伤害性刺激等都能激活补体系统,引发内毒素血症,诱发全身性炎症反应综合征(Syste-mic inflammatory response syndrome,SIRS),严重损害组织器官功能[9]。I/R 过程中,IL-6、IL-8 及IL-10等作为急性期炎症反应的始动因子,介导了心肌细胞的结构破坏,加剧心功能损伤,其水平的高低反映了SIRS 的严重程度。既往研究发现CPB 下心脏手术患者血清中促炎因子IL-6 和IL-8,抗炎因子IL-10 等浓度均显著升高,但七氟烷处理组炎症水平较对照组显著更低[9]。提示七氟烷具有显著抗炎作用,能有效拮抗SIRS 减轻CPB 相关心血管不良反应。
2 心肌保护作用机制
1.1 激活线粒体ATP 敏感性钾离子通道(Mitochondrial atp-sensitive k+channels,mKATP)
mKATP 是一种线粒体内膜上的内向整流钾离子通道,正常生理情况下受细胞内外离子浓度调节,维持膜电位的稳定。mKATP 通道开放使K+内流进入线粒体,膜电位差降低可拮抗Ca2+内流,预防钙超载,产生的三磷酸腺苷(adenosine triphosphate,ATP)可维持细胞的能量需求。研究显示七氟烷预处理和后处理均可预防MIRI,联合处理更为显著,加用特异性mKATP 阻滞剂5-羟基癸酸盐(5-hydroxydecanoate,5-HD)后心肌保护作用明显被削弱[3]。进一步研究发现MIRI 过程大鼠心肌细胞线粒体中主要的缝隙连接蛋白43(Connexin43,Cx43)明显减少,七氟烷后处理能有效上调Cx43 表达,而5-HD 消除了该作用,提示七氟烷可能通过激活mKATP 通道上调Cx43 的表达来减轻心肌损害[10]。
2.2 预防钙离子(Ca2+)超载
正常情况下Ca2+参与多种电生理活动,细胞内外浓度处于动态平衡。心肌缺血缺氧时原储存的ATP 迅速耗尽,Ca2+大量内流,随后再灌注过程伴随着氧化应激反应进一步加速Ca2+内流,加剧细胞损伤。Liu[11]等在兔的离体MIRI 模型发现,七氟烷预处理能显著降低细胞线粒体内的Ca2+,增加ATP 浓度,给予5-HD 后该作用被抵消。提示七氟烷预处理可能通过抑制Ca2+超载实现心肌保护作用,且此途径依赖mKATP 通道的开放。kojima 等人[12]发现I/R 后小鼠心肌细胞会出现明显的氧化应激反应,激活钙调蛋白依赖性蛋白激酶II,L型钙电流显著增强。七氟烷能有效抑制钙调蛋白依赖性蛋白激酶II 磷酸化,并且将L 型钙电流降至基础值以下。表明七氟烷减轻氧化应激反应引起的Ca2+超载可能与抑制L 型钙电流有关。
2.3 活性氧(Reactive oxygen species,ROS)的生成与介导
正常情况下人体内仅产生少量的ROS,且很快被体内抗氧化酶清除。I/R 导致机体内环境紊乱,氧化-抗氧化系统失衡,ROS 过度生成破坏细胞组织的结构及功能。2002年Droge[13]报道称ROS 的作用其实具有浓度-效应关系。高浓度的ROS 及衍生物能破坏所有主要细胞成分,但中等浓度的ROS 在信号传导过程中起介导作用,参与减轻氧化应激损害。有研究发现,七氟烷既能显著抑制ROS 生成从而减轻心肌细胞损伤,又能促进ROS 作为上游信号分子参与介导心肌保护通路。Li 等[14]发现七氟烷预处理可以显著增加自噬体含量及腺苷酸活化蛋白激酶(Amp-activated protein kinase,AMPK) 的磷酸化从而实现心肌保护,而AMPK 磷酸化依赖ROS 的产生,即ROS 很可能在信号途径上游介导AMPK 磷酸化反应。
2.4 抑制线粒体膜通透性转运孔(Mitochondrial permeability transition pore,mPTP)开放
mPTP 是位于线粒体内膜上的一种非特异性孔道,通常只能选择性通过一些分子和离子。I/R 氧化应激状态下,mPTP 异常开放引起线粒体外膜破裂,导致胶体渗透压改变、线粒体肿胀,释放细胞色素c 等加速细胞凋亡和坏死。Zhang 等[15]在I/R初期,单独对大鼠应用七氟烷观察到其心肌乳酸脱氢酶释放显著减少,心肌梗死面积减少,加入mPTP 开放剂苍术苷可以部分或完全取消七氟烷的心肌保护作用,提示七氟烷可能通过阻断mPTP 开放,产生心肌保护作用。
2.5 抑制心肌细胞凋亡
I/R 过程中细胞线粒体受损,细胞色素c 从线粒体释放后与凋亡相关因子结合,激活Caspase 家族等相关蛋白直接裂解吞噬细胞,诱导细胞凋亡。Bcl-2 具有阻止细胞色素c 释放、抗细胞凋亡的作用,Bax 蛋白通过与Bcl-2 结合拮抗其作用,Bcl-2/Bax 的比例对细胞凋亡进程有重要影响。研究发现七氟烷预处理及后处理会显著增加Bcl-2,减少Bax 的表达。核因子κB(Nuclear factor kappa-B,NF-κB)在其中起触发和介质作用,能够上调Bcl-2,下调炎症因子,阻止caspase-3 及Caspase9 的活化表达,抑制心肌细胞凋亡[16]。因此七氟烷可能通过上调抗凋亡因子,下调促凋亡因子,改变细胞凋亡进程实现心肌保护。
2.6 激活G 蛋白-磷酯酰肌3 激酶丝/苏氨酸蛋白激酶(Phosphatidylinositol-3-kinase-serine/threonine,PI3K-Akt)
G 蛋白是在细胞信号传导途径中起重要作用的GTP结合蛋白,具有传递加强信号的作用,G蛋白-PI3K-Akt 信号通路参与调节细胞增殖、分裂、分化、凋亡等,对其生命活动有重要作用。Zaugg 等[17]研究发现,七氟烷可以通过激活腺苷受体,传递信号至胞内,激活G 蛋白偶联受体,促mKATP 通道开放来发挥心肌保护作用。七氟烷预处理及后处理均可通过激活PI3K-Akt 信号通路,增加Akt的磷酸化,在I/R 中发挥心肌保护作用。
2.7 激活酪氨酸激酶- 信号转录(Janus kinasesignal transducer and activator of transcription,JAKSTAT)
JAK 是一类非受体酪氨酸激酶家族,已发现成员有JAK1、JAK2、JAK3 及TYK1 等。JAK-STAT信号通路参与了多种重要细胞生命活动。Wu[18]等对成年大鼠单独使用2.4%浓度的七氟烷后处理,显著减少了其心肌梗死面积,并且增加了p-JAK2,p-STAT3 的表达。联合使用JAK2 抑制剂后作用被完全抵消。提示七氟烷后处理的心肌保护可能与JAK2-STAT3 的激活有关。
2.8 激活细胞外信号调节激酶1/2(Extracellular signal-regulated kinase 1/2,ERK1/2)
ERK1/2 属于细胞外信号调节激酶,参与细胞增殖、分化和存活等生理过程的调控。在大鼠MIRI 模型研究中发现,使用七氟烷预处理及后处理时,p-ERK1/2 及ERK1/2 活性明显增加,大鼠心功能得到明显改善,而增加pd9809(ERK1/2 抑制剂)后,七氟烷的心肌保护作用被消除,提示七氟烷可能通过上调p-ERK1/2,激活ERK1/2 途径实现心肌保护作用[19]。
2.9 其它相关机制
除上述机制外,七氟烷还可能通过调节血管活性因子一氧化氮(NO)的合成与释放抑制炎症反应及细胞凋亡[20]。上调缺氧诱导因子-1(Hypoxia inducible factor-1,HIF-1)改善线粒体功能[21]等其它途径发挥心肌保护作用,还需未来更多深入相关研究帮助阐明。
2.10 心肌保护机制间联系
如前所述,七氟烷的不同心肌保护作用机制间有一定关联性,相互促进或拮抗,实现共同作用,见图1。
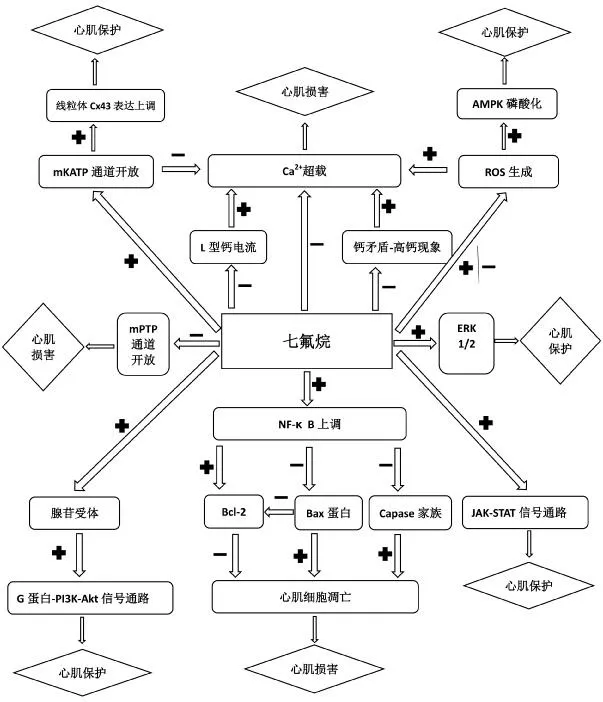
图1 心肌保护机制间联系
3 结语
综上所述,七氟烷预处理和后处理的心肌保护作用已经得到大量研究的证实,与上述多种不同机制相关。但目前仍存在不少模糊甚至相互矛盾的地方尚未阐明,可能与不同实验对象(动物或人)、七氟烷处理方式和时长不一等因素有关。未来的研究方向除了进一步明确病理生理学机制,继续寻找更加有力的基础证据外,还应该更加注重临床的实际应用研究,为今后临床工作提供更为可靠的指导方案,进一步改善患者的预后。
