颈动脉斑块在缺血性脑卒中高危人群肾功能进展中的价值研究
2022-01-07廖文珍胡少明邹福琛吴奇志林海南
廖文珍 胡少明 邹福琛 吴奇志 林海南
(福建省厦门市思明区嘉莲街道社区卫生服务中心,福建 厦门361010)
缺血性脑卒中(IS)是由于脑供血动脉狭窄或闭塞导致的脑组织缺血坏死,具有高致残率、高死亡率的特点,严重影响患者的生活[1]。动脉粥样硬化(CAS)的病理变化主要累及体循环系统的大、中型动脉,使其管壁增厚形成斑块,失去弹性,致动脉狭窄、闭塞,最终可导致缺血性改变[2],CAS的严重程度与IS存在明显相关性[3]。而CAS是一种系统性、繁琐的病理改变,可在多血管床中同时发生,当肾微血管出现病变时可能导致肾功能的下降[4]。因此,本文旨在探讨颈动脉斑块与缺血性脑卒中高危人群肾功能进展的关系,从而为社区开展该人群肾病预防和早期干预提供依据和针对性建议,现报道如下。
1 资料与方法
1.1 一般资料
采用观察性队列研究的方法,选取2018年1-3月在厦门市思明区嘉莲街道卫生服务中心接受检查,并完成血常规、肾功能、血脂、糖化血红蛋白及颈动脉彩超等筛查项目的体检者。按照国家卫生部2009年制定的《缺血性脑卒中筛查和防控指导规范(试行)》进行脑卒中高危人群筛查[5],排除已经诊断为缺血性卒中的人员、参加其他课题研究人员、不能配合完成问卷等,最终符合各项纳入标准缺血性脑卒中高危人群共258例。每位患者随访观察2年时间,2年后重复基线时所有检查。最终临床资料完整者为206例,按基线时颈动脉内是否有斑块分为颈动脉斑块组(简称斑块组,n=117)与颈动脉无斑块组(简称无斑块组,n=89)。2018年基线时颈动脉无斑块,但观察2年后到2020年出现新发斑块的患者,称为新发组(n=49);2018年基线时无颈部血管斑块,但观察2年后到2020年仍然无斑块的患者,称为持续无斑块组(n=68)。
1.2 方法
1.2.1 颈动脉超声检查采用西门子x600彩色超声诊断仪,探头频率5-10MHz。所有研究对象于上午空腹进行颈动脉超声检查,取仰卧位,右侧自无名动脉分叉处、左侧从主动脉弓起始处开始,连续观察颈总动脉、颈内外动脉分叉处、颈内动脉、颈外动脉主干及分支。观察血管走行,管壁光滑程度,测量颈动脉内-中膜厚度(IMT),观察有无斑块。动脉粥样硬化所致血管壁结构的病理改变在二维超声显像下主要表现为:血管壁增厚(主要是内、中膜增厚)及斑块形成。IMT<1.0 mm表示内膜无增厚,IMT≥1.0 mm表示内膜增厚,IMT≥1.2 mm定义为斑块[6]。
1.2.2 所有研究对象均于清晨空腹采血,采用法国产ABX MICROSCRP200全自动血球计数仪测定血红蛋白(Hb);采用日本产7020型日立全自动生化分析仪测定空腹血糖、糖化血红蛋白、白蛋白、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、尿酸等。eGRF采用CKD-EPI公式进行计算。
1.3 观察指标
以2018年第一季度健康体检时间作为起点,以死亡、失访或至随访结束(2020年3月31日)为终点。入组研究时测体重指数、血压、血红蛋白、空腹血糖、糖化血红蛋白、白蛋白、肾功能、血脂、尿酸及颈部彩超;每位患者观察2年后,复查肾功能及颈部彩超。
1.4 统计学方法
统计分析计量资料用均数±标准差表示,所有计量资料均经过正态性检验及方差齐性检验。队列间采用两独立样本t检验;自身前后对照采用配对t检验;用SPSS21.0软件进行数据的统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
比较基线时斑块组和无斑块组年龄、体质量指数(BMI)、血压、血红蛋白、空腹血糖、糖化血红蛋白、白蛋白、血脂以及尿酸,差异均无统计学意义(P>0.05)。见表1。
表1 两组患者一般资料比较(±s)
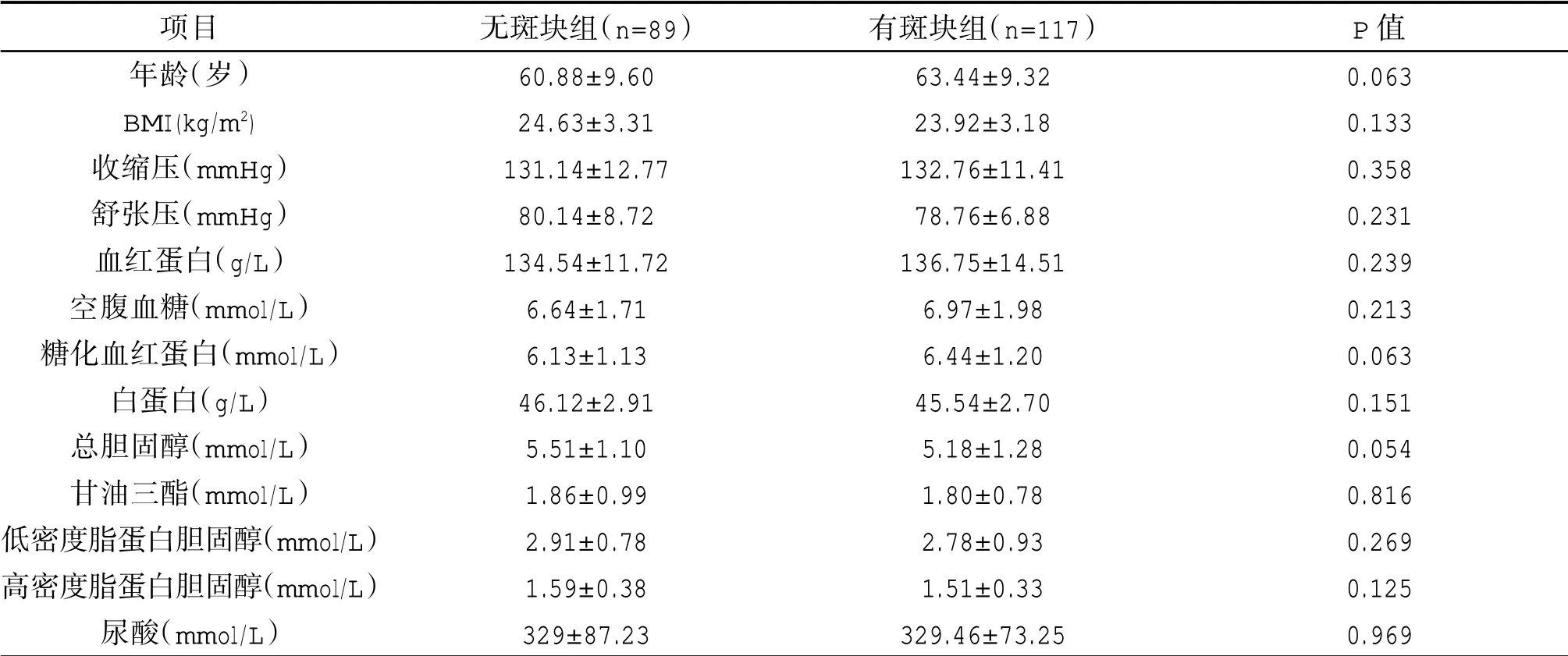
表1 两组患者一般资料比较(±s)
项目年龄(岁)BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)血红蛋白(g/L)空腹血糖(mmol/L)糖化血红蛋白(mmol/L)白蛋白(g/L)总胆固醇(mmol/L)甘油三酯(mmol/L)低密度脂蛋白胆固醇(mmol/L)高密度脂蛋白胆固醇(mmol/L)尿酸(mmol/L)无斑块组(n=89)60.88±9.60 24.63±3.31 131.14±12.77 80.14±8.72 134.54±11.72 6.64±1.71 6.13±1.13 46.12±2.91 5.51±1.10 1.86±0.99 2.91±0.78 1.59±0.38 329±87.23有斑块组(n=117)63.44±9.32 23.92±3.18 132.76±11.41 78.76±6.88 136.75±14.51 6.97±1.98 6.44±1.20 45.54±2.70 5.18±1.28 1.80±0.78 2.78±0.93 1.51±0.33 329.46±73.25 P值0.063 0.133 0.358 0.231 0.239 0.213 0.063 0.151 0.054 0.816 0.269 0.125 0.969
2.2 比较基线时斑块组和非斑块组肾功能情况
基线时,斑块组eGFR显著低于非斑块组,差异具有统计学意义(P<0.05),表明颈动脉存在斑块的患者肾功能总体较无斑块的患者差。见表2。
表2 比较基线时斑块组和非斑块组肾功能情况(±s)

表2 比较基线时斑块组和非斑块组肾功能情况(±s)
组别斑块组非斑块组F值t值P值例数(例)89 117 eGFR(mL/1.73m2 88.86±13.34 92.43±11.89 0.649-2.584 0.01)
2.3 比较随访前后自身肾功能情况
2018年基线有斑块的患者,随访2年后做自身配对比较,得出2020年eGFR显著低于2018年eGFR,差异具有统计学意义(P<0.05),表明有颈动脉斑块的患者2年后肾功能明显进展。2018年基线无斑块的患者,随访2年后做自身配对比较,得出2018年eGFR与2020年eGFR比较差异无统计学意义(P>0.05),表明无颈动脉斑块的患者2年后肾功能无明显进展。见表3。
表3 比较随访前后自身肾功能情况(±s)
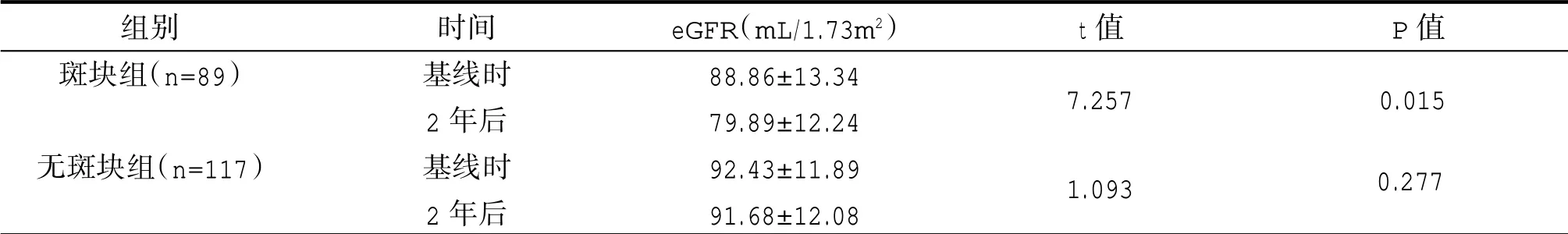
表3 比较随访前后自身肾功能情况(±s)
组别斑块组(n=89)无斑块组(n=117)时间基线时2年后基线时2年后eGFR(mL/1.73m2)88.86±13.34 79.89±12.24 92.43±11.89 91.68±12.08 t值 P值7.257 0.277 0.015 1.093
2.4 随访2年后比较斑块组和无斑块组肾功能情况
斑块组和无斑块组分别观察2年后,比较两组肾功能,得出斑块组2020年eGFR显著低于无斑块组eGFR,差异具有统计学意义(P<0.05),表明有颈动脉斑块的患者2年后肾功能进展明显比无斑块组快。见表4。
表4 随访2年后比较斑块组和无斑块组肾功能情况(±s)

表4 随访2年后比较斑块组和无斑块组肾功能情况(±s)
组别斑块组非斑块组F值t值P值例数(例)89 117 2020年eGFR(mL/1.73m2)79.89±12.24 91.68±12.08 0.091 7.339 0.005
2.5 比较新发组和持续无斑块组两组肾功能情况
2018年基线时颈动脉无斑块的患者有117例,观察2年后,有49例患者出现新发颈总动脉斑块,有68例仍未发现斑块,比较两组肾功能得出,新发组eGFR显著低于持续无斑块组eGFR,差异有统计学意义(P<0.05),表明新发颈总动脉斑块的患者肾功能进展快于持续无斑块组。见表5。
表5 比较新发组和持续无斑块组两组肾功能情况(±s)
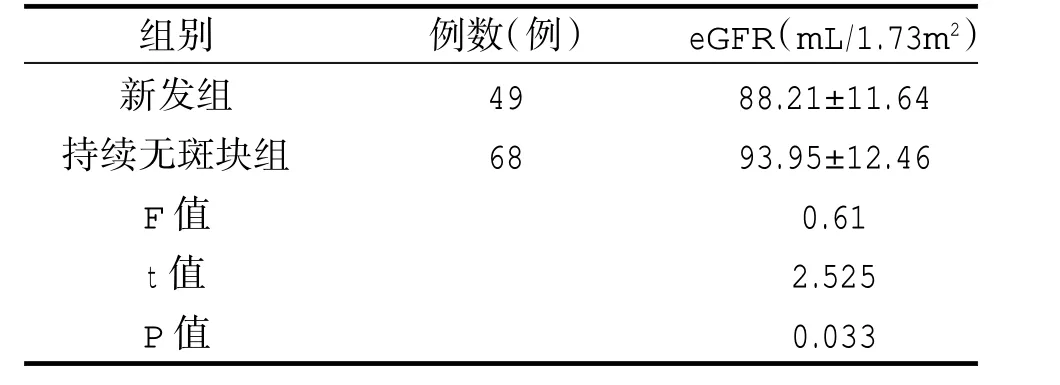
表5 比较新发组和持续无斑块组两组肾功能情况(±s)
组别新发组持续无斑块组F值t值P值例数(例)49 68 eGFR(mL/1.73m2 88.21±11.64 93.95±12.46 0.61 2.525 0.033)
3 讨 论
缺血性脑卒中是一种临床常见疾病,研究认为其病因为存在长期动脉粥样硬化、衰老、高血压和糖尿病等因素。缺血性脑卒中发生的常见原因是颈动脉粥样硬化斑块的形成,在颈动脉粥样硬化斑块引起的缺血性脑卒中中,不稳定斑块的破裂、出血、脱落等占主要原因[7]。动脉粥样硬化的基本病理学特征主要表现为动脉内膜脂质沉积、内膜片状纤维化,从而形成粥样斑块,引起管壁变硬、管腔狭窄,进而导致一系列继发缺血性病变[8]。动脉粥样硬化血管壁内、中膜厚度(IMT)≥1.2 mm定义为斑块。动脉粥样硬化是一种系统性、繁琐的病理改变,可在多血管床中(比如肾血管)同时发生。缺血可导致血管内皮损伤、炎症反应和肾内纤维化途径的激活,进而引发肾损伤[9]。因此,本研究通过观察性队列研究,阐述颈动脉斑块与缺血性脑卒中高危人群肾功能进展的关系。
本研究基线时斑块组eGFR88.86±13.34(m L/1.73m2),非斑块组eGFR 92.43±11.89(m L/1.73m2),差异具有统计学意义(P=0.01),表明颈动脉存在斑块的患者肾功能总体较无斑块的患者差。有研究显示,肾脏病与心脑血管疾病间相互影响,随着心脑血管疾病的发展,肾脏功能可发生不可逆转的损害[10]。推测颈部血管病变的患者,可能肾脏血管也同步病变,因此有颈部斑块患者表现为较差的肾功能。
2018年基线有斑块的患者,随访2年后做自身配对比较,得出2020年eGFR 79.89±12.24(m L/1.73m2)显著低于2018年eGFR 88.86±13.34(m L/1.73m2),差异具有统计学意义(P=0.015),表明有颈动脉斑块的患者肾功能比颈部无斑块的患者明显进展。2018年基线无斑块的患者,随访2年后做自身配对比较,得出2018年eGFR 92.43±11.89(m L/1.73m2)与2020年eGFR 91.68±12.08(m L/1.73m2)比较差异无统计学意义(P=0.277),表明无颈动脉斑块的患者2年后肾功能无明显进展。斑块组和无斑块组分别观察2年后,比较两组肾功能,得出斑块组2020年eGFR 79.89±12.24(m L/1.73m2)显著低于无斑块组eGFR 91.68±12.08(m L/1.73m2),差异具有统计学意义(P=0.005),表明有颈动脉斑块的患者2年后肾功能进展明显比无斑块组快。2018年基线时颈动脉无斑块的患者有117例,观察2年后,有49例患者出现新发颈总动脉斑块,有68例仍未发现斑块,比较两组肾功能得出,新发组eGFR 88.21±11.64(m L/1.73m2)显著低于持续无斑块组eGFR 93.95±12.46(m L/1.73m2)(P=0.033),表明新发颈总动脉斑块的患者肾功能进展快于持续无斑块组。
综上,通过基线状态、随访2年以及新发斑块的患者进行肾功能比较,均得出有颈动脉斑块的患者肾功能状态较差。
当肾微血管出现硬化时,会降低肾脏毛细血管灌注量,增加肾小球压、跨膜压,从而增加动脉管壁厚度,甚至导致肾小球硬化的出现[11]。因此,我们推测,颈动脉内-中膜增厚甚至颈动脉斑块形成作为反映全身动脉硬化的指标,不仅意味着大血管硬化,同时也预示肾脏微血管的硬化。在肾缺血缺氧的情况下,肾素-血管紧张素(RAS)系统活化,内皮源性因子合成和氧化应激增加,迸一步加重缺血和纤维化改变,出现蛋白尿,随着受损肾单位数量的增加,逐渐出现肾功能障碍[12]。肾脏微血管硬化可能导致肾小球毛细血管血流阻力增高,进一步引起肾小球内压升高,刺激系膜细胞分泌多种细胞因子及生长因子,造成系膜细胞肥大,产生细胞外基质,最终导致肾小球硬化,促进肾功能的恶化[13]。
综上表明,颈动脉斑块形成,可能预示着同步发生肾脏血管的硬化,可能导致或者加剧eGFR降低,我们的研究也验证了这一点。因此,临床上应该对缺血性脑卒中高危人群进行常规双侧颈动脉超声检查,对已形成颈动脉斑块或者新发颈动脉斑块的患者,应及早关注肾脏受损的指标,延缓肾功能的进展。但是,本研究作为观察性队列研究,样本量仍较少,观察时间仍较短,有一定的局限性。颈动脉斑块与缺血性脑卒中高危人群肾功能之间的关系还需大样本、前瞻性、随访研究进一步探讨。
