四君子颗粒抑制棕榈酸诱导的STC-1细胞凋亡
2022-01-07唐保露戚小宇马明悦郑书国
袁 萍 张 旭 唐保露 戚小宇 马明悦 郑书国
皖南医学院药理学教研室,安徽芜湖 241002
高血糖是2型糖尿病最主要的临床特征,也是糖尿病并发症发生发展和病情进行性加重的主要原因。因此,降血糖是糖尿病治疗最主要的措施,控制血糖贯穿于糖尿病治疗的始终[1]。然而,临床研究显示,目前的治疗措施均难以长期维持血糖稳定,随着病情发展,患者血糖控制都将逐渐恶化,最终只能依靠注射胰岛素控制血糖,造成这一现象的根本原因是胰岛功能的进行性减退[2]。肠促胰素效应的发现为2型糖尿病的治疗提供了新的思路。肠促胰素主要包括空肠K细胞分泌的葡萄糖依赖性促胰岛素多肽(GIP)和回肠、结肠等L细胞分泌的胰高血糖素样肽-1(GLP-1)等,二者在血糖调节中发挥重要作用。尤为重要的是,GLP-1对胰岛β细胞具有促进增殖、抑制凋亡的作用,对维持胰岛β细胞功能和数量平衡具有重要意义[3]。大量研究显示,2型糖尿病患者肠促胰素效应明显受损,GLP-1分泌明显减少,提示改善肠促胰素效应可能是阻止胰岛功能进行性减退的有效途径之一[4]。
糖尿病属于中医消渴病范畴,其发生发展与脾胃关系密切,其中脾气亏虚是消渴病的主要病机,“脾虚致消”“健脾愈消”是中医治疗消渴病的重要理论依据之一[5]。临床研究显示,益气健脾方药可明显提高2型糖尿病患者血浆GLP-1水平,降低血糖及糖化血红蛋白水平,改善临床症状,但其确切机制未明[6]。本研究采用体外培养的肠道L细胞株STC-1细胞,以血清药理学方法观察益气健脾经典方药四君子汤对棕榈酸诱导的细胞凋亡的影响,以探讨益气健脾方药促进肠促胰素效应、改善2型糖尿病的确切机制,为临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD大鼠(SPF级,220~240 g),购于浙江省实验动物中心,许可证号:SCXK(浙)2014-0001。
1.1.2 细胞株 小鼠小肠内分泌细胞株STC-1细胞,购于北纳生物。
1.1.3 药物与试剂 四君子颗粒,李时珍医药集团有限公司;DMEM培养液、胎牛血清,HyClone公司;caspase-3、caspase-9活性检测试剂盒,碧云天生物技术研究所;CCK-8测试试剂盒,上海贝博生物科技有限公司;CHOP抗体、p-PERK抗体、PERK抗体、Bcl-2抗体,Affinity Biosciences公司;Bax抗体,北京博奥森生物技术有限公司;ECL发光液,上海天能科技有限公司;其余试剂均为分析纯。
1.1.4 主要仪器 二氧化碳细胞培养箱,美国SIM公司;净化工作台,苏州安泰空气技术有限公司;高速冷冻离心机,德国Eppendorf公司;Mini PROTEAN转膜系统,美国Bio Rad公司;化学发光凝胶成像系统,美国Protein Simple公司;酶标仪,瑞士Tecan公司;流式细胞仪,美国BD公司。
1.2 方法
1.2.1 含药血清制备 SD大鼠30只,随机分为对照组、四君子颗粒高剂量组(10.50 g/kg)和四君子颗粒低剂量组(5.25 g/kg)。四君子颗粒组灌胃给予相应剂量四君子颗粒,对照组灌胃给予相应容量蒸馏水,连续7 d。第7天给药后2 h,戊巴比妥钠麻醉,无菌条件下腹主动脉取血,离心15 min分离血清,56℃水浴灭活30 min,-80℃冰箱密封保存。
1.2.2 细胞培养 STC-1细胞培养于DMEM培养液(含10%胎牛血清),于37℃、5%CO2、饱和湿度培养箱中培养。当细胞生长至80%~90%融合时,0.25%胰蛋白酶溶液消化,传代培养。
1.2.3 细胞活力检测 细胞活力采用CCK8法检测。用0.25%的胰蛋白酶消化细胞,按1×104/孔接种于96孔板,24 h后,将细胞随机分为正常对照组、模型组、空白血清对照组和四君子颗粒低、高剂量组。正常对照组及模型组加入普通培养液,空白血清对照组加入含10%对照血清的培养液,四君子颗粒低、高剂量组分别加入含10%含药血清培养液。孵育24 h后,正常组更换新鲜普通培养液,其余各组更换为含0.4 mmol/L棕榈酸的培养液,孵育72 h。每孔加入CCK8试剂20μL,继续孵育3 h,酶标仪测定450 nm处吸光度。
1.2.4 细胞凋亡检测 STC-1细胞以1×106/孔的密度接种于6孔培养板,细胞分组及药物处理同1.2.3项下。与棕榈酸孵育结束后,消化、收集细胞,冷PBS洗涤后加入400μL检测结合液重悬细胞,每管加入Annexin V-FITC染色液5μL,4℃避光孵育15 min,再加入PI染色液10μL,4℃避光孵育5 min,随后用流式细胞仪检测细胞凋亡水平(激发波长488 nm,发射波长525 nm)。
1.2.5 凋亡蛋白酶活性检测 将STC-1细胞均匀接种于6孔培养板(1×106/孔),细胞分组与药物处理同1.2.3项下。细胞与棕榈酸孵育72 h后,弃去培养液,PBS洗涤后加入预冷裂解液,冰浴裂解15 min,4℃、16 000 r/min离心15 min。吸取上清液,BCA法测定蛋白浓度,按试剂盒说明书测定caspase-3和caspase-9活性。
1.2.6 免疫印迹法检测蛋白水平 将STC-1细胞接种于6孔培养板中(1×106/孔),细胞分组及药物处理同1.2.3项下。与棕榈酸孵育72 h后,弃培养液,PBS洗涤2次,0.25%胰酶消化收集细胞,RIPA裂解液冰浴裂解细胞,4℃、12 000 r/min离心10min。收集上清液,BCA法测定蛋白浓度,SDSPAGE法分离蛋白、转膜,5%脱脂牛奶封闭2 h。分别加入Bax、Bcl-2、p-PERK、PERK、CHOP和β-actin抗体,4℃孵育过夜。TBST洗涤,加入二抗(辣根过氧化物酶标记)孵育2 h。TBST洗涤,加入ECL发光液显色,采用凝胶图像分析仪对目标条带光密度进行分析,结果以p-PERK/PERK、CHOP/β-actin、Bax/β-actin、Bcl-2/β-actin表示。
1.3 统计学分析
统计分析采用DAS1.0软件,定量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),两两比较采用LSD法,检验水准α=0.05。
2 结果
2.1 四君子颗粒对STC-1细胞活力的影响
由表1可见,与棕榈酸(0.4 mmol/L)孵育72 h后,STC-1细胞活力显著下降(P<0.01),说明棕榈酸诱导了STC-1细胞损伤。与四君子颗粒含药血清预孵可明显减轻棕榈酸诱导的细胞活力下降(P<0.05,P<0.01),而空白对照血清对细胞活力无明显影响,提示四君子颗粒可有效减轻棕榈酸诱导的STC-1细胞损伤。
表1 四君子颗粒对STC-1细胞活力的影响(±s,n=6)

表1 四君子颗粒对STC-1细胞活力的影响(±s,n=6)
注:SJZ(L):四君子颗粒低剂量组;SJZ(H):四君子颗粒高剂量组。与对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01,下同。
组别对照组模型组空白血清对照组SJZ(L)SJZ(H)F P剂量(g·kg-1)5.25 10.50细胞活力(OD450)1.11±0.14 0.49±0.10**0.47±0.09**0.65±0.05#0.80±0.09##42.339<0.001
2.2 四君子颗粒对STC-1细胞凋亡的影响
如图1和表2所示,正常组凋亡细胞很少,而与棕榈酸孵育72 h可引起细胞凋亡水平显著升高(P<0.01),主要表现为早期凋亡细胞明显增多。与四君子颗粒含药血清预孵24 h后再暴露于棕榈酸,细胞凋亡水平较模型组明显下降(P<0.05或P<0.01)。与空白对照血清预孵24 h对棕榈酸诱导的细胞凋亡水平无明显影响,提示四君子颗粒可明显抑制棕榈酸诱导的STC-1细胞凋亡。
表2 四君子颗粒对棕榈酸诱导的STC-1细胞凋亡的影响(±s,n=6)

表2 四君子颗粒对棕榈酸诱导的STC-1细胞凋亡的影响(±s,n=6)
注:SJZ(L):四君子颗粒低剂量组;SJZ(H):四君子颗粒高剂量组。
组别对照组模型组空白血清对照组SJZ(L)SJZ(H)F P剂量(g·kg-1)5.25 10.50细胞凋亡率(%)11.83±1.5 46.03±5.2**43.7±6.68*34.16±4.55#27.44±3.97##34.601<0.001

图1 四君子颗粒对棕榈酸诱导的STC-1细胞凋亡的影响
2.3 四君子颗粒对STC-1细胞凋亡蛋白酶活性的影响
由表3可见,暴露于棕榈酸(0.4 mmol/L)72 h后,STC-1细胞凋亡蛋白酶caspase-3和caspase-9活性均明显升高(P<0.01),而与四君子颗粒含药血清预孵24 h可明显降低棕榈酸诱导的凋亡蛋白酶活化(P<0.05或P<0.01)。空白对照血清对棕榈酸诱导的STC-1细胞凋亡蛋白酶活化无明显影响,提示四君子颗粒可明显抑制棕榈酸诱导的STC-1细胞凋亡蛋白酶活化。
表3 四君子颗粒对STC-1细胞凋亡蛋白酶活性的影响(±s,n=6)
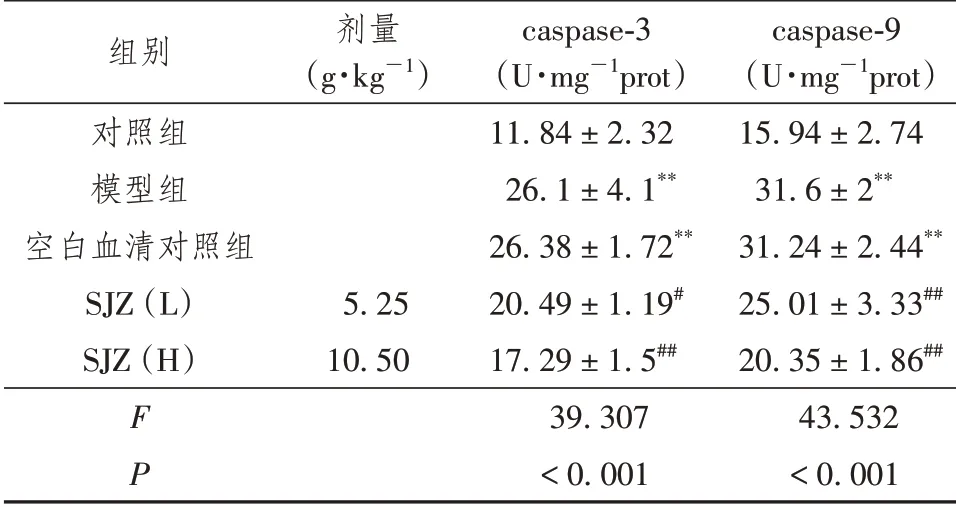
表3 四君子颗粒对STC-1细胞凋亡蛋白酶活性的影响(±s,n=6)
注:SJZ(L):四君子颗粒低剂量组;SJZ(H):四君子颗粒高剂量组。
组别对照组模型组空白血清对照组SJZ(L)SJZ(H)F P剂量(g·kg-1)5.25 10.50 caspase-3(U·mg-1prot)11.84±2.32 26.1±4.1**26.38±1.72**20.49±1.19#17.29±1.5##39.307<0.001 caspase-9(U·mg-1prot)15.94±2.74 31.6±2**31.24±2.44**25.01±3.33##20.35±1.86##43.532<0.001
2.4 四君子颗粒对棕榈酸诱导的内质网应激信号通路的影响
由图2和表4可见,对照组细胞内质网应激信号通路PERK蛋白磷酸化水平较低,其下游CHOP蛋白表达也较少。与棕榈酸孵育72 h,PERK磷酸化和CHOP蛋白表达水平均显著升高(P<0.01),提示棕榈酸在STC-1细胞诱导了内质网应激。与四君子颗粒含药血清预孵可明显抑制棕榈酸诱导的PERK磷酸化和CHOP蛋白表达(P<0.05或P<0.01),而空白对照血清对上述变化无明显影响,提示四君子颗粒可有效抑制棕榈酸诱导的STC-1细胞内质网应激。
表4 四君子颗粒对棕榈酸诱导的内质网应激相关蛋白水平的影响(±s,n=6)

表4 四君子颗粒对棕榈酸诱导的内质网应激相关蛋白水平的影响(±s,n=6)
注:SJZ(L):四君子颗粒低剂量组;SJZ(H):四君子颗粒高剂量组。与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别对照组模型组空白血清对照组SJZ(L)SJZ(H)F P剂量(g·kg-1)5.25 10.50 p-PERK/PERK 0.40±0.06 0.81±0.03**0.82±0.05**0.64±0.05##0.56±0.02##59.604<0.001 CHOP/β-actin 0.40±0.04 0.83±0.03**0.82±0.06**0.56±0.03##0.48±0.05##76.219<0.001

图2 四君子颗粒对棕榈酸诱导的内质网应激相关蛋白水平的影响
2.5 四君子颗粒对Bcl-2家族蛋白水平的影响
由图3和表5可见,与棕榈酸孵育72 h后,细胞内抗凋亡蛋白Bcl-2水平明显下降,而促凋亡蛋白Bax水平显著升高(P<0.01)。与四君子颗粒含药血清预孵可明显抑制棕榈酸诱导的Bcl-2家族蛋白水平改变(P<0.05或P<0.01),而空白对照血清对上述变化无明显影响,提示四君子颗粒可有效抑制棕榈酸诱导的Bcl-2家族蛋白表达改变,这可能是四君子颗粒抑制棕榈酸诱导的STC-1细胞凋亡的机制之一。
表5 四君子颗粒对STC-1细胞Bcl-2家族蛋白水平的影响(±s,n=6)

表5 四君子颗粒对STC-1细胞Bcl-2家族蛋白水平的影响(±s,n=6)
注:SJZ(L):四君子颗粒低剂量组;SJZ(H):四君子颗粒高剂量组。与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别对照组模型组空白血清对照组SJZ(L)SJZ(H)F P剂量(g·kg-1)5.25 10.50 Bcl-2/β-actin 0.72±0.06 0.41±0.04**0.40±0.05**0.52±0.04#0.59±0.09#19.617<0.001 Bax/β-actin 0.42±0.06 0.83±0.02**0.85±0.08**0.69±0.06#0.48±0.02##52.739<0.001

图3 四君子颗粒对STC-1细胞Bcl-2家族蛋白水平的影响
3 讨论
GLP-1是肠道L细胞分泌的肽类激素,可呈葡萄糖浓度依赖性促进胰岛素分泌,在血糖调节中发挥重要作用。此外,GLP-1可促进胰岛β细胞增殖、抑制其凋亡,对维持胰岛β细胞数量和功能稳态具有重要意义[7]。生理情况下,GLP-1的分泌除受葡萄糖调节外,血浆游离脂肪酸及其衍生物也可促进GLP-1分泌[8]。短期接触高浓度游离脂肪酸可促进GLP-1分泌,长期暴露则会加重L细胞负担,导致L细胞损伤(脂毒性),诱导细胞凋亡,进一步加重GLP-1分泌障碍。临床资料显示,90%以上2型糖尿病患者呈肥胖状态,这些患者除表现为高血糖外,其血浆游离脂肪酸水平也明显升高,并同时伴有L细胞功能障碍,其血浆GLP-1水平与肥胖程度呈负相关[9],这可能是2型糖尿病患者胰岛功能进行性减退的主要原因之一,提示保护L细胞、改善GLP-1分泌功能可能是阻止甚至逆转2型糖尿病胰岛功能进行性减退的有效措施之一。本研究采用体外培养的肠道L细胞株STC-1细胞,应用血清药理学的方法观察益气健脾方药四君子颗粒对L细胞的保护作用。结果显示,暴露于棕榈酸72 h后,STC-1细胞出现明显损伤,细胞凋亡增加,而四君子颗粒含药血清可明显减轻游离脂肪酸诱导的STC-1细胞损伤,抑制细胞凋亡,这一结果与益气健脾方药提高2型糖尿病患者血浆GLP-1水平、降低血糖及糖化血红蛋白水平、改善临床症状作用一致[6],提示益气健脾方药改善2型糖尿病可能与抑制肠道L细胞凋亡、改善肠促胰素功能有关。
游离脂肪酸及其衍生物可通过激动肠道L细胞表面的G蛋白偶联受体GPR40和GPR119促进GLP-1分泌,但长期暴露于高浓度游离脂肪酸将引起细胞内蛋白质合成与翻译后加工重要场所内质网负担加重,内质网内聚集大量未折叠或错误折叠蛋白,引发内质网应激[10]。此时细胞将首先启动未折叠蛋白(UPR)反应,如减少新合成蛋白向内质网转运、增加分子伴侣和折叠酶以提高内质网折叠能力、通过内质网相关蛋白降解途径(ER associated degradation,ERAD)加速未折叠蛋白降解过程等,以恢复内质网稳态。若内质网应激过强或持续时间过长,UPR无法恢复内质网稳态,细胞将启动凋亡进程,触发caspase级联反应并最终活化caspase-9和caspase-3,促使细胞凋亡[11]。CHOP基因广泛存在于哺乳动物细胞内,其编码的蛋白在内质网应激诱导细胞凋亡中发挥重要作用。内质网应激时,IRE-1、PERK、ATF6信号通路的活化均可诱导CHOP蛋白表达增加,其中PERK信号通路是CHOP表达的主要调控途径[12]。本研究结果显示,与棕榈酸孵育72 h后,STC-1细胞内PERK磷酸化水平及其下游转录因子CHOP蛋白均显著增加,凋亡蛋白酶caspase-9和caspase-3活性也明显升高,提示棕榈酸诱导的细胞凋亡与诱导内质网应激有关,这一结果与文献报道一致[13]。与四君子颗粒含药血清预孵后再暴露于棕榈酸,STC-1细胞内p-PERK及CHOP蛋白水平均明显低于模型组,caspase-9和caspase-3活性也明显下降,提示四君子颗粒抑制棕榈酸诱导的STC-1细胞凋亡与抑制内质网应激PERK信号通路有关。
此外,近年来研究发现,CHOP蛋白可上调Bcl-2基因家族中Bax、Bak等促凋亡基因表达,下调Bcl-2等抗凋亡基因表达,增加线粒体对促凋亡因子的敏感性,促进细胞凋亡[14]。本研究结果显示,与棕榈酸孵育72 h后,伴随CHOP蛋白表达增加,STC-1细胞内促凋亡基因Bax蛋白表达显著升高,而抗凋亡蛋白Bcl-2水平显著下降。与四君子颗粒含药血清预孵可明显升高Bcl-2蛋白水平,降低Bax蛋白水平,提示四君子颗粒抑制棕榈酸诱导的STC-1细胞凋亡与调节Bcl-2基因家族表达有关。
综上所述,四君子颗粒可有效抑制棕榈酸诱导的肠道L细胞株STC-1细胞凋亡,其机制与抑制内质网应激PERK-CHOP信号通路及调节Bcl-2基因家族蛋白表达有关。
利益冲突所有作者均声明不存在利益冲突