浓香型白酒窖泥微生物评价体系的构建
2022-01-07张梦梦吴玉轩吕志远胥鑫钰
张梦梦,吴玉轩,吕志远,苏 宁,胥鑫钰
(济南趵突泉酿酒有限责任公司,山东济南 250115)
浓香型白酒的生产是以窖泥微生物、大曲微生物、酒醅微生物等复杂的物质能量代谢为前提,其中窖泥微生物的作用使得浓香型白酒产生浓郁的窖香,因此窖泥微生物区系对白酒的风味与品质至关重要。
窖泥微生物属于厌氧发酵体系,其研究的难点在于大量具有重要代谢功能的微生物在实验室条件下难以培养[1]。而这些微生物群落组成及多样性反映了窖泥质量,并在很大程度上决定了浓香型白酒品质。窖泥中富集多种厌氧功能菌,主要为嫌气性梭状芽孢杆菌,它们参与浓香型白酒发酵的生香作用。据资料显示,老窖中嫌气芽孢杆菌超过新窖的3 倍。浓香型白酒以固态窖泥发酵为特征,窖泥中微生物的生长代谢活动对白酒风味物质的形成具有重要影响[2]。老熟窖泥的细菌多样性指数及均匀度指数高于新窖泥和趋老熟窖泥[3]。全面剖析窖泥中功能微生物菌群组成及多样性、窖泥质量与微生物群落之间的关联性为深入认识白酒生产机制,进而为从根本上提升白酒品质提供理论依据。同时也是带动白酒传统生产技术升级及实现白酒可持续发展的必要环节[4]。
广义的细菌是指所有的原核生物,是所有生物中数量最多的一类。细菌中有很多酿酒有益菌,对白酒风味起着举足轻重的作用,如:己酸菌是老窖发酵生香的一种功能菌;乳酸菌具有产乳酸酯的能力,并能将己糖同化为乳酸、酒精和CO2。不同的酿酒有益菌对白酒发酵均起着不可忽视的作用。
梭菌属是芽孢杆菌科的一个属,是能形成芽孢、厌氧生长的革兰氏染色阳性大杆菌,因芽孢常比菌体大,致使菌体呈梭状而得名,又称厌氧芽孢杆菌属。梭菌因其能够代谢合成白酒中的重要风味物质而被认为是窖泥中的优势菌之一,例如C.tyrobutyricum及C.butyricum的主要代谢产物为丁酸,同时伴有乙酸生成等[5]。
本次实验结果主要以PCR-DGGE 条带为依据,并将条带采取一定方法换算出条带分值。根据结果分析条带得分高低与窖池酒质的对应关系,找到适合本厂窖泥的微生物评价体系。因此,此实验对窖泥追踪、提高酒质、改良生产等有着重要的作用。
1 材料与方法
1.1 材料、试剂及仪器
窖泥样品:取样对象为浓香型窖池的池壁窖泥,由于时间原因,窖泥取样分4 轮不同窖池的窖泥。此次实验以窖泥普查为主,各轮次穿插同一窖池不同轮次的窖泥样品。因检修结束后(比正常轮次发酵期延长60 d),生产经验可知,优质原酒一般出现在中下层,故实验选择池壁下层窖泥取样分析。本次分析样本数目较丰富,共573 个窖泥样品,其中一轮164 个样品、二轮188 个、三轮170 个、四轮51 个。此报告主要针对四个轮次所取样品进行阶段性汇总分析,分细菌界和梭菌属两大体系进行实验。
试剂及耗材:Easy taq 酶、DNA Maker、loading buffer、GelStain 染液,北京全式金生物技术有限公司提供;DNA 提取试剂盒、丙烯酰胺、去离子甲酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷、尿素、四甲基乙二胺、过硫酸铵(均为分析纯),生工生物工程(上海)股份有限公司。
仪器设备:高速冷冻离心机,德国Sigma 公司;T100 型PCR 扩增仪、DCodeTM System 突变检测系统及凝胶成像仪,美国Bio-Rad 公司;DYCP-31 E型琼脂糖电泳仪,北京六一仪器厂。
1.2 试验方法
1.2.1 分析方法
为进一步探究原酒酒质、窖泥理化指标与窖泥微生物多样性之间的关联性,综合所有样品,对窖泥理化指标与窖泥微生物所对应指纹图谱进行了量化。
1.2.2 实验步骤
1.2.2.1 窖泥DNA提取
窖泥DNA 的提取采用基因组DNA 提取试剂盒,试剂盒具体组成见表1。

表1 DNA提取试剂盒具体组成
取0.22~0.23 g的窖泥,加入400 μL 65 ℃预热的Buffer SCL,振荡混匀,置于65 ℃水浴15 min;室温12000 r/min 离心3 min,吸取上清液转移至新的1.5 mL离心管中;加入等体积Buffer SP,颠倒混匀,冰浴10 min;室温12000 r/min 再次离心3 min,吸取上清液至一个干净的1.5 mL离心管中;加入200 μL氯仿,充分混匀,12000 r/min 离心5 min。吸取上层水相至一个干净的2 mL 离心管中;加入1.5 倍体积的Buffer SB,充分混匀后用移液器将其全部加入到吸附柱中,室温静置2 min;12000 r/min 离心30 s,倒掉收集管中废液;将吸附柱放回收集管中,加入700 μL Wash Solution,12000 r/min 离心30 s,倒掉收集管中废液;将吸附柱放回收集管中,加入300 μL Wash Solution,12000 r/min 离心1 min,倒掉收集管中废液;将吸附柱放回收集管中,12000 r/min离心2 min(此步绝不可省略,否则残余的乙醇会严重影响得率和后续实验)。取出吸附柱,放入一个新的1.5 mL 离心管中,在吸附膜中加入50~100 μL TE Buffer,静置3 min。12000 r/min 离心2 min,得到的DNA 溶液置于-20 ℃保存或直接用于后续试验。重复最后一个步骤或将TE Buffer 60 ℃预热,以此提高DNA的得率。
1.2.2.2 PCR扩增
配制所需样品的总体系,见表2。

表2 细菌体系(共50 μL)
细菌引物:
(1)上游引物:F338(含GC夹子)。
(2)下游引物:R518。
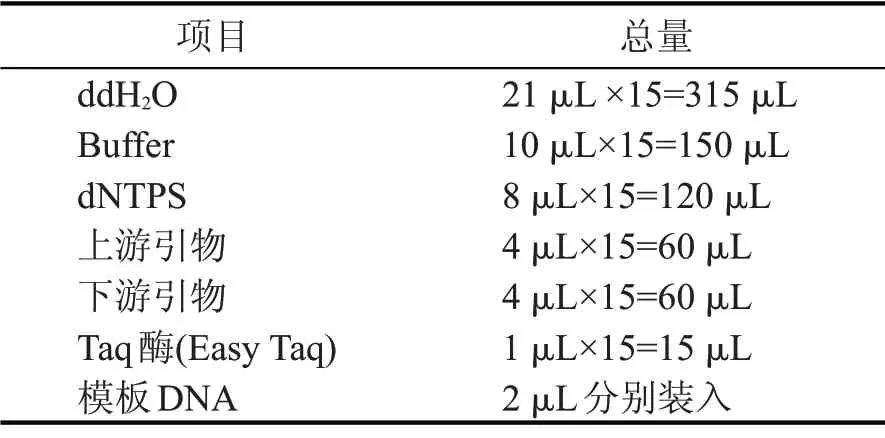
表3 梭菌体系(共50 μL)
梭菌引物:
(1)上游引物:SJ-F(含GC夹子)。
(2)下游引物:SJ-R。
注:分装完总体系,加模板DNA 时,注意换枪头,防止交叉污染。标记好顺序,防止混乱。
扩增体系配制结束后,混匀于PCR仪中进行扩增,不同类型菌种采用不同扩增方式。
1.2.2.3 琼脂糖凝胶电泳
(1)制胶
①称取0.3 g 琼脂糖于三角瓶中,加入20 mL 1×TAE缓冲液,加热溶解(注意琼脂糖完全溶解,壁上勿沾,混匀)。
②加热混匀后,加入1 μL gelstain(核酸染料),混匀充分。
③将混匀溶解后的琼脂糖溶液倒入事先准备好的模具中。
④室温凝固约30 min,凝固后,拔下梳子于电泳槽中待用。
⑤电泳槽中缓冲液(1×TAE)倒至约max 位置,使缓冲液没过凝胶,进行点样。
⑥将提取的DNA 与Loading Buffer 混匀后,点入到孔中(依次点入,不乱顺序)。
(2)点样结束后,插入电极,130 V,30 min左右。
此步骤用来检测DNA 是否提取成功,若用试剂盒提取后的DNA相对稳定,此步骤可省略。
1.2.2.4 DGGE(变性梯度凝胶电泳)
(1)制备丙烯酰胺凝胶
①将预先洗干净的制胶条安装正确。
②变性剂的制备。
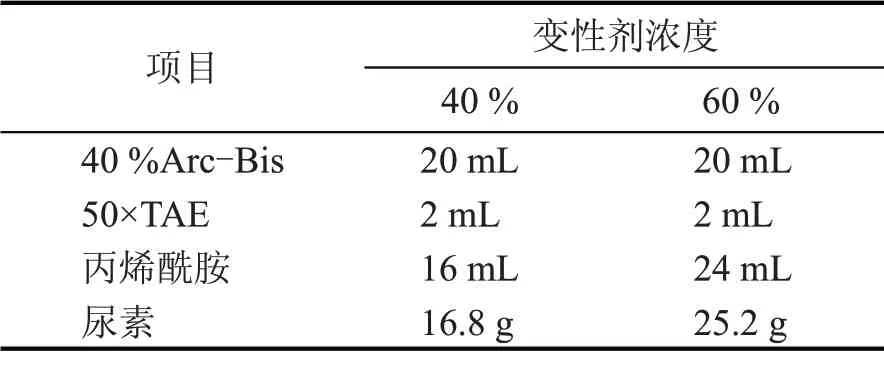
表4 细菌变性剂的制备

表5 梭菌变性剂的制备
相关药品加入完毕后,均定容至100 mL备用。
注:a.40 %Arc-Bis 制备法:Arc:38.93 g;Bis:1.07 g。
B.50×TAE 溶液制备:Tris-Base:242 g+500~600 mL H2O;EDTA:18.6 g+200 mL H2O。
水:750 mL;冰乙酸:57.1 mL。
③准备两个高低变性梯度的离心管,制备相应菌种变化梯度。
④将制好的高低浓度变性剂混匀充分,灌胶。
⑤凝胶制好后,轻轻插入梳子,避免产生气泡。
⑥凝胶待用,室温约凝4 h左右。
(2)点样,电泳
①细 菌:将PCR 扩 增好 的DNA 模板+9 μL Loading buffer(6×),离心混匀,全部吸取点入点样孔,缓冲液封孔,放入电泳槽内准备电泳,待液面到达run 线,设置仪器为20 V,20 min 冲洗泳道,之后电泳。

表6 菌种变化梯度
②梭菌:将PCR 扩增好的DNA 模板+9 μL Loading buffer(6×),离心混匀,全部吸取点入点样孔,缓冲液封孔,放入电泳槽内准备电泳,待液面到达run 线,设置仪器为20 V,20 min 冲洗泳道,之后按60 V+930 min条件进行电泳。
(3)染色
电泳结束后,在板内倒入染色液(核酸染料selstain),避光染色1 h,后于去离子水中清洗30 min左右,后于紫外线下显像观察。
(4)DGGE条带顺序
扩增,筛选条带较好的凝胶切下,于50 μL 无菌水中,65 ℃水溶和-20 ℃冰箱中反复冻融(4 ℃过夜也可),胶完全融化后作为DNA 模板放于4 ℃保存。
2 结果与分析
2.1 检修后细菌四轮窖泥评价与原酒酒质分析
本次实验就检修后第一轮至第四轮的540 个样品进行分析,去除25 个异常样品后,以横坐标为窖泥评价得分,定60 分为及格线;纵坐标代表平均己酸乙酯含量,其中一轮因发酵时间较长,己酸乙酯含量较高,因此己酸乙酯基准线定为5.2 g/L,其余三轮己酸乙酯基准线定3.8 g/L,据此绘制窖泥细菌评价与原酒酒质分布图。四轮对比图如图1所示。
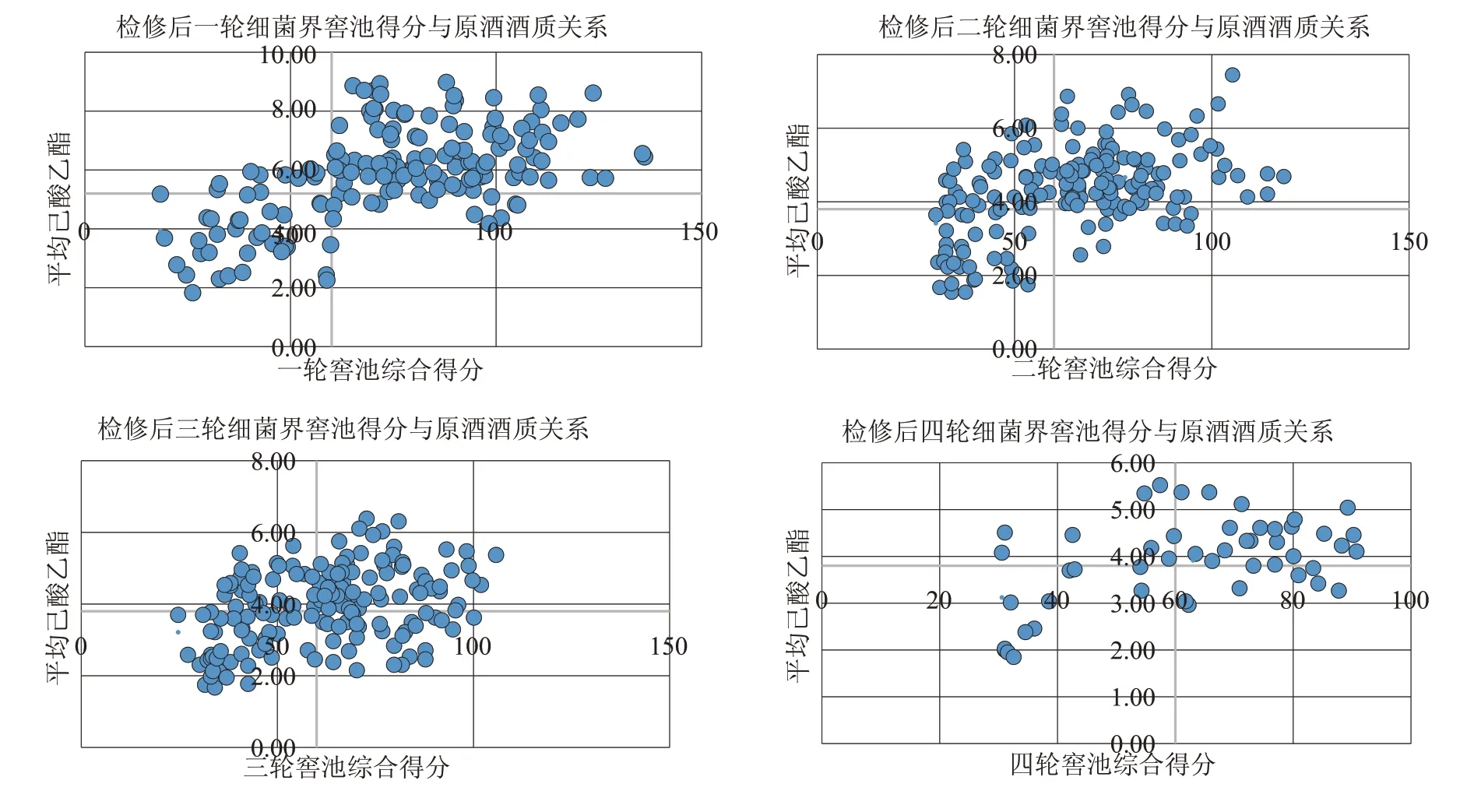
图1 检修后细菌界窖池得分与原酒酒质关系
图1 整体表现为一三象限数据多,二四象限数据少的规律。一三象限,主要呈现窖泥综合得分越高,平均己酸乙酯含量越高的规律,也就是窖泥综合得分与原酒酒质呈现正相关;二四象限呈现窖泥综合得分较低,但平均己酸乙酯较高或窖泥综合得分较高,但平均己酸乙酯较低的现象,出现这些偏离规律的数据,可能是窖泥质量不是决定原酒酒质的唯一因素,或者窖泥的评价体系并不完美。但是,大体规律还是有很强的指向性。
其中我们发现检修期后第一轮次酒质受窖泥影响比其他轮次要大,这应该与发酵时间有关系。因为检修期结束后,各窖池的发酵期均增加了60 d左右,己酸乙酯转化率提高。
由图2 可以看出,数据点主要集中在一三象限,且分布在渐近线两侧。可以得出数据总体的线性趋势呈正相关,即窖泥评价得分越高,平均己酸乙酯越高。
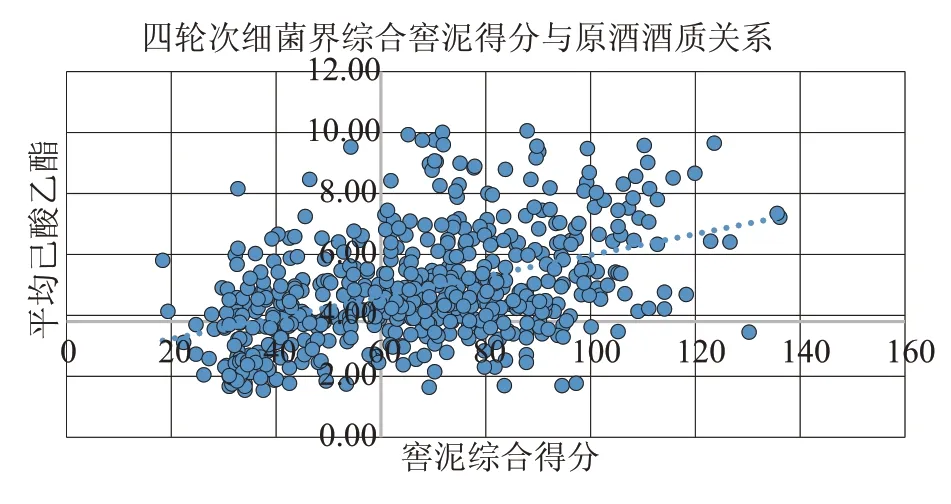
图2 四轮次细菌界综合窖泥得分与原酒酒质关系
白酒发酵是一个多微共酵的过程,窖泥微生物是决定白酒风味与品质的核心,但是发酵过程还受发酵时间、酒醅质量、发酵情况、人工操作等多因素的共同影响。
2.2 检修后梭菌四轮窖泥评价与原酒酒质分析
本次实验就检修后第一轮至第四轮的560 个样品进行分析,去除15 个异常样品后,以横坐标为窖泥评价得分,定60 分为及格线;纵坐标代表平均己酸乙酯含量,其中第一轮因发酵时间较长,己酸乙酯含量较高,因此己酸乙酯基准线定为5.2 g/L,其余三轮己酸乙酯基准线定3.8 g/L,据此绘制窖泥梭菌评价与原酒酒质分布图。四轮对比图如图3所示。
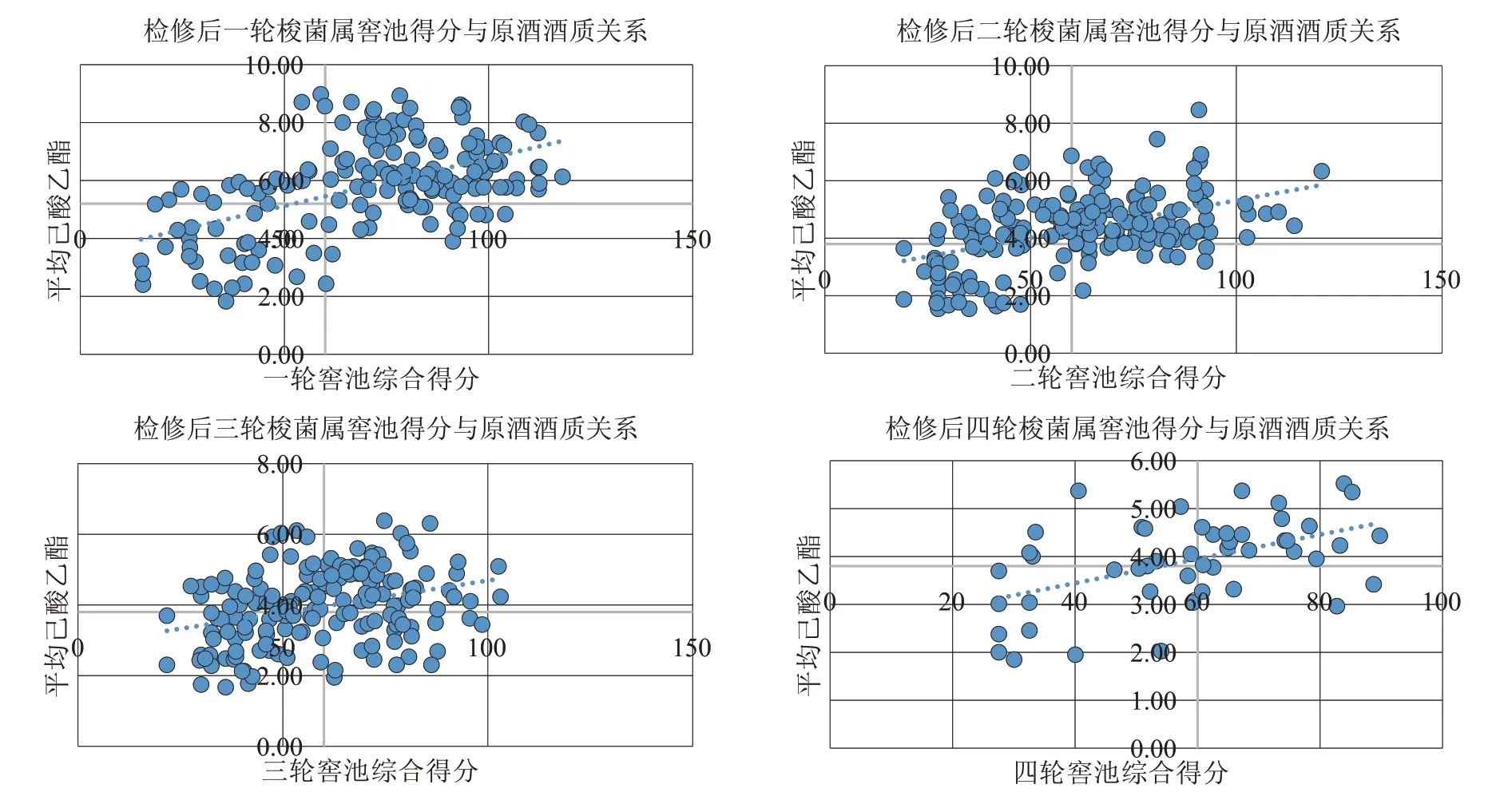
图3 检修后梭菌属窖池得分与原酒酒质关系
4 个轮次共有560 个数据,数据点分布平均,由图3 不难看出,梭菌属对比图与细菌界的对比图走向大致相同。整体呈现第一象限、第三象限窖池数据最多,第二象限、第四象限数据少的规律。且样品数据均分布在渐近线两侧,窖池综合得分与原酒酒质基本呈正相关,可以说明窖池综合得分越高原酒酒质越好,也可以说明梭菌属对窖泥质量有着重要影响。
此外还可以看出,梭菌属检修后第一轮窖泥样品总体最接近趋势线,可以得出检修后第一轮次受窖泥质量影响最大,后三轮次二四象限中偏离趋势线的点可以说明原酒酒质的好坏有诸多影响因素,窖泥质量的好坏只能作为影响原酒酒质的因素之一,还受发酵时间、操作过程等影响。
由图4 可以看出,梭菌属数据分布相比细菌界数据分布整体上移,可以看出梭菌对窖泥质量的影响较大。整体样品分布与细菌界相差不大,还是以一三象限为主,部分在第二象限和第四象限偏X 轴方向。这表明窖泥的综合得分与平均己酸乙酯总体成正相关,即窖泥质量较高的窖池,原酒酒质也较好,窖泥质量差的窖池,对应的原酒质量也较为逊色。
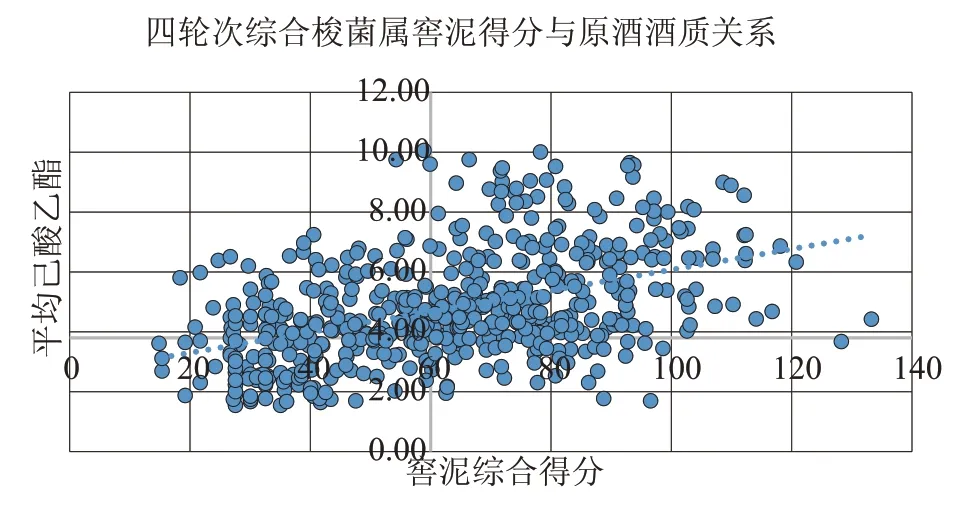
图4 四轮次梭菌属综合窖泥得分与原酒酒质关系
2.3 对细菌界、梭菌属的评价体系验证
为验证以上评价体系是否准确,现随机抽取20组质量等级不同的原酒样品及其所对应的窖泥样品。对其原酒酒质及窖泥样品分别进行检测分析,分析图谱如图5—图6。

图5 原酒酒质与细菌界窖泥得分关系
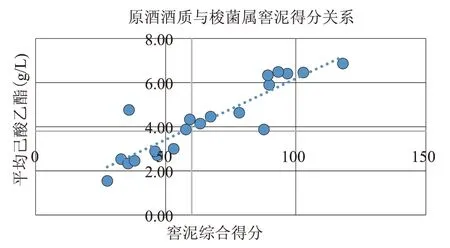
图6 原酒酒质与梭菌属窖泥得分关系
由图5、图6 可看出,窖泥微生物评价得分基本遵循原酒的酒质变化,这也说明所构建的窖泥微生物评价体系可以运用于实际生产中对整个窖池所产原酒质量的预估及评价。
3 结论
本次实验结果主要以PCR-DGGE 条带为依据,并将条带采取一定方法换算出条带分值。根据结果分析条带得分高低与窖池酒质的对应关系,找到适合本厂窖泥的微生物评价体系。对573 个窖泥样品的细菌和梭菌分析表明,窖泥质量对于原酒酒质有着举足轻重的作用,窖泥微生物多样性与原酒酒质两者相互联系、相互制约。原酒酒质的好坏与窖泥质量紧密相关,但窖泥质量不是影响原酒酒质的唯一因素,这与酒醅质量、人工操作、发酵情况等也有着千丝万缕的联系,只有各个影响因素都处于最适状态,酒质才能最大程度的提高。同时,退化窖泥、正常新窖泥及优质老窖泥的理化因子差异与细菌总量亦有相关性[5]。窖泥中微生物的种类和白酒的风味密切相关[6],总而言之,白酒的发酵是一个多微共酵的过程,只有各个影响因素均处于最优状态,原酒质量才能稳定提升。
