驼乳中产转糖基活性β-半乳糖苷酶乳酸菌的筛选鉴定及其酶学特性分析
2022-01-06韩明明褚宇欣胡有贞倪永清
韩明明,褚宇欣,关 波,胡有贞,李 谞,倪永清
(石河子大学食品学院,新疆 石河子 832000)
低聚半乳糖(galacto-oligosaccharides,GOS)是以乳糖或半乳糖为还原性末端,通过β-糖苷键连接一个或多个半乳糖单元形成的低聚糖混合物[1],是一种能调节肠道微生物菌群赋予宿主健康益处的益生元[2]。现有研究表明,GOS能促进人体肠道中的有益菌(如乳酸菌和双歧杆菌)最大限度地发挥其功能,促进肠道蠕动[3],减少肠道疾病的发病率[4],延长肾衰竭患者的生命[5],降低婴幼儿在遗传方面的疾病发生率等[6]。GOS具有模拟人乳寡糖的生理功效,是目前婴幼儿配方奶粉的重要成分[7]。据估计,GOS全球每年消费量在20 000 t左右,并以每年10%~20%的比例增长[8]。
GOS获取途径目前还十分有限,主要通过酶法合成,利用具有转糖基活性的β-半乳糖苷酶催化乳糖反应制得。β-半乳糖苷酶(EC 3.2.1.23),俗称乳糖酶,除了具有水解乳糖的功能,还能够在一定条件下以乳糖作为半乳糖基受体,催化合成具有不同聚合度和糖苷键类型的GOS[9]。乳糖浓度、水活度、温度、pH值等反应条件及β-半乳糖苷酶本身的特性均会影响以乳糖为底物反应合成GOS的得率[10]。不同微生物来源的β-半乳糖苷酶对转糖基反应受体的选择性也存在差异,酶源很大程度上决定了合成GOS产物的聚合度及糖苷键类型[5,11]。因此,近些年寻找安全、高效制备GOS的微生物新酶源成为研究热点[12]。
乳酸菌为公认安全(Generally Regarded as Safe,GRAS)菌株,其作为高转糖苷活性β-半乳糖苷酶的产酶菌株具有独特优势和价值[13]。到目前为止,利用乳酸菌β-半乳糖苷酶合成GOS的研究主要集中于Bifidobacteriumspp.、Lactobacillus plantarum、L.reuteri、L.paracasei及L.sakei等[14-18]。L.kefiri相比其他异型乳酸发酵Lactobacillus类群的来源更为有限,主要从开菲尔粒、啤酒及开菲尔饮料中分离获得[19]。近年有研究报道从哈萨克斯坦的驼乳中分离获得了L.kefiri[20],但源于L.kefiri的β-半乳糖苷酶合成GOS特性的研究尚未见报道。L.kefiri作为传统食品发酵微生物具有良好的安全性,已被欧盟食品安全局(European Food Safety Authority,EFSA)列入安全资格认定名录(Qualified Presumption of Safety,QPS)[21]。此外,L.kefiri具有较强的耐胆盐能力,与GOS共同作用能有效抑制Listeria monocytogenes等病原菌的生长[22],具有良好的益生潜能[23-25]。L.kefiri的这些特性对于开发安全、高产转糖基活性β-半乳糖苷酶的菌株并应用于GOS的合成及开发合生元产品将具有独特的优势。
本研究从采自新疆沙湾县的驼乳样品中筛选获得1 株产转糖基活性β-半乳糖苷酶的L.kefiri菌株,对其产酶条件、酶学性质及以乳糖为底物合成GOS的反应条件及产物成分进行分析,旨在为丰富转糖基活性β-半乳糖苷酶产酶菌株的来源,进一步开发利用乳酸菌β-半乳糖苷酶高效合成GOS奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
驼乳和骆驼酸乳均为新疆维吾尔自治区沙湾县西戈壁镇采集。样品于无菌采样袋中低温保存且当日运回,于冰箱4 ℃保存。
1.1.2 培养基与试剂
MRS培养基:蛋白胨10 g/L,酵母浸粉5 g/L,牛肉膏10 g/L,葡萄糖20 g/L,乙酸钠5 g/L,K2HPO42 g/L,MgSO4·7H2O 0.58 g/L,柠檬酸铵2 g/L,MnSO4·4H2O 0.25 g/L,吐温-80 1 mL/L,琼脂粉20 g/L,蒸馏水1 000 mL(pH 6.2~6.4),121 ℃灭菌15 min。
5-溴-4-氯-3-吲哚-β-D-半乳糖(X-Gal)、邻硝基苯-β-D-半乳糖苷(o-nitrophenylβ-D-galactopyranoside,o-NPG) 生工生物工程(上海)股份有限公司;Silica gel 60 No.553薄层层析(thin layer chromatography,TLC)板 美国默克公司;其他试剂均为国产分析纯。
X-Gal溶液:用二甲基甲酰胺溶解X-Gal配制成20 mg/mL的贮存液,于-20 ℃避光贮存。
o-NPG溶液:将250 mg邻硝基苯-β-D-半乳糖苷用80 mL反应缓冲溶液溶解,再用100 mL容量瓶摇匀定容,于-20 ℃保存。
1.2 仪器与设备
X7酶标仪 美国BioTek公司;LC-10A高效液相色谱(high performance liquid chromatography,HPLC)、RID-10A示差检测器 日本岛津公司;糖分析柱Hi-Plex Na Column(300 mm×7.7 mm) 美国Agilent公司;TC-512聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 英国Techne公司;5810R高速冷冻离心机 德国Eppendorf公司;2Y快速组织细胞破碎仪 天津欧诺仪器股份有限公司。
1.3 方法
1.3.1 样品初筛、纯化及保藏
在超净工作台中量取等分适量样品于装有灭菌生理盐水的锥形瓶内,振荡摇匀,即10-1的样品稀释液。用灭菌生理盐水的试管梯度稀释至10-5,分别取100 μL稀释液(10-3、10-4、10-5)均匀涂布到添加X-Gal以乳糖为碳源的MRS初筛平板上,37 ℃培养1~2 d,以菌落蓝白色进行初筛,挑取蓝色菌落在相同培养条件下纯化3 次。初筛菌株分别采用斜面和甘油法保藏。
1.3.2 粗酶液制备及酶活力测定
1.3.2.1 粗酶液制备
参考李琦等[26]的方法,略有修改。挑取活化后平板上的蓝色单菌落接种于MRS液体培养基中,37 ℃、160 r/min培养24 h,4 ℃、8 000 r/min冷冻离心收集菌体,用pH 6.5、0.05 mol/L磷酸盐缓冲液等体积重悬,加入1 mg/mL溶菌酶反应3 h,移入含200 μm酸洗玻璃珠的击打管内,细胞破碎仪击打(0~4 ℃,击打48 s,停58 s,共320 s,击打4 次),8 000 r/min离心10 min,所得上清液即为粗酶液。
1.3.2.2β-半乳糖苷酶活力及蛋白含量的测定
参考王丽军等[27]的方法。取50 μLo-NPG(pH 6.5、0.05 mol/L磷酸盐缓冲液配制)与50 μL粗酶液加入酶标板孔中,37 ℃反应10 min后加入200 μL 0.5 mol/L碳酸钠溶液终止反应,静置5 min后,可见明显黄色,用酶标仪测其420 nm波长处的吸光度,计算酶活力。酶活力单位定义:1 min催化水解o-NPG生成1 μmol邻硝基苯(o-nitrophenyl,o-NP)消耗的酶量为1个酶活力单位(U)。
蛋白含量测定:参照Bradford法,以牛血清白蛋白为标准蛋白。取20 μL酶液与200 μL考马斯亮蓝G-250溶液加入酶标板孔中,室温下反应5 min后,用酶标仪测其595 nm波长处的吸光度,对照标准曲线计算蛋白含量(mg)。
比活力为单位质量蛋白的酶活力,用U/mg表示。
1.3.3 产酶菌株的鉴定
1.3.3.1 形态学和生理生化鉴定
将筛得菌株接种于MRS培养基37 ℃培养至长出单菌落,培养过程对菌落的色泽、大小、形状、透明度等特征进行观察记录。涂片,进行革兰氏染色,镜检观察。参考《伯杰细菌鉴定手册》对筛得菌株进行鉴定,以糖发酵实验、淀粉水解实验、过氧化氢酶实验、明胶液化实验和硫化氢实验结果比较其生理生化特性。
1.3.3.2 分子生物学鉴定
提取产β-半乳糖苷酶菌株基因组DNA,用细菌16S rRNA基因的通用引物27f和1492r进行PCR扩增,琼脂糖凝胶电泳鉴定PCR结果,PCR产物送往生工生物工程(上海)股份有限公司,进行通用引物27f和1492r的双向测序,将测序结果从NCBI-BLAST进行同源性比对分析,依据数据库中相关种属序列,建立系统发育树,进化距离的计算采用Neighbor-Joining法,在MEGA 6.0软件中用p-distances和Kimura-2 parameter双参数法构建,选用Bootstrap法评价进化树分支聚类的稳定性,重复1 000 次,得到产酶菌株的种属分类情况。
1.3.4 菌株产酶条件优化
1.3.4.1 碳源
将MRS培养基的碳源分别调整为1 g/100 mL乳糖、1 g/100 mL葡萄糖、0.5 g/100 mL乳糖+0.5 g/100 mL葡萄糖、2 g/100 mL乳糖、2 g/100 mL葡萄糖、1 g/100 mL乳糖+1 g/100 mL葡萄糖,37 ℃液体培养24 h,分别测定酶活力。
1.3.4.2 氮源
将MRS培养基的氮源分别调整为以蛋白胨、酵母浸粉、牛肉膏、硫酸铵、尿素、蛋白胨+酵母浸粉(1∶1)、蛋白胨+牛肉膏(1∶1)、酵母浸粉+牛肉膏(1∶1)、蛋白胨+酵母浸粉+牛肉膏(1∶1∶1)为氮源,总氮源质量浓度为1 g/100 mL,37 ℃液体培养24 h,分别测定酶活力。
1.3.4.3 发酵初始pH值的影响
选择最适碳源和氮源,在不同的初始pH 3.5、4.5、5.5、6.5、7.5、8.5、9.5条件下液体培养后测定酶活力。
1.3.4.4 发酵时间的影响
选择最适碳源、氮源及初始pH值液体培养,48 h内每隔4 h取样,测定酶活力和菌体生长量(OD600nm)。
1.3.5β-半乳糖苷酶的初步纯化
取10 mL粗酶液,在4 ℃冰浴状态下,缓慢地加入对应40%饱和度的相应量硫酸铵固体并缓慢搅拌,避免蛋白质变性产生气泡,静置过夜,4 ℃、3 000×g离心30 min,收集沉淀,加入0.05 mol/L磷酸盐缓冲液(pH 7.0)溶解,于14 kDa透析袋中透析过夜,获得初步纯化的β-半乳糖苷酶。
1.3.6 酶学特性分析
1.3.6.1 最适反应温度
取初步纯化酶液,分别在45、50、55、60、65、70、75 ℃条件下与o-NPG反应,测其酶活力。
1.3.6.2 最适反应pH值
用不同pH值的磷酸盐缓冲液分别配制pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的o-NPG溶液,取初步纯化酶液,在最适温度下分别反应,测其酶活力。
1.3.6.3 金属离子对酶活力的影响
用1 mmol/L的NiCl2、MgCl2、BaCl2、KCl、NaCl、AlCl3、CaCl2、FeCl3、FeCl2等金属离子盐溶液配制o-NPG溶液,取初步纯化酶液,最适温度下分别反应,测其酶活力。
1.3.7 转糖基反应合成GOS条件优化
1.3.7.1 转糖基反应
50 μL粗酶液与300 μL 30%乳糖溶液40 ℃反应12 h,沸水浴灭酶10 min后,取10 μL样品,用无水乙醇稀释至1%。
1.3.7.2 乳糖为底物合成GOS的反应条件优化
取粗酶液50 μL与300 μL乳糖溶液分别在不同初始乳糖质量浓度(100、200、300、400、450 g/L)、反应温度(45、50、55、60、65、70、75 ℃)及反应时间(2、4、8、12、24 h)条件下进行转糖基反应,TLC法分析其产物,最终确定乳糖为底物合成GOS的最适反应条件。
1.3.8 TLC分析
参考李正义等[28]的方法。将硅胶铝板烘干活化,将无水乙醇稀释至1%的样品混匀,用毛细管点样,层析缸中以展开剂(正丁醇∶乙醇∶水=5∶3∶2)展开,完全展开后晾干,喷雾显色剂于120 ℃烘箱中烘烤20 min显色。扫描后用软件ImageJ(https://imagej.nih.gov/ij/)对不同颜色的斑点进行初步定量分析。
1.3.9 HPLC分析
参考王丽军等[27]的方法,稍有修改。用三蒸水将灭酶后的转糖基反应产物稀释至终质量浓度为1 g/100 mL,0.22 μm滤膜过滤后,使用RID-10A示差检测器,Hi-Plex Na低聚糖分析柱,三蒸水作流动相,流速0.2 mL/min,柱温80 ℃,进样量20 μL,进行HPLC分析。参考卢丽丽等[29]的方法,根据HPLC峰面积对反应产物中各糖组分进行定量。
1.4 数据处理
酶活力测定均设置空白对照,且测定结果为3 次平行实验所得。所有数据统计均使用Excel软件,采用Origin Pro软件绘制图表。
2 结果与分析
2.1 产酶菌株的筛选鉴定
2.1.1 产酶菌株的筛选
在含X-Gal的MRS平板上初筛得到20 株产β-半乳糖苷酶菌株,初筛菌株的产酶水平见表1。
以液体发酵制备得到的粗酶液催化30 g/100 mL乳糖溶液反应,反应产物进行TLC分析(图1A),GOS斑点灰度扫描半定量结果如图1B所示。共筛选获得转糖基活性较强的β-半乳糖苷酶产酶菌株6 株,其中骆驼酸乳来源1 株(LS2),驼乳来源5 株(L1、L4、L6、L10、L11),选择生成GOS产物最多的L6菌株开展进一步研究。

图1 复筛菌株转糖基反应产物的TLC(A)及GOS灰度定量(B)Fig.1 TLC analysis (A) of transglycosylation reaction products obtained with β-galactosidase from selected strains and gray values of GOS (B)
2.1.2 产酶菌株的鉴定
2.1.2.1 形态学及生理生化特性
驼乳及骆驼酸乳来源菌株均能在MRS平板上生成直径1 mm左右的圆形菌落,菌落颜色为乳白色,革兰氏染色阳性,驼乳中筛选所得菌株L1~L16为杆状,骆驼酸乳来源菌株LS1~LS4为链球状。
对具有明显转糖基活性的6 株菌L1、L4、L6、L10、L11、LS2进行生理生化鉴定结果见表2。6 株菌均能发酵乳糖和葡萄糖,均不能发酵阿拉伯糖、半乳糖和鼠李糖,驼乳来源菌株L1、L4、L6、L10及L11都不能发酵麦芽糖、甘露糖、木糖和蔗糖,LS2则能发酵麦芽糖、甘露糖、木糖和蔗糖,6 株菌的明胶液化实验、淀粉水解实验、硫化氢实验均为阴性。

表2 产转糖基活性β-半乳糖苷酶菌株的生理生化鉴定Table 2 Physiological and biochemical identification of strains producing β-galactosidase with transglycosyl activity
2.1.2.2 分子生物学分析
对6 株产β-半乳糖苷酶菌株的16S rRNA基因序列进行BLAST比对分析,并选择同源序列进行系统进化分析。结果显示(图2),筛选菌株L1、L4、L6、L10、L11与开菲尔乳杆菌(L.kefiri)归为一支,LS2则与肠膜明串珠菌(Leuconostoc mesenteroides)归为一支。
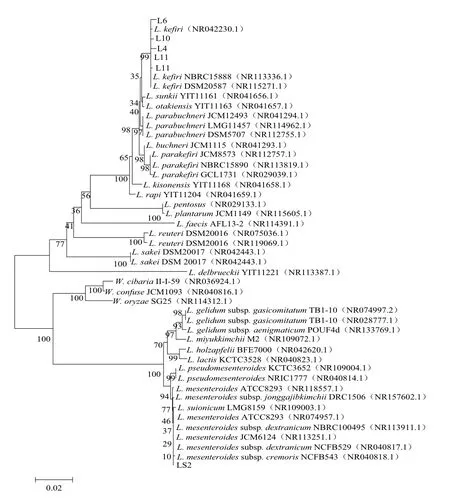
图2 产β-半乳糖苷酶菌株的系统进化分析Fig.2 Phylogenetic analysis of β-galactosidase-producing strains
2.2 产酶条件优化
2.2.1 碳源对产β-半乳糖苷酶的影响
分析碳源对L.kefiriL6产酶的影响,分别测定菌液OD600nm及酶活力,结果见图3。以2 g/100 mL乳糖为碳源时,产酶水平最高,为(2.11±0.01)U/mL,表明该β-半乳糖苷酶为诱导酶。
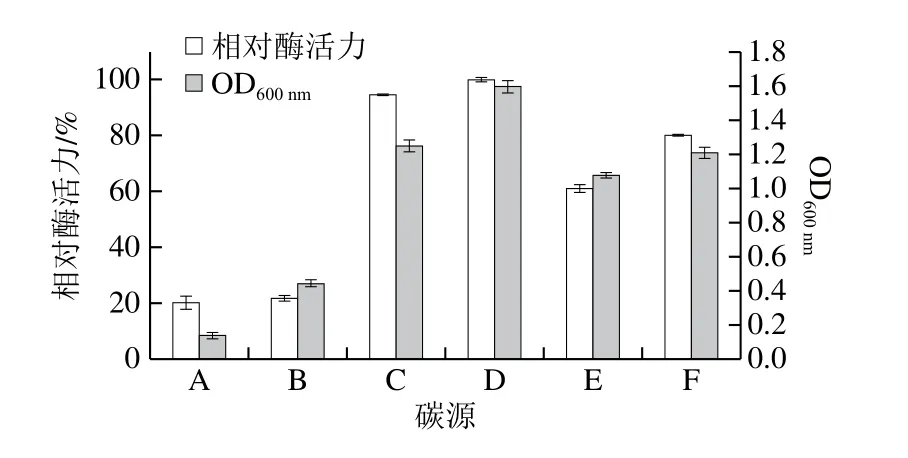
图3 碳源对产β-半乳糖苷酶的影响Fig.3 Effect of carbon source on the production of β-galactosidase
2.2.2 氮源对产β-半乳糖苷酶的影响
分析氮源对L.kefiriL6产酶的影响,分别测定菌液OD600nm及酶活力,结果见图4。菌株以蛋白胨和牛肉膏为氮源时,其产酶水平为(0.58±0.01)U/mL;以蛋白胨、牛肉膏和酵母浸粉为氮源时,其产酶水平最高,可达(3.31±0.01)U/mL,表明酵母浸粉为该菌株产β-半乳糖苷酶的重要氮源。

图4 氮源对产β-半乳糖苷酶的影响Fig.4 Effect of nitrogen source on the production of β-galactosidase
2.2.3 培养基初始pH值对产β-半乳糖苷酶的影响
为分析培养基初始pH值对L.kefiriL6产酶的影响,以柠檬酸-磷酸盐缓冲液配制不同pH值的培养基进行发酵培养,37 ℃培养24 h,分别测定菌液OD600nm及酶活力,结果见图5。菌体生长量与产酶水平变化趋势一致,pH 5.5~6.5时,相对酶活力均达90%以上,pH 5.5时,产酶水平最高,为(2.99±0.02)U/mL。

图5 发酵初始pH值对产β-半乳糖苷酶的影响Fig.5 Effect of initial medium pH on the production of β-galactosidase
2.2.4 发酵时间对产β-半乳糖苷酶的影响
为得到L.kefiriL6的产酶曲线,将其接种至上述优化后的培养基中,37 ℃培养48 h,间隔4 h测定菌液OD600nm及酶活力(图6)。结果表明,该菌株在培养20 h产酶水平最高((3.81±0.02)U/mL),4~20 h培养基中菌体的生长量变化趋势与产酶趋势基本一致。20 h以后,菌体生长达到稳定期,产酶量逐渐降低。

图6 发酵时间对产β-半乳糖苷酶的影响Fig.6 Effect of fermentation time on the production of β-galactosidase
2.3 β-半乳糖苷酶的初步纯化
L.kefiriL6菌株破碎所得粗酶液经饱和度40%硫酸铵初步纯化,其纯化过程的相关参数见表3。硫酸铵初步纯化的回收率为70%,比活力可达142.47 U/mg。
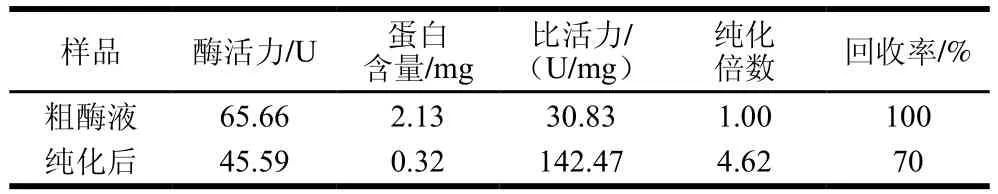
表3 β-半乳糖苷酶的初步纯化Table 3 Preliminary purification of β-galactosidase
2.4 酶学特性分析
2.4.1 pH值对酶活力影响
如图7所示,该酶在pH 6.0~9.0范围内活性较高,相对酶活力均能保持60%以上,pH 7.0时,该酶相对酶活力最高。pH 3.0~4.0时酶活力基本丧失。

图7 pH值对酶活力的影响Fig.7 Effect of pH on enzyme activity
2.4.2 温度对酶活力影响
如图8所示,菌株L.kefiriL6所产β-半乳糖苷酶的最适催化温度为55 ℃,这与王欣等[30]的研究结论相同。该酶催化反应的温度范围较宽,45~70 ℃均能保持50%以上相对酶活力。75 ℃时,相对酶活力降低至20%以下。

图8 温度对酶活力的影响Fig.8 Effect of temperature on enzyme activity
2.4.3 金属离子对酶活力影响
不同金属离子对菌株L.kefiriL6所产β-半乳糖苷酶的酶活力具有较为明显的影响,结果如图9所示。Mg2+对该酶有明显的激活作用,相对酶活力约为对照的1.93 倍。Ni2+、Ca2+和Al3+则对其酶活力有明显的抑制作用,而其他金属离子如Na+、K+、Ba2+、Fe2+、Fe3+对其酶活力无明显影响。
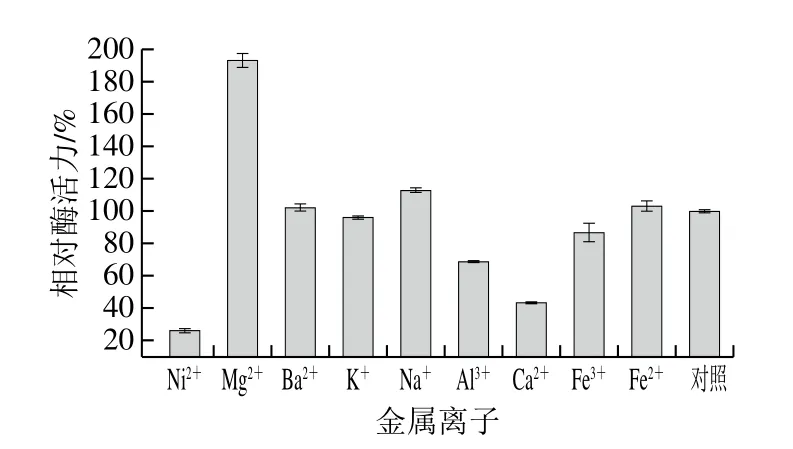
图9 金属离子对酶活力的影响Fig.9 Effect of metal ions on enzyme activity
2.5 转糖基反应条件优化
2.5.1 乳糖质量浓度对转糖基反应的影响
如图10所示,随反应体系中初始乳糖质量浓度增加,GOS得率逐渐增加。当初始乳糖质量浓度为10 g/100 mL时,GOS得率仅3.34%(m/m,下同),乳糖残留量为0.72%(m/m,下同);初始乳糖质量浓度升高至45 g/100 mL时,GOS得率最高达17.60%,此时,乳糖残留量为14.40%。
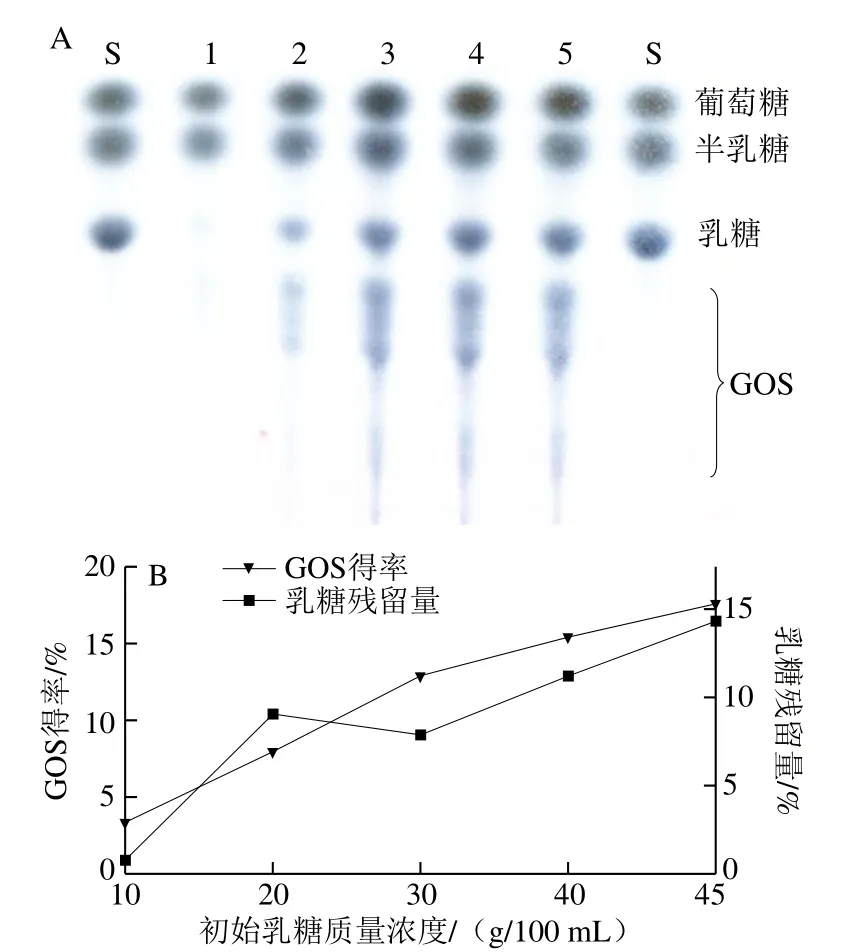
图10 不同初始乳糖质量浓度反应产物的TLC(A)及GOS、残留乳糖的HPLC定量分析(B)Fig.10 TLC analysis (A) and HPLC quantification of GOS and residual lactose (B) at different initial lactose concentrations
2.5.2 转糖基反应温度优化
以45 g/100 mL的乳糖质量浓度,分别在45、50、55、60、65、70、75 ℃进行转糖基反应,TLC分析其产物,结果见图11。在45~60 ℃时,均有水解产物和转糖基产物生成;65 ℃时GOS得率最高,可达26.12%;反应温度升高至75 ℃,乳糖残留量增至93.55%,GOS得率急剧降低,仅为6.92%。因此,菌株L.kefiriL6所产β-半乳糖苷酶合成GOS最适反应温度为65 ℃。

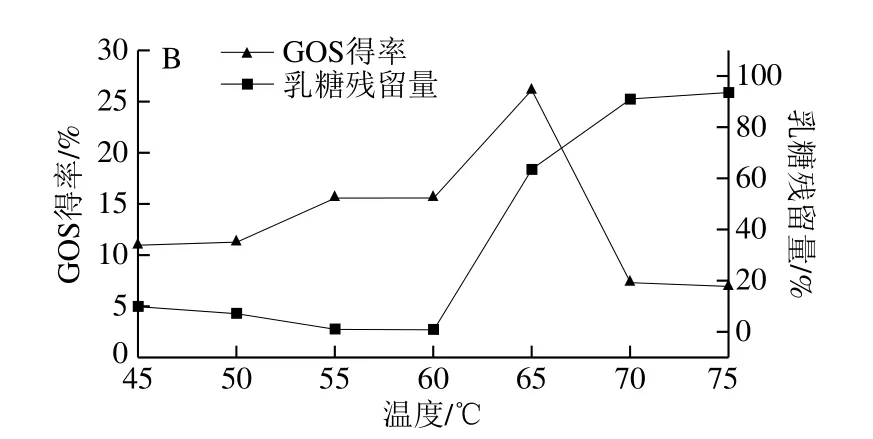
图11 不同温度转糖基反应产物的TLC(A)及GOS、残留乳糖的HPLC定量分析(B)Fig.11 TLC analysis (A) and HPLC quantification of GOS and residual lactose (B) at different reaction temperatures
2.5.3 转糖基反应时间优化
转糖基反应体系中,该酶与乳糖反应2 h即有水解产物和转糖基产物生成。转糖基反应4 h时GOS得率最高,可达31.51%(图12)。反应时间继续延长,体系中乳糖残留量不断减少,反应至24 h,乳糖的水解率达到64.52%。4 h后,GOS得率逐渐降低,反应24 h后,GOS得率仅为20.49%。因此,菌株L.kefiriL6所产β-半乳糖苷酶催化合成GOS的最适反应时间为4 h。

图12 不同反应时间转糖基反应产物的TLC(A)及GOS、残留乳糖的HPLC定量分析(B)Fig.12 TLC analysis (A) and HPLC quantification of GOS and residual lactose (B) after different reaction times
2.6 最优反应条件下转糖基产物的组成分析
将乳糖质量浓度45 g/100 mL、65 ℃条件下转糖基反应4 h的GOS产物进行HPLC分析。保留时间52.040 min的峰为半乳糖,保留时间48.393 min为葡萄糖,40.612 min为二糖(乳糖和转移二糖未分离),34.530 min为半乳三糖,16.223~30.052 min之间的峰为三糖以上的GOS成分。
根据图13各GOS组分对应的HPLC峰面积计算各GOS组分得率。最适反应条件下生成的转糖基产物中半乳糖为11.06%,葡萄糖为21.16%,二糖(包括乳糖和转移二糖)为49.78%,转移三糖为13.85%,转移三糖以上的GOS为4.15%。结合ImageJ对TLC斑点扫描结果分析,确定乳糖36.27%,转移二糖为13.51%。综上,L.kefiriL6催化合成GOS得率为31.51%,酶催化反应形成的GOS主要为转移二糖和转移三糖。

图13 转糖基反应产物的HPLC分析Fig.13 HPLC analysis of the transglycosylation reaction products
3 讨 论
β-半乳糖苷酶因其来源广泛,具有乳糖水解和转半乳糖基活性,被广泛应用于乳糖的水解和GOS的合成。一般来说,GOS得率随着乳糖质量浓度的增加而增加,其酶源和反应条件(乳糖质量浓度、水活度、温度、pH值等)对合成的GOS得率和组成有显著影响[31]。目前合成GOS的商业化β-半乳糖苷酶制剂主要来源于米曲霉(Aspergillus oryzae)、乳酸克鲁维酵母(Kluyveromyces lactis)和环状芽孢杆菌(Bacillus circulans)[32]。不同来源的β-半乳糖苷酶其活性存在显著差异[33],仍需不断寻找新酶源以高效合成GOS。
本研究从新疆沙湾县采集的驼乳样品中分离筛得6 株高转糖基活性菌株,5 株为骆驼乳来源,1 株为骆驼酸乳来源。其中,L6的产酶水平及转糖基活性均较高,结合形态、生理生化及分子生物学方法将L6菌株鉴定为L.kefiri。L.kefiriL6所产β-半乳糖苷酶的最适反应pH值为7.0,这与已报道的细菌来源β-半乳糖苷酶最适pH值一般介于6.0~7.5一致[34]。不同温度下,酶的催化活性差异显著[35],最适温度高于50 ℃的β-半乳糖苷酶一般被称为耐热β-半乳糖苷酶[34]。已报道的耐热性较强的β-半乳糖苷酶主要有来源于Bacillus coagulans的β-半乳糖苷酶,其最适反应温度为65 ℃[36];来源于Thermotoga maritime的β-半乳糖苷酶最适反应温度为80 ℃[37];来源于Thermussp.的β-半乳糖苷酶最适反应温度为85 ℃[38]。L.kefiriL6所产β-半乳糖苷酶的催化反应温度范围较宽,该酶的最适反应温度为55 ℃,45~70 ℃均能保持50%以上相对酶活力,温度高达75 ℃时,相对酶活力才降至20%以下。因此,该菌株所产β-半乳糖苷酶在低乳糖乳品的加工过程中具有良好的应用前景。
L.kefiriL6菌株所产β-半乳糖苷酶在初始乳糖质量浓度为45 g/100 mL、65 ℃反应4 h,GOS得率达到最高,约31.51%,这与Vénica等[39]报道的达到最高GOS得率通常需反应1~5 h一致。随着转糖基反应时间延长,体系中乳糖残留量不断减少,反应至24 h,乳糖水解率达到64.52%,这与郑义等[40]以马克斯克鲁维酵母来源的β-半乳糖苷酶反应50 h,得到68.34%的乳糖水解率较相似。4 h后,GOS得率逐渐降低,可能是反应体系中底物乳糖的质量分数逐渐降低,转糖基反应产物不断积累,导致反应更多向水解反应方向进行[32]。本研究所得GOS得率与已报道的马克斯克鲁维酵母[40]34.70%的GOS得率和长双歧杆菌来源β-半乳糖苷酶32.50%的GOS得率[9]接近,但低于王丽军等[27]报道的L.plantarumYLBGNL-S7来源β-半乳糖苷酶43.40%的GOS得率,表明菌株的来源可能对其所产β-半乳糖苷酶的转糖基活性影响更大。L.kefiriL6菌株所产β-半乳糖苷酶在其最佳的转糖基反应条件下生成的GOS中,转移二糖约为13.51%,转移三糖约为13.85%,转移三糖以上的GOS约为4.15%;L.plantarumWCFS1[41]来源的β-半乳糖苷酶合成GOS,生成的转移二糖19%、转移三糖21%、转移四糖1.3%;L.plantarumYLBGNL-S7来源的β-半乳糖苷酶合成GOS,转移二糖和转移三糖分别为18.29%和12.95%,转移三糖以上的GOS质量分数为12.17%,不同来源的β-半乳糖苷酶合成GOS的种类及数量均存在一定差异[42-44]。
4 结 论
本研究从新疆沙湾县驼乳样品中筛选获得转糖基活性较高的β-半乳糖苷酶产酶菌株L.kefiriL6。该酶的催化反应温度范围较宽,最适反应温度为55 ℃,45~70 ℃均能保持50%以上相对酶活力;以45 g/100 mL乳糖为底物,65 ℃、pH 7.0条件下反应4 h生成的转移二糖为13.51%,转移三糖为13.85%,转移三糖以上的GOS为4.15%,该菌株为酶法合成GOS提供了新的乳酸菌酶源。
