甲状腺微小乳头状癌及术后颈部转移淋巴结的超声介入治疗研究进展
2022-01-06黄凯峰张旭旭马苏美
黄凯峰,郑 悠,张旭旭,马苏美
1. 重庆大学附属肿瘤医院超声医学科,重庆 400030;
2. 重庆医科大学附属第二医院放射科,重庆 400010;
3. 甘肃省人民医院超声医学科,甘肃 兰州 730000;
4. 兰州大学第一医院超声医学科,甘肃 兰州 730000
甲状腺癌已成为发病率上升最快的癌症,病理学分型为乳头状癌、滤泡状癌、髓样癌及未分化癌,其中75%为甲状腺微小乳头状癌(papillary microcarcinoma of the thyroid,PTMC),即直径<10 mm的甲状腺乳头状癌[1]。PTMC生物学特征同乳头状癌一样,虽总体趋于惰性,预后较好,但颈部淋巴结易转移,中央区淋巴结转移率为20%~90%[2],即使术中进行预防性清扫颈部淋巴结,仍有15%~30%的患者术后发生淋巴结转移,影响患者长期生存率[3]。PTMC和颈部转移淋巴结的治疗方式首选手术切除,但针对部分患者,有医疗机构尝试超声引导下介入治疗消除病灶,而对此方式争议较大,不同的科室及机构所得出的结论不尽相同,同时也存在滥用介入技术导致过度治疗的趋势,故有必要探讨超声介入治疗在PTMC及转移淋巴结中的规范运用。
1 PTMC及颈部转移淋巴结治疗现状
1.1 颈部开放手术和腔镜手术治疗PTMC
PTMC对放化疗不敏感,首选治疗方式为手术切除,国内大多同时行颈部中央区淋巴结预防性清扫术,患者10年生存率达90%以上[4]。但外科开放手术创伤较大,颈部常留有L型切口瘢痕,即使采用低领式小切口,颈部仍留有瘢痕,同时颈部淋巴结清扫发生并发症风险较高,甲状腺全切患者术后常需终身服用甲状腺激素,使得一部分患者不接受或不能耐受外科开放手术。
近几年用于PTMC切除的腔镜甲状腺手术分为腔镜辅助下颈部小切口手术(改良Miccoli手术)和全腔镜下手术。改良Miccoli手术选取颈下正中≤2 cm的切口,而全腔镜下根治手术主要为经乳晕入路,术后切口隐蔽,两种腔镜术式均利用高清监视系统放大了局部解剖,能很好地保护喉返神经、甲状旁腺等重要组织器官,并降低术后并发症风险,同时术后瘢痕相较传统开放手术更为美观[5],但操作难度大,手术时间长,术中出血量较大,患者术后疼痛感明显,改良Miccoli手术美容效果不理想,全腔镜手术存在需器械牵引切除腺体,易损伤血管等不足。而2014年起中国开展的机器人甲状腺手术多采用双侧乳晕腋窝入路,相较传统腔镜手术而言,因操作臂更灵活,使得清扫更为全面,对比传统腔镜手术,对双侧甲状腺癌患者处理优势更明显[6],但耗时费力,手术时间更长,难以在临床中推广。甲状腺缺乏生理性腔隙,各种腔镜手术易引起皮下软组织损伤,目前还不能代替传统外科开放手术。
1.2 低危PTMC的积极监控观察策略
有研究[7-8]认为,PTMC可能并非高危癌发展的早期阶段,汇总PTMC随访研究结果,PTMC相关死亡率低于0.3%,因此无淋巴结转移和组织侵犯的PTMC可被认为是一种低危的分化型甲状腺癌。进而有学者[9]提出对PTMC进行积极监控观察,即不立即手术切除,而采用密切随访和超声检查的方式观察PTMC进展,结果显示,10年随访期内15.9%患者结节体积增大(最大径增长超过3 mm),仅5.6%患者因结节体积增大(最大径增长超过10 mm)和颈部淋巴结转移而被建议转行手术治疗。鉴于PTMC的惰性,美国甲状腺协会(American Thyroid Association,ATA)指南指出[4],对于手术高风险以及无转移表现的PTMC,推荐行积极监控观察。尽管积极监控观察能避免PTMC的过度治疗,使得大部分低危PTMC患者受益,但其纳入标准严格,需排除PTMC高危病理学亚型和颈部淋巴结转移,而无论术前细针抽吸活组织检查(fine-needle aspiration biopsy,FNAB)还是超声扫查均不能有效地排查高危细胞病理学亚型和隐匿性颈部淋巴结转移,致使部分不宜采用积极监控观察的患者病情延误,不得不行抢救性手术,而因结节进展引起的组织粘连和转移使得手术风险和治疗难度增加[10]。因此积极监控观察较适用于全身情况较差,不能耐受手术,结节直径<5 mm且经全面评估后属低危癌的老年患者,对于年龄<40岁的年轻患者,疾病进展风险更高,如需行积极监控观察,可同时进行促甲状腺激素(thyroidstimulating hormone,TSH)抑制治疗,而在积极监控观察中,若结节直径增长超过3 mm,出现颈部淋巴结转移,或患者改变监控观察策略,要求手术时,应结束积极监控观察,转为外科手术治疗[11]。
1.3 术后颈部转移淋巴结的治疗
甲状腺乳头状癌为激素依赖性肿瘤,对于高危PTMC术后采用TSH抑制治疗和放射性核素治疗可有效地防止其术后复发[11],但有研究[12]表明,即使采用甲状腺全切术加淋巴结预防性清扫及放射性核素治疗,术后颈部淋巴结转移率仍高达16.5%。2015年版ATA指南指出,甲状腺癌术后颈部转移淋巴结首选手术治疗,但术后颈部瘢痕形成,组织粘连常使解剖结构分界不清,再次开放手术并发症风险和处理难度较大[13]。而术后转移淋巴结的清扫至关重要,目前用于开放手术的淋巴结定位方法较多,但导丝钩针定位法、γ探针探测法及亚甲蓝染料定位法等均存在各种不足,有研究[14]在超声引导下将纳米炭注入转移淋巴结,使再次手术时转移淋巴结能充分暴露,得以完全清扫,成功地引入超声介入技术指导再次手术清理操作。近几年超声不仅用于指导手术定位,而且较多用于术后转移淋巴结的介入治疗,成功灭活转移淋巴结,同时避免了再次手术带来的创伤和风险。
1.4 新兴的超声介入治疗
超声引导下介入治疗兼具微创及主动干预的特点,即超声引导穿刺消融针经皮进入并损毁目标病灶,达到治疗目的。超声介入技术多用于甲状腺良性结节的减容治疗,对于甲状腺良性结节及高功能腺瘤疗效确切,而近年来对PTMC及颈部转移淋巴结的超声介入治疗报道逐渐增多,目前运用到的介入治疗技术包括热消融、化学消融,放射性粒子植入。
2 超声引导下介入治疗技术
2.1 超声引导下热消融
射频消融(radiofrequency ablation,RFA)利用电极产生震荡电场产热,针尖温度达60℃以上,造成组织凝固性坏死,外周形成45~60℃的热疗区,可在杀灭原位及交界处肿瘤组织的同时尽量保存正常组织。
微波消融(microwave ablation,MWA)是通过交变电磁场引起极性分子碰撞运动产热,造成肿瘤坏死,因减少血管热沉效应而拥有比RFA更高的热效率,可减少并发症风险。激光消融(laser ablation)采用激光穿透组织产热,与RFA、MWA相比,温度更高,达300 ℃以上,可导致肿瘤组织快速灭活,同时伴随组织气化。激光消融针较为纤细,操作中更易避开血管及神经,消融范围较小,更适于治疗风险较大的微小病灶。
2.2 超声引导下化学消融技术
甲状腺化学消融以无水乙醇消融为主,最早用于小肝癌,后逐渐运用于肺、肾、甲状腺、淋巴结转移瘤等。在95%~99%纯度乙醇的渗透作用下,靶细胞脱水、蛋白质变性,发生凝固性坏死。乙醇在结节内的弥散程度决定疗效好坏,一般在实性结节中弥散不均匀,多用于囊性成分为主结节的治疗。
2.3 超声引导下放射性碘粒子植入技术
甲状腺的放射性粒子治疗主要是在计算机体层成像(computed tomography,CT)引导下进行,但对于直径<1 cm的淋巴结,CT显示不清[15]。毗邻气管、食管等重要脏器结构部位的淋巴结,CT不能实时引导,植入风险较高,因而超声引导成为浅表淋巴结粒子植入的新选择,原理是在超声引导下将131I或125I植入瘤体内,通过微小放射源发出持续的低剂量γ射线和X射线,破坏肿瘤细胞DNA分子结构,同时电离水分子,造成肿瘤细胞水肿、变性至坏死。因剂量较低,可在杀伤肿瘤组织同时,较少损伤正常组织。
3 超声介入治疗PTMC的进展
3.1 热消融治疗初诊PTMC
目前的指南[4,11,16-18]均不推荐使用热消融治疗初诊PTMC,仅部分指南推荐对于部分不宜二次手术的复发病灶及转移淋巴结可行热消融治疗。其主要原因:① 热消融为局部治疗手段,不符合甲状腺癌最小切除单位为一侧叶的原则,术后易复发;② 超声对颈部淋巴结的识别仍然存在不足,即使低危PTMC仍存在中央区淋巴结隐匿性转移风险,而热消融无法预防性清扫淋巴结;③ 消融术后复发灶行二次手术难度较大,消融组织变性坏死,与周边颈部肌肉及组织粘连严重,只能参考局部晚期甲状腺癌的手术原则进行处理[19];④ 有针道转移的相关报道[20],因甲状腺体积较小且腺毗邻众多重要组织器官,在退针时可能因安全距离不足导致针道消融不完全,从而增加了种植转移的风险。但已有的指南均对不能耐受手术及不愿接受手术的初诊患者PTMC热消融治疗持观察态度。近几年,国内外多个医疗机构开展了针对PTMC的热消融治疗(表1),3种热消融技术均有涉及,以RFA、MWA为主,激光消融较少,研究报道主要来源于中国。总结这些研究可见:① 大部分经热消融治疗的PTMC病灶体积被有效控制,部分病灶完全消除;② 相关并发症发生率较低,主要为术后暂时声音嘶哑和轻微疼痛,均于术后几分钟至数月内缓解,无永久性喉返神经损伤、气管食管颈动脉损伤等严重并发症,患者术后甲状腺、甲状腺旁腺功能正常;③ 大部分研究随访期较长,最长平均随访期达到72个月,随访期内病灶复发及转移率低,均无远处转移报道。除1例发现对侧腺体转移行甲状腺双侧叶全切术外,其余均采用二次热消融治疗,经随访转移病灶均完全消除;④ MWA并发症发生率对比其他消融方式更高,主要为暂时性声音嘶哑,这可能与MWA针较粗、消融半径更广、更易造成腺体内喉返神经热损伤有关;⑤ 回顾性研究较多,前瞻性研究较少,缺乏多中心研究以及随机对照试验比较不同消融方式及热消融与外科手术之间的差异;⑥ 欧美开展相关研究较少,仅意大利一家机构开展临床试验,结果显示,结节体积缩减率及并发症发生率与中国、韩国两国研究结果差距较大,除了此研究患者数较少、开展较晚等因素,人种差异亦可能带来影响,因此热消融是否有益于治疗其他人种PTMC尚需更多验证。

表1 2019—2021年不同国家及机构热消融治疗PTMC结果
目前未见对比热消融和积极监控观察PTMC的研究报道,热消融是否有益于控制低危组PTMC进展不得而知。而总结热消融和外科手术的对比研究(表2)可见:① 在手术时间、术中出血量、住院天数、总花费、并发症发生率方面热消融治疗明显低于外科手术,且所有的热消融治疗均未产生永久性损伤,而部分研究外科手术造成部分患者永久性喉返神经损伤和甲状腺功能减退;② 术后复发率未作为重点进行对比,仅少数研究长期随访复发转移情况,而是否能降低复发率才是评价一个治疗手段疗效最重要的指标;③ 研究总量较少,暂无随机对照试验研究比较两者差异。
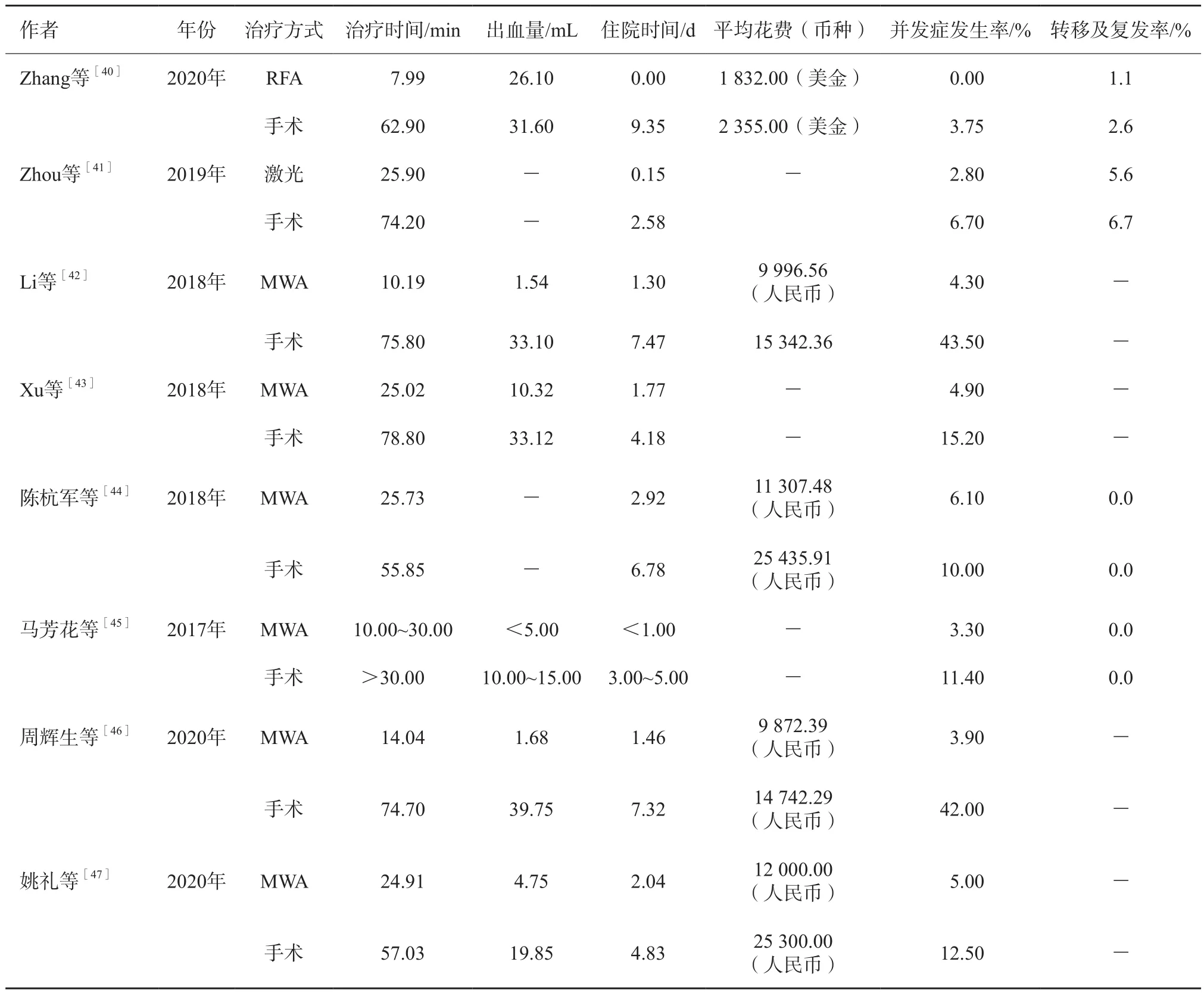
表2 热消融同外科手术治疗PTMC的对比研究结果
3.2 其他超声介入手段治疗初诊PTMC
化学消融目前主要用于甲状腺囊性结节的治疗,周超等[21]对92例完全囊性或囊性成分大于50%的结节行无水乙醇消融,术后12个月结节体积缩小率达(93.83±6.48)%。乙醇在治疗PTMC原位病灶方面的研究甚少,且均为热消融技术不成熟时的姑息疗法,疗效较差,复发率及并发症发生率较高。因此指南[19]明确反对使用化学消融治疗初诊PTMC,目前运用到初诊PTMC治疗的超声介入技术仅为热消融。
4 超声介入治疗术后颈部转移性淋巴结
4.1 放射性碘离子和化学消融治疗
目前超声介入治疗颈部转移淋巴结的主要指征:① 术前行穿刺证实转移且病情不适合再次进行外科手术或患者拒绝再次进行外科手术;② 转移淋巴结≤3个;③ 不存在长径>2 mm的粗大钙化。ATA指南[4]指出,对于PTMC术后颈部转移淋巴结,可进行碘离子放射治疗,作为传统的术后治疗手段,131I治疗甲状腺癌转移性淋巴结取得了良好的临床效果,但仍有2%~5%的病灶在传统131I治疗和TSH抑制治疗下难以取得较好疗效[48],赵玮等[49]采用超声引导下125I粒子植入治疗甲状腺癌术后转移淋巴结,分别于术后1、3、6、12个月观测患者甲状腺球蛋白(thyroglobulin,TG)水平、淋巴结体积及内部血流变化,结果显示TG水平在治疗后12个月中位水平由25.14μ g/L降至0.45 μ g/L,低于完全缓解期TG<1 μ g/L的标准,淋巴结血流等级明显降低,而淋巴结体积未见明显缩小。
有研究[50]对甲状腺术后淋巴结转移灶采用无水乙醇治疗,淋巴结最大径及TG水平均明显减低。但并非所有乙醇消融治疗均能减小转移淋巴结最大径,Kim等[51]对46个病灶进行治疗,随访显示仅24个病灶体积缩小,病理解剖表明,尽管消融后体积未明显缩减,但乙醇破坏了淋巴结内的转移性PTC细胞,仍有助于控制甲状腺癌进展。综上,尽管超声引导的放射性碘离子治疗以及化学消融治疗后淋巴结体积缩减率较低,但仍能有效地抑制术后颈部转移淋巴结侵袭进展,是一种安全、有效的姑息性治疗方式。
4.2 热消融治疗
热消融治疗颈部转移淋巴结以Ⅲ、Ⅳ、Ⅵ区淋巴结为主[2,52-53],能在短时间内(平均10~15 s)有效地损毁单个转移淋巴结,具备较高的淋巴结体积缩减率,有助于控制淋巴结复发,同时并发症发生率相较二次手术更低。在靠近颈总动脉行颈部Ⅱ、Ⅲ、Ⅳ区转移淋巴结热消融时,应当注意辨别并保护迷走神经,有研究[2]在对3例转移淋巴结治疗时,因淋巴结与迷走神经分界不清,未能避开迷走神经,引发迷走神经反射,致使患者心率血压降低,此时应立即终止消融,待患者心率血压恢复正常,可通过缩短单次消融时间及增加消融次数来彻底消融淋巴结。
5 总结及展望
超声为甲状腺疾病的首选检查,同样超声引导下的介入治疗也是甲状腺介入治疗的主要手段。依靠超声的实时、动态监控,操作者能在颈部精密、复杂的解剖环境中制造隔离带,并按照设计的方案布针,加之超声造影对于消融范围的精密把控,使得超声介入在控制并发症和结节清除率方面表现优异。并且近几年开展的初诊PTMC及颈部转移淋巴结的超声介入治疗研究因纳入指征更严格、操作流程更规范、随访时间更长取得了更可信的疗效,得到了更为广泛的认可[54-55]。人们对于部分甲状腺恶性肿瘤超声介入治疗的认知也经历了一个从不认可、从视为姑息疗法至逐渐成为一线疗法的过程。从有限的对比研究中可以看出,对于初诊PTMC的治疗,超声介入和外科手术均有较低的复发概率,而超声介入治疗复发转移淋巴结的研究中,绝大部分为外科术后复发患者,可见初诊PTMC的治疗并不是“一刀切”或“一消了之”,而是一个多学科协作的长期治疗过程。PTMC的生物学特性还未完全阐明,因此以肿瘤复发来否定超声介入治疗显然不可取。同时超声介入是一项有门槛的技术,要达到理想治疗效果,操作者必须有优秀的超声操作技巧,较好的介入穿刺基础,以及处理不同程度并发症的临床能力,因而对于甲状腺恶性肿瘤的介入治疗,应在具备良好超声介入资质的科室进行,以避免滥用。值得一提的是,热消融免疫效应以及热增敏技术的研究已在肝癌等实质性脏器肿瘤中开展,是否适用于甲状腺恶性肿瘤的热消融有待进一步探索。
