美国白蛾丝素蛋白基因的鉴定、时空表达及取食不同寄主植物后的表达响应
2022-01-05赵旭东韩芷琪耿薏舒胡天义李文萱郝德君
赵旭东,韩芷琪,耿薏舒,胡天义,李文萱,郝德君*
(1. 南京林业大学南方现代林业协同创新中心,南京 210037;2. 南京林业大学林学院,南京 210037)
大多数鳞翅目幼虫依靠唇腺分泌纤维蛋白(统称为丝),用于躲避天敌、抵御外界不良环境以及营造化蛹场所(Robert, 2002; Chinnaswamyetal., 2012)。丝素作为丝的主要成分,约占75%~80%,是由丝素重链(Fibroin Heavy Chain, fib-H链)、丝素轻链(Fibroin Light Chain, fib-L链)和P25三种蛋白组成(Rouhovaetal., 2021)。丝素重链与丝素轻链通过二硫键形成H-L复合体,fib-H和fib-L之间的二硫键位点被鉴定为fib-H的羧基末端的第20位残基(Cys-20)以及 fib-L羟基末端第172位残基(Cys-172),这类H-L复合体对于丝蛋白在细胞内运输及有效分泌必不可少(Tanakaetal., 1999a)。同时,P25蛋白通过非共价键疏水作用与H-L复合体结合,以维系丝素蛋白分子复合体的三维构造(Yonemuraetal., 2009; Matthewetal., 2011)。已有研究表明,家蚕Bombyxmori一个基本的丝素单位由6个fib-H、6个 fib-L和1个P25分子组装成(Takeietal., 1987; Songetal., 2002; Matthewetal., 2011; Tsubotaetal., 2016)。但并非所有鳞翅目幼虫丝素蛋白均由这三种蛋白构成,如天蚕AntheraeayamamaiGuerin-Meneville、柞蚕Antheraeapernyi等大蚕蛾科柞蚕属昆虫的丝纤维则缺少fib-L和P25组分,是由丝素重链二聚体组成(Hwangetal., 2001; Tanaka and Mizuno, 2001; Naoyukietal., 2009);毛翅目幼虫的丝纤维主要由fib-H和fib-L构成,缺少P25(Yonemuraetal., 2006)。
不同的鳞翅目幼虫由于其生物学习性的差异,幼虫吐丝发挥不同的作用,同时伴随丝素蛋白基因特异的表达模式。家蚕Bmfib-H、Bmfib-L和BmP25的表达量均随着幼虫的生长发育而呈现上升趋势,老熟幼虫时表达量达到峰值(赵晓明, 2017)。同样地,在米蛾Corcyracephalonica中,随着幼虫龄期的增加,丝腺组织分泌丝的能力逐渐增强,Ccfib-H、Ccfib-L和CcP25的表达量也随之升高,在末龄幼虫时达到峰值,在预蛹阶段又显著下降(Chaitanya and Dutta-Gupta, 2010; Chaitanyaetal., 2013)。稻纵卷叶螟Cnaphalocrocismedinalis通过用丝包裹稻叶形成网幕,幼虫在网幕中取食水稻上表皮和叶片组织,其丝素蛋白的表达量也与产生网幕的时期呈现正相关(Suetal., 2016)。
美国白蛾HyphantriacuneaDrury是国际性检疫害虫,具有适应性强,繁殖量大,寄主种类多,传播途径广,危害严重等特点(杨忠岐等, 2007),自1979年在辽宁省丹东市首次发现以来,目前已经扩散至13个省(区、市)608个县级行政区(国家林业和草原局2021年第7号公告)。对森林、园林、果树业造成巨大的经济损失,对国土生态安全构成严重威胁(Tangetal., 2021; 卢修亮等, 2021)。研究发现,美国白蛾幼虫具有吐丝结网的习性,一旦卵孵化后即可分泌丝蛋白形成丝状网幕,1~4龄幼虫在网幕内取食寄主植物(Wuetal., 2019; 王光宇等, 2020),网幕也为其提供适宜的生长温度以及躲避天敌的攻击(Rehnberg, 2002)。关于美国白蛾丝素蛋白的表达特性研究还未见报道。本研究通过克隆三条美国白蛾丝素蛋白,利用荧光定量PCR技术探究丝素蛋白基因在美国白蛾不同发育阶段和不同组织的表达特性,以期明确丝素蛋白表达特性与幼虫产丝时期的关系。同时,分别选择美洲黑杨Populusdeltoides、日本晚樱Cerasusserrulatavar.lannesiana、山樱花Cerasusserrulata、喜树CamptothecaAcuminata和落羽杉Taxodiumdistichum等5种植物,研究美国白蛾取食不同寄主植物后丝素蛋白基因的表达特性,为解析网幕介导的美国白蛾对不同寄主的适应性和扩散机制奠定基础,也为未来防治美国白蛾提供潜在的基因靶标。
1 材料与方法
1.1 供试虫源
美国白蛾2龄幼虫于2020年5月采自江苏省淮安市淮安区杨树上(33.52°N,119.16°E)。将幼虫带回室内参照曹利军等(2014)方法进行人工饲养,人工气候培养箱温度设置为26℃±1℃,相对湿度65%±5%,光周期16 L ∶8 D。待成虫羽化后,提供新鲜的杨树叶片供其产卵。取室内繁殖的第2代幼虫用于试验。
1.2 美国白蛾幼虫总RNA的分离与cDNA模板的合成
取10头生长发育一致的美国白蛾3龄幼虫用液氮速冻后置于研钵中,研磨成粉末状,再用提取试剂盒(上海生工技术公司)提取总RNA。利用紫外分光光度计及1%琼脂糖凝胶电泳检测RNA浓度及质量,选择电泳图谱良好且OD260/OD280值在1.8~2.0之间的mRNA样品合成cDNA模板。cDNA模板用HiScript II Q Select RT SuperMix(南京诺唯赞生物技术公司)两步法合成,第一步:4× gDNA Wider Mix 4 μL,Oligo (dT) 1 μL,RNA 1 μL,ddH2O 10 μL,42℃ 2 min;第二步:将4 μL 5× HiScript II Select qRT SuperMix II加入混合液,85℃ 5 s,50℃ 15 min,-20℃保存或直接用于PCR反应。
1.3 美国白蛾丝素蛋白基因的克隆
美国白蛾3条丝素蛋白基因HcP25、HcFib-H、HcFib-L的cDNA序列由美国白蛾幼虫转录组(由本实验室构建,未发表数据)筛选获得,利用Prime Premier 5.0软件设计引物(表1),送至上海生工生物公司合成。以美国白蛾3龄幼虫RNA合成的cDNA为模板,利用ApexHF FS PCR Master Mix(艾科瑞生物,中国)聚合酶进行PCR扩增,扩增体系为:ApexHF FS PCR Master Mix 25 μL、上下游引物各1 μL、cDNA模板2 μL,ddH2O 21 μL;扩增条件为:98℃ 10 s、50℃ 15 s、72℃ 30 s,循环30次;72℃ 5 min延伸,扩增后用1.5%琼脂糖凝胶电泳检测。将PCR产物经琼脂糖凝胶电泳后切胶纯化,克隆于pCE2载体(南京诺唯赞生物技术公司),导入大肠杆菌EscherichiacoliTrans1-T1(南京诺唯赞生物技术公司)之后在含有氨苄抗性的LB琼脂板上37℃过夜培养,挑取阳性克隆于LB液体培养基中37℃ 200 r/min孵育2 h,再进行菌液PCR鉴定。将验证正确的重组质粒送至上海生工生物有限公司进行测序。利用分子生物学软件DNAMAN 8.0比对测序序列与美国白蛾cDNA文库中的丝素蛋白序列相似性。

表1 本实验所用引物
1.4 美国白蛾不同发育阶段和不同组织RNA的提取以及cDNA模板合成
美国白蛾不同虫龄幼虫和蛹的cDNA模板的合成:选取200~300粒卵、20~30头1龄、2龄幼虫;5~10头3龄、4龄幼虫;3~5头5龄、6龄幼虫、蛹各3~10头为一个生物学处理,3次重复。RNA提取及cDNA合成方式参考1.2。
美国白蛾不同组织cDNA模板的合成:选取2日龄3龄幼虫10~15头,在生理盐水中解剖,获得头、中肠、血淋巴、马氏管、脂肪体、表皮、丝腺、足等组织,置于RNA later中短时保存,通过离心法将RNA later去除。RNA提取及cDNA合成方式参考1.2。
1.5 不同寄主植物处理
将初羽化的雌雄成虫置于10 cm×10 cm×10 cm的饲养盒中,提供30%蜂蜜水补充营养,让其自由交配,第2天收集卵块。将收集的卵卡分别放入盛有5种新鲜寄主的的饲养盒(13.5 cm×8.0 cm×0.5 cm)中,待幼虫孵化,每隔1 d清理1次虫粪便并更换食料。由于美国白蛾幼虫在1~4龄时形成网幕,因此选择取食5种寄主植物的3龄幼虫为供试昆虫进行丝素蛋白的表达特性分析。取10~15头蜕皮后1 d的3龄幼虫为一个处理,5次重复。RNA提取及cDNA合成方式参考1.2。
1.6 荧光定量PCR引物的合成与扩增效率的检测
依据cDNA文库所得到的基因序列设计引物(退火温度均在50℃~60℃之间),以美国白蛾核糖体基因Ribosomal Protein S26 (RPS26)为内参基因(实验室前期筛选,数据未发表),引物设计运用Primer 5.0软件,由上海生工生物公司合成,引物序列见表1。取美国白蛾3龄幼虫的cDNA模板,稀释浓度为500、50、5、0.5和0.05 ng/μL。分别利用上述引物进行扩增,每个浓度重复5次。利用公式E = 10-1/Slope (E为扩增效率,Slope为5个浓度平均Ct值所构成直线的斜率值)计算引物的扩增效率,比较待测丝素蛋白基因与内参基因RPS26扩增效率的数值,确定本研究所用的荧光定量PCR引物是否达到要求。
1.7 实时荧光定量PCR
依据克隆获得的丝素蛋白基因序列设计实时荧光定量PCR引物。引物设计采用Primer 5.0软件由上海生工生物公司合成,引物序列见表1。实时荧光定量PCR在Applied Biosystem 7500 System(美国)上进行。反应体系:UltraSYBR mix (with R) 12.5 μL,上下游引物各0.5 μL,cDNA模板2 μL,ddH2O 9.5 μL。扩增条件:95℃预变性30 s;95℃ 5 s,60℃ 34 s,40个循环;每个样品设置3个生物学重复,每个生物学重复设置3个技术重复,采用2-ΔΔCt法计算丝素蛋白基因的相对表达量(Livaketal., 2001)。
1.8 美国白蛾丝素蛋白基因序列分析以及进化树分析
通过在线软件(http://web.expasy.org/compute_pi/)分析美国白蛾丝素蛋白核苷酸序列的物理性状。已知鳞翅目昆虫的丝素蛋白基因氨基酸序列相似性搜索使用BLAST (http://www.ncbi.nlm.nih.gov/BLAST/)工具利用NCBI的CD search (www. ncbi. nlm. nih. gov/structure/ cdd/cdd.shtml)预测蛋白的保守功能域;ClustalX软件进行氨基酸多重序列完全比对;利用MEGA 9.0软件包中的邻位相连法(Neighbor-Joining)构建进化树并经1 000次Bootstrap自举重复检验。
1.9 数据处理与分析
美国白蛾不同发育阶段、不同组织以及取食不同寄主的丝素蛋白相对表达量变化采用2-ΔΔCt法计算。利用IBM SPSS Statistics 20软件进行数据处理,Origin 2018绘制图表。采用单因素分析法中的Duncan氏多重检验法对美国白蛾丝素蛋白基因相对表达量进行差异显著性分析,差异显著水平为P<0.05。
2 结果与分析
2.1 美国白蛾丝素蛋白基因的鉴定
基于美国白蛾幼虫的转录组数据,通过基因克隆鉴定了3条美国白蛾丝素蛋白基因。其中HcP25具有完整的ORF,编码221个氨基酸,HcFib-L、HcFib-H为部分片段。HcP25预测分子量为25.6 kDa,理论等电点预测为7.45。信号肽预测结果表明,HcP25N端均具有17个氨基酸组成的信号肽序列(图1),且有典型的丝素蛋白P25蛋白保守结构域。
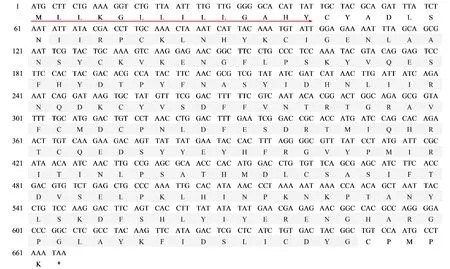
图1 美国白蛾丝素蛋白HcP25基因核苷酸序列以及其推导出来的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of HcP25 from Hyphantria cunea注:红色下划线为推导的信号肽区域,灰色阴影部分为P25蛋白超家族结构域。Note: The predicted signal peptide sequence was underlined. The gray shaded part was the fibroin P25 super family domain.

表2 3条丝素蛋白的BLASTX最佳匹配
2.2 美国白蛾与其他昆虫丝素蛋白基因氨基酸序列的进化树分析
NCBI BLAST比对结果显示,丝素蛋白主要在鳞翅目昆虫中特异性表达。MEGA 9.0邻接法(Neighbor Joining methods)对包括美国白蛾HcP25、HcFib-H、HcFib-L在内的不同科鳞翅目昆虫的丝素蛋白基因核苷酸序列分别进行系统发育进化树的构建。结果显示(图2):美国白蛾HcP25、HcFib-H、HcFib-L均与车前灯蛾同源性最高,同属于一个分支。P25、Fib-H、Fib-L在鳞翅目不同科之间在出现较大的分化;分化的原因可能是由于取食习性以及生物学习性的差异导致。P25以及Fib-L在美国白蛾所属的灯蛾科中与夜蛾科的进化关系较为接近,而在丝素蛋白Fib-H中灯蛾科与凤蝶科进化关系更为接近。
2.2 美国白蛾丝素蛋白基因在幼虫不同发育阶段的表达
引物合成后,RT-qPCR检测结果显示无引物二聚体,亦无非特异性扩增。丝素蛋白基因HcP25、HcFib-H、HcFib-L引物扩增效率分别为106.03%、94.90%、108.14%;内参基因RPS26的引物扩增效率为104.15(表3)。确定本研究所用的荧光定量PCR引物均达到实验要求。
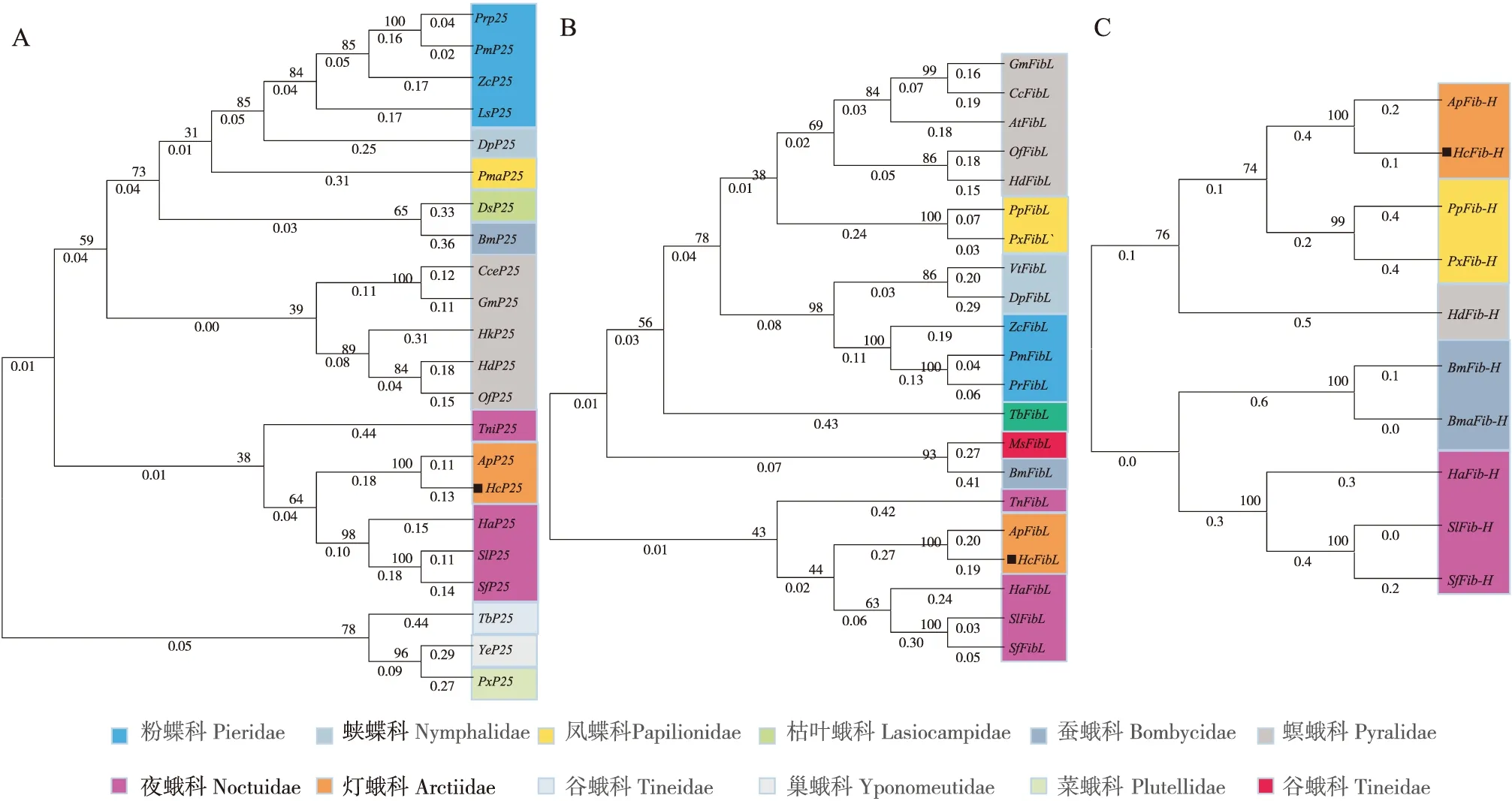
图2 鳞翅目昆虫丝素蛋白进化树Fig.2 Phylogenetic tree of lepidopteran Fibroins注: A表示鳞翅目昆虫P25基因进化树; B表示鳞翅目昆虫Fib-L进化树;图C表示鳞翅目昆虫Fib-H进化树。不同颜色区域代表鳞翅目不同科;Note: A represents phylogenetic tree of lepidopteran P25s; B represents phylogenetic tree of lepidopteran Fib-Ls; C represents phylogenetic tree of lepidopteran Fib-Hs. Different color regions represent different families of Lepidoptera. 物种名以及P25s登录号:菜粉蝶 Pieris rapae;Prp25(XP 022115373.1);白粉蝶Pieris macdunnoughi;PmP25(CAF4741365.);菊黄花粉蝶Zerene cesonia;ZcP25(XP 038217613.1);条纹小粉蝶 Leptidea sinapis;LsP25(VVD01372.1);黑脉金斑蝶 Danaus plexippus plexippus;DpP25(XP 032525475.1); 金凤蝶 Papilio machaon;PmaP25(XP 014362623.1);赤松毛虫 Dendrolimus spectabilis;DsP25(BAB39502.1);桑野蚕 Bombyx mandarina; BmP25(BAB39500.1);米蛾 Corcyra cephalonica;CceP25(ACX50393.1);蜡螟 Galleria mellonella; GmP25(XP 026750282.1);海波斯莫科马属尖蛾 Hyposmocoma kahamanoa;HkP25(XP 026325402.1);棉褐环野螟 Haritalodes derogata;HdP25(ARE31005.1);亚洲玉米螟 Ostrinia furnacalis;OfP25(XP 028174026.1);粉纹夜蛾 Trichoplusia ni;TniP25(XP 026736911.1);车前灯蛾Arctia plantaginis;ApP25(CAB3237372.1) ;美国白蛾 Hyphantria cunea;HcP25;棉铃虫 Helicoverpa armigera;HaP25(XP 021180832.1);斜纹夜蛾 Spodoptera litura; SlP25(XP 022817133.1);草地贪夜蛾 Spodoptera frugiperda;SfP25(XP 035455615.1);幕衣蛾 Tineola bisselliella;TbP25(QRN45216.1);稠李巢蛾 Yponomeuta evonymella; YeP25(BAE97692.1);小菜蛾 Plutella xylostella; PxP25(QQP17683.1)。物种名以及Fib-Ls登录号:蜡螟 Galleria mellonella;GmFibL(XP 026751556.1);米蛾 Corcyra cephalonica;CcFibL(ACX50392.1);脐橙螟蛾 Amyelois transitella;AtFibL(XP 013191394.1);亚洲玉米螟 Ostrinia furnacalis;OfFibL(XP 028170825.1);棉褐环野螟 Haritalodes derogata;HdFibL(AFS32690.1);玉带凤蝶 Papilio polytes;PpFibL(XP 013148799.1);柑橘凤蝶 Papilio xuthus;PxFibL(NP 001299492.1);特美红蛱蝶 Vanessa tameamea;VtFibL(XP 026488043.1);黑脉金斑蝶 Danaus plexippus plexippus;DpFibL(OWR43595.1);菊黄花粉蝶 Zerene cesonia;ZcFibL(XP 038218698.1);白粉蝶 Pieris macdunnoughi;PmFibL(CAF4952403.1);菜粉蝶 Pieris rapae;PrFibL (XP 022120941.1);袋衣蛾 Tineola bisselliella;TbFibL(QRN45215.1);烟草天蛾 Manduca sexta;MsFibL(XP 037303618.1);家蚕 Bombyx mori;BmFibL (AAL83649.1);粉纹夜蛾 Trichoplusia ni;TnFibL(XP 026736676.1);车前灯蛾Arctia plantaginis;ApFibL (CAB3225488.1);美国白蛾 Hyphantria cunea;HcFibL;棉铃虫 Helicoverpa armigera;HaFibL (XP 021187436.1);斜纹夜蛾 Spodoptera litura;SlFibL (XP 022823583.1);草地贪夜蛾 Spodoptera frugiperda;SfFibL (XP 035443377.1);物种名以及Fib-H登录号:车前灯蛾Arctia plantaginis;ApFib-H (CAB3248753.1);美国白蛾Hyphantria cunea;HcFib-H;玉带凤蝶 Papilio polytes;PpFib-H(XP 013147704.1);柑橘凤蝶 Papilio xuthus;PxFib-H (KPJ01470.1);棉褐环野螟 Haritalodes derogata;HdFib-H(ANA52002.1);桑野蚕 Bombyx mandarina; BmFib-H (CAA27612.1);家蚕 Bombyx mori;BmFib-H (NP 001106733.1);棉铃虫 Helicoverpa armigera;HaFib-H (PZC72456.1);斜纹夜蛾 Spodoptera litura;SlFib-H (XP 022817907.1);草地贪夜蛾 Spodoptera frugiperda;SfFib-H (XP 035449581.1)
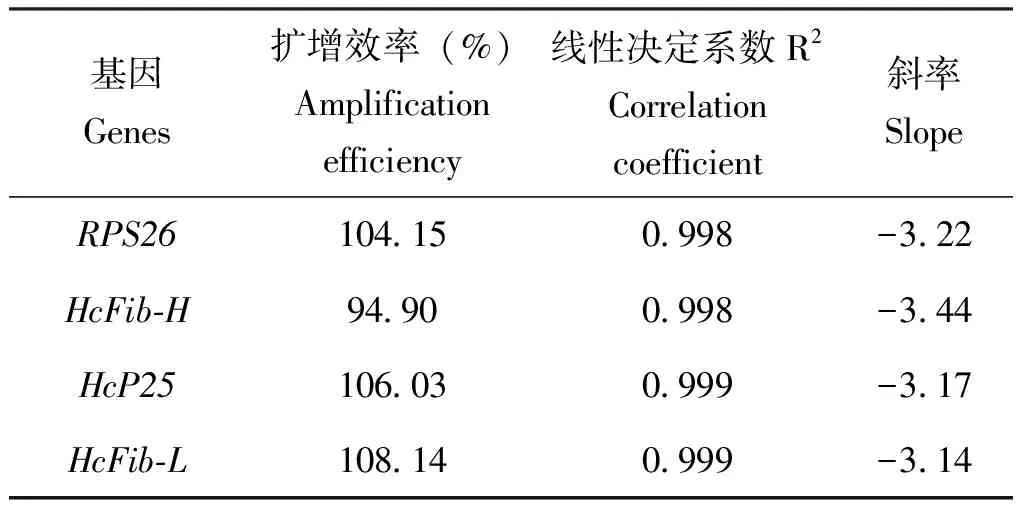
表3 候选基因qRT-PCR引物的扩增效率及线性相关系数Table 3 Amplification efficiency and R2 of qRT-PCR primers for candidate genes
RT-qPCR结果显示美国白蛾丝素蛋白HcP25、HcFib-H、HcFib-L相对表达量在美国白蛾幼虫不同发育阶段存在明显差异。HcP25与HcFib-H具有相似的表达特点,HcP25与HcFib-H在初孵幼虫以及2龄时相对表达量显著高于其它龄期(P<0.05);在2龄后随着龄期增长呈下降趋势,4龄之后HcP25与HcFib-H表达量显著下降,在蛹期时相对表达量最低(图3-A,C)。HcFib-L在2龄幼虫体内表达量达到峰值,显著高于其它龄期(P<0.001),之后同样随着龄期增长显著下降,且在蛹期时相对表达量最低,显著低于卵期与幼虫期(P<0.05,图3-B)。
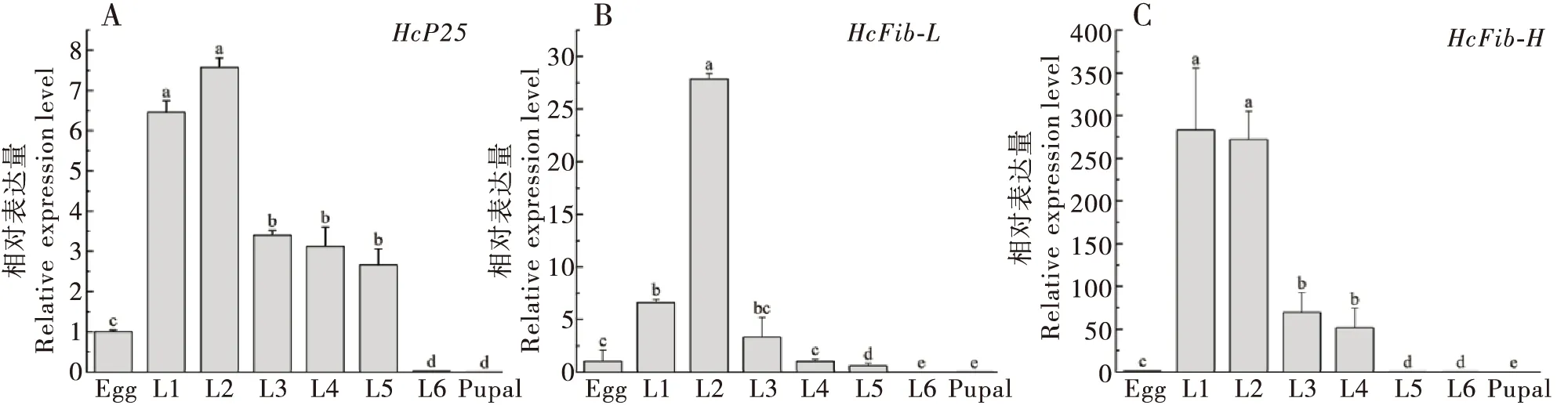
图3 美国白蛾丝素蛋白基因 HcP25 (A)、HcFib-L (B)、HcFib-H (C)在不同发育阶段的表达特性Fig.3 Expression profiles of HcP25 (A), HcFib-L (B), HcFib-H (C) in different developmental stages of Hyphantria cunea注:L1~L6:分别表示1龄至6龄美国白蛾幼虫。数据为平均数±标准误,柱上不同小写字母表示差异显著P<0.05,Duncan氏多重比较。下图同。Note: L1~L6 1st~6th instar larva, respectively. Data in the figure were mean±SE, and different small letters above bars indicated significant difference (P<0.05, Duncan’s multiple comparison).The same below.
2.3 美国白蛾丝素蛋白基因在幼虫不同组织的表达分析
美国白蛾HcP25、HcFib-H和HcFib-L基因在3龄幼虫的不同组织中具有不同的表达模式。RT-qPCR结果表明3条丝素蛋白基因均在丝腺组织中表达量最高,且极显著高于其它组织(P<0.001);其中HcFib-H在脂肪体、头中特异性地高表达,且在脂肪体中相对表达量高于头部(P<0.05),显著高于其他组织(P<0.05)。HcP25、HcFib-L除了在丝腺组织中特异性表达之外,在表皮、脂肪体、头中也有表达,且在这3个组织之间差异不显著(P>0.05)(见图4)。

图4 美国白蛾丝素蛋白基因HcP25 (A)、HcFib-L (B)、HcFib-H (C)在幼虫不同组织的表达特性Fig.4 Expression profiles of HcP25 (A), HcFib-L (B), HcFib-H (C) in different tissues of the 3th instar larvae of Hyphantria cunea
2.4 美国白蛾丝素蛋白基因在取食不同寄主植物后的表达谱分析
取食不同寄主植物后美国白蛾3龄幼虫丝素蛋白基因的转录水平存在显著差异。取食杨树的美国白蛾幼虫的HcP25和HcFib-H基因相对表达量种群极显著高于其它寄主的种群(P<0.001,图5-A,B),取食喜树的美国白蛾也相对较高。HcP25和HcFib-H基因表达量高低依次为杨树种群>喜树种群>山樱花种群>日本晚樱种群、落羽杉种群。HcFib-L表达特性与HcP25和HcFib-H不同,取食山樱花与日本晚樱幼虫的HcFib-L相对表达量显著高于其它种群(P<0.05),取食杨树幼虫的HcFib-L表达相对较低且与取食落羽杉、喜树的无显著性差异(P>0.05);取食落羽杉幼虫的HcP25、HcFib-H和HcFib-L表达量均低于取食其它寄主植物(图5-C)。
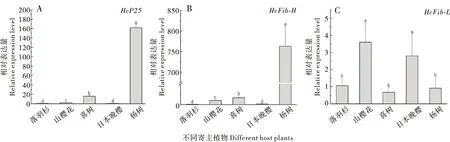
图5 美国白蛾幼虫取食不同寄主植物后丝素蛋白基因HcP25 (A)、HcFib-L (B)、HcFib-H (C)的表达特性Fig.5 Relative expression levels of HcP25 (A),HcFib-L (B),HcFib-H (C) in the 3th instar larvae of Hyphantria cunea after feeding on different host plants
3 结论与讨论
丝是一种从螨类、蜘蛛等节肢动物外胚层腺体中分泌形成的聚合纤维,而节肢动物产丝能力是由多个昆虫谱系中进化而来的(Gatesyetal., 2001; 王孟卿和彩万志, 2004; Addisetal., 2014)。吐丝现象在膜翅目、长翅目、管蚤目、双翅目、毛翅目和鳞翅目等昆虫的幼虫中均有发生(Matthewetal., 2012; Yanetal., 2021)。丝的主要作用吐丝结成网幕保护幼虫躲避天敌或者是化蛹时制作茧室以及一些肉食性昆虫利用丝收集食物或用作捕获猎物的“陷阱”(Johnetal., 2001)。产丝能力、丝的功能以及性能在不同的昆虫种类中有很大的不同。美国白蛾幼虫聚集在寄主植物叶片以及树枝上通过分泌丝纤维形成网幕,幼虫通常白天群聚在网幕中,夜晚扩张网幕并将植物叶片包裹起来供其取食(Rehnberg, 2002; Chenetal., 2020)。网幕为美国白蛾幼虫提供适宜的生长温度以及躲避天敌的攻击。此外,网幕还可以调节热量,减缓网内的空气流动,从而促进幼虫的发育(Rehnberg, 2002; Takuyaetal., 2016)。
丝素蛋白是研究节肢动物适应性进化的理想材料,因为它们独立地出现在许多节肢动物的谱系中。通常情况下,丝主要由甘氨酸、丙氨酸和丝氨酸等非必需氨基酸组成。拥有特殊功能的丝蛋白往往具有特定的属性,这些属性在很长一段时间的进化过程中一直保持不变(Goslineetal., 1999)。这些保守的蛋白质特征可以从单一半胱氨酸残基的均匀定位,到更复杂的特征,如序列同源性高的长片段区域。对于蜘蛛丝来说,研究这些蛋白保守的特征有助于确定重要的丝蛋白序列元件和分子进化模式(Johnetal., 2001)。本研究中筛选出美国白蛾幼虫3条丝素蛋白基因即HcP25、HcFib-H、HcFib-L,核苷酸序列比对分析,发现3条丝素蛋白基因均与车前灯蛾同源性最高,可能是由于两种昆虫均隶属于灯蛾科,具有同源的系统进化关系。P25、Fib-H、Fib-L在鳞翅目不同科之间在出现较大的分化;P25以及Fib-L在美国白蛾所属的灯蛾科中与夜蛾科的进化关系较为接近,而在Fib-H中灯蛾科与凤蝶科进化关系更为接近。可能是由于不同科的鳞翅目幼虫的网幕行使不同的功能,以及生物学习性的差异导致丝素蛋白功能上的分化(Robert., 2002)。如在谷蛾总科和螟蛾总科中,幼虫通常藏匿于用丝构成的纺丝管中,在纺丝管中取食,还可以躲避天敌;而一些尺蛾科和夜蛾科的老熟幼虫吐丝帮助它们从树冠上下落到地面上化蛹(Frantisek and Michal, 2004; Tsubotaetal., 2020)。
同样,丝在在鳞翅目幼虫不同的发育时期行使不同的功能。如一些斑蛾科、卷叶蛾科以及毒蛾科昆虫的初孵幼虫利用丝线借助风的作用扩大分布范围,蚕蛾科昆虫在老熟幼虫化蛹时吐丝作茧以保护蛹(Inoueetal., 2000)。本研究中,美国白蛾丝素蛋白HcP25、HcFib-H、HcFib-L相对表达量在美国白蛾幼虫不同发育阶段处于动态的变化过程。HcP25与HcFib-L在初孵幼虫及2龄时相对表达量显著高于其它龄期,HcFib-L在2龄幼虫时表达量达到峰值,之后随着龄期增长呈现下降趋势,表明丝素蛋白的表达量与美国白蛾的产丝量密切相关。美国白蛾在其幼虫孵化后立即大量吐丝结网幕,而这一阶段HcP25、HcFib-H、HcFib-L相对表达量较高。美国白蛾幼虫4龄后开始分散取食,不群居结成网幕(Wuetal., 2019),因而HcP25、HcFib-H、HcFib-L相对表达量较低,而蛹期几乎不形成网幕,相对表达量最低。在对丝素蛋白在不同组织表达水平研究中,丝素蛋白基因HcP25、HcFib-L和HcFib-H均在丝腺组织中特异性表达,说明3条基因参与丝腺组织中丝纤维的合成。美国白蛾幼虫的丝腺是一对特异化程度非常高的器官,由下唇腺特化而成,主要功能是合成和分泌丝蛋白,而头部器官是幼虫分泌丝的主要场所(Wuetal., 2019; Chenetal., 2020),3条基因在美国白蛾头部均有分布和表达说明丝素蛋白在可能头部参与丝的分泌。
植物作为重要的生态因子和食物资源,直接影响昆虫的地理分布与扩散。美国白蛾为多食性食叶害虫,具有特定的食物结构和适应性。本研究中,取食不同寄主植物的美国白蛾3龄幼虫丝素蛋白呈现不同的表达水平。已有研究表明家蚕幼虫血淋巴中贮藏的蛋白积累是由寄主植物直接诱导的(Nagata and Kobayashi, 1990),丝素蛋白的表达水平因取食不同的桑叶品种而有所差异(Micheal and Subramanyam, 2014)。诱导丝素蛋白高表达的桑树品种的叶片含有较高的蛋白质和碳水化合物,直接有助于家蚕幼虫产生更多的丝素(Ruthetal., 2019)。在这些寄主富含较多的微量营养素、氨基酸和碳水化合物,以及促进丝腺生长成熟和血淋巴分泌的促生酶(Chinnaswamyetal., 2012; Ruthetal., 2020)。本研究发现取食杨树的美国白蛾幼虫HcP25与HcFib-H基因相对表达量种群极显著高于其它寄主种群,可能是由于杨树叶片中蛋白质、碳水化合物的丰度高于其它寄主,从而诱导HcP25与HcFib-H基因的高表达,继而使其在杨树上产生更多的网幕,造成危害。HcFib-L与HcP25、HcFib-H表达模式呈现不同的表达特性,取食山樱花和日本晚樱幼虫的HcFib-L表达量显著升高,可能是由于美国白蛾网幕形成过程中不同类型的丝素蛋白行使不同的功能。在家蚕的研究中,幼虫取食不同品种桑叶后,5龄家蚕幼虫的Fib-L与Fib-H同样呈现了不同的表达模式(Ruthetal., 2020)。在不同鳞翅目昆虫中Fib-H具有同源性,其氨基酸序列重复区具有多样性,同时氨基酸组成、基本序列重复单元的复杂性以及这些重复单元的排列决定了丝纤维的特性(Frantisek and Michal, 2004; Takuyaetal., 2020)。而Fib-L和P25主要是参与丝基本单元的构成以及Fib-H的分泌,与Fib-H在丝形成的过程中发挥不同的作用(Frantisek and Michal, 2004)。下一步将测定不同寄主的营养物质,以及美国白蛾在不同寄主植物上网幕发生量,明确寄主植物营养物质、美国白蛾在不同寄主上的发生量以及与形成网幕大小的关系。
美国白蛾是一种多食性的入侵害虫,以幼虫取食寄主植物叶片造成危害,其幼虫吐丝合成丝状物形成网幕对寄主植物造成危害。本研究在克隆出美国白蛾三条丝素蛋白的基础上,探究了其时空表达特性以及美国白蛾幼虫取食不同寄主植物后的表达谱,为进一步研究深网幕介导的美国白蛾对不同寄主的适应机制、寄主介导的扩散机制奠定基础。
