黄曲霉素产毒真菌多重聚合酶链式反应体系的建立*
2022-01-05叶壵敏张晓芹石森林
叶壵敏,林 娜,张晓芹△,石森林
(1.浙江中医药大学,浙江 杭州 310000;2.浙江中医药大学附属丽水市中医院,浙江 丽水 323000)
真菌毒素污染是影响食品安全的重要因素[1],其中黄曲霉、寄生曲霉等真菌所产生的黄曲霉素具有高致癌性、致病性,广泛存在于玉米、花生、木耳、大豆等食品中,是威胁人类健康的首要真菌毒素[2-4]。黄曲霉素产毒真菌的快速检测和防治是目前真菌毒素污染领域的研究热点。当前对黄曲霉素产毒真菌的检测主要依靠传统的形态学或免疫学方法。传统形态学方法主要基于菌株形态、生理特征等进行鉴别,耗时耗力,且需要的经验性较强;免疫学方法主要依靠黄曲霉素的抗性特点进行检测,检测样品需经纯化、孵育等多个环节,检测周期长、操作复杂[5-7]。分子生物学技术的发展为黄曲霉素产毒真菌的快速检测提供了新途径。孙长坡等[8]、MAHMOUD 等[9],AHMAD 等[10]等分别基于RFLP、SSR、功能基因等对不同真菌进行了鉴定。多重聚合酶链式反应(PCR)法是指在同一反应体系中加入多对引物,同时检测出2 种以上目的基因的方法,具有高效、快速、高通量等优势[11-14]。从黄曲霉素的生物合成途径分析,杂色曲霉B(VerB)、杂色曲霉1(Ver-1)是黄曲霉素产生的关键基因[15-19],对这2 个基因进行及时检测也是鉴定黄曲霉素产毒真菌的关键;ITS 基因是真菌通用基因,可通过该基因测序有效排除假阳性和假阴性。目前尚无针对以上3 种基因开展黄曲霉素产毒真菌的多重PCR 体系研究。DNA 质量是影响多重PCR 的主要因素,CTAB[20]、SDS[21]及相关改良方法是目前常用的总DNA 提取方法,不同研究对象常需采用相应提取方法方可获得高质量总DNA。为此,本研究中拟在考察了最佳DNA 提取方式的基础上,基于VerB,Ver-1,ITS 基因序列设计多重PCR 引物,建立黄曲霉素产毒真菌的多重PCR 检测体系,为该类真菌的分子鉴定提供借鉴。
1 材料与方法
1.1 材料
仪器:MJ-150-II 型霉菌培养箱、HZQ-X300C 型恒温振荡器、DK-8D 型三孔电热恒温水槽(上海一恒科学仪器有限公司);GenoSens 1850 型凝胶成像仪(北京勤翔生物技术有限公司);NanoDrop 2000 型超微量分光光度计(美国Thermo Fisher 公司);T100 型PCR 仪(美国Bio-Rad 公司);GNJS-Ⅱ型菌落计数器(上海谷宁仪器有限公司)。
试剂:dNTP、Taq 酶、DNA Marker 及真菌、植物基因组DNA 提取试剂盒,均购自上海生工生物技术有限公司(批号分别为GA14KA7272,AK71529A,H701KA0592,H111KA8418,GB16KA7790)。细菌琼脂粉、胰蛋白胨、葡萄糖、酵母浸粉、马铃薯-葡萄糖琼脂(PDA)培养基、沙氏葡萄糖液体(SDB)培养基,均购自杭州水露生物科技有限公司。
菌株:包括黄曲霉Aspergillus flavus AS 3.3554、寄生曲霉 Aspergillus parasiticus AS 3.124、土曲霉Aspergillus terreus AS 3.3935、杂色曲霉Aspergillus versicolor AS 3.3886、红曲霉Monascus sp AS 3.782、烟曲霉Aspergillus fumigatus AS 3.3572、毛 霉 Mucor AS 3.3447、链格孢霉Alternaria AS 3.4255、青霉Penicillium expansum AS 3.3875、黑曲霉Aspergillus niger CMCC(F)98003 和构巢曲霉Aspergillus nidulans AS 3.3916,均购自杭州水露生物科技有限公司。
1.2 方法
1.2.1 菌株培养
将1.1 项下11 种菌株分别接种于PDA 培养基上,28 ℃培养箱中活化培养5~7 d,以菌落计数器观察各菌株的生长情况。
1.2.2 不同DNA 提取方法考察
提取试剂盒考察:分别用Ezup 柱式植物基因组DNA 抽提试剂盒、Ezup 柱式真菌基因组DNA 抽提试剂盒提取各菌株DNA,各菌株DNA 采用液氮研磨的取材方式,以DNA 琼脂糖凝胶电泳结果和ITS 基因序列结果评价提取试剂盒的优劣。
处理方式考察:采用提取效果较优的试剂盒,评价DNA 不同取材方式对总DNA 提取的影响。即对平皿培养后的菌落采取以下3 种取材方式,直接将菌丝从平皿上刮下,放入2 mL 离心管中,进行DNA 提取;用提取试剂盒中的buffer PCB 将斜面培养的菌丝溶解,取溶解液适量置2 mL 离心管中,进行DNA 提取;平皿上的菌丝转移至研钵内,液氮研磨后再用试剂盒提取。总DNA 提取产物用1%琼脂糖凝胶电泳验证。
1.2.3 目标基因引物设计与扩增
根据Ver-1,VerB,ITS 序列,通过引物设计软件Primer 5.0 设计相对应的多重PCR 引物(见表1),引物序列由上海生工生物工程有限公司合成。

表1 黄曲霉素产毒真菌的多重PCR 目标基因及引物Tab.1 Multiplex PCR target genes and primers of aflatoxigenic fungi
1.2.4 单重PCR 检测的特异性与灵敏度测定
PCR 反应体系:10.0 μL 5 ×PCR buffer,5.0 μL 10 mmol/L dNTP,5 μmol/μL 引物2 μL,4 μL 25 mmol/L MgCl2,0.5 μL Taq 酶(5 U / μL),1 μL DNA模板(10 ng/μL),加ddH2O 至50 μL。PCR 反应程序:94 ℃预变性5 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min;4 ℃保存。1%琼脂糖凝胶电泳检测产物纯度。
以1.1 项下11 种菌株的DNA 为模板,在不同反应管中分别扩增Ver-1(800 bp)、VerB(1 000 bp)、ITS(600 bp)目标基因片段,测定单基因PCR 的特异性。以浓度确定的黄曲霉菌株基因组DNA(20 ng/μL)为模板,按质量浓度1 pg/μL~10 ng/μL 进行梯度稀释,经1%琼脂糖凝胶电泳检测单基因PCR 扩增的灵敏性。
1.2.5 多重PCR 特异性与灵敏性测定
以1.1 项下11 种菌株的DNA 为模板,在同一反应管中同时进行Ver-1(800 bp)、VerB(1 000 bp)、ITS(600 bp)目标基因片段的扩增,测定多重PCR 的特异性。以浓度确定的黄曲霉菌株基因组DNA(20 ng/μL)为模板,依次稀释至10,1 ng/μL,100,10,1,0.1 pg/μL,然后分别经1%琼脂糖凝胶电泳检测多重PCR 扩增的灵敏度。
1.2.6 多重PCR 检测的重复性与稳定性测定
平行提取3 份黄曲霉菌株DNA,按上述条件进行单管多重PCR 扩增,验证体系的重复性;分别在第1,4,7 天用同一份黄曲霉菌株DNA 进行单管多重PCR 检测,验证体系的稳定性。
2 结果
2.1 菌株培养
各菌株培养结果见图1。
2.2 DNA 提取方法比较
试剂盒优选:将1.1 项下11 种菌株用液氮研磨后,分别采用Ezup 柱式真菌基因组抽提试剂盒和Ezup 柱式植物基因组抽提试剂盒进行总DNA 的提取。结果采用真菌基因组抽提试剂盒的DNA 条带显示率为100%,采用植物基因组抽提试剂盒的DNA 条带显示率为50%(见图2);以真菌共有ITS 序列为目标基因,进行PCR扩增,结果采用真菌基因组抽提试剂盒的ITS 扩增率为100%,而采用植物基因组抽提试剂盒,ITS 扩增率为66.7%(见图3)。故选用真菌基因组抽提试剂盒提取。
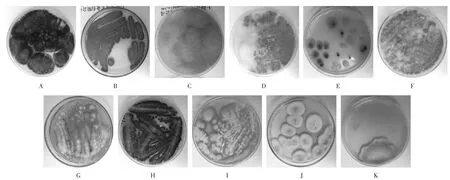
A.黑曲霉 B.青霉 C.毛霉 D.寄生曲霉 E.红曲霉 F.黄曲霉 G.杂色曲霉 H.烟曲霉 I.土曲霉 J.构巢曲霉 K.链格孢霉图1 各菌株培养结果(×100)A.Aspergillus niger B.Penicillium expansum C.Mucor D.Aspergillus parasiticus E.Monascus F.Aspergillus flavus G.Aspergillus versicolor H.Aspergillus fumigatus I.Aspergillus terreus J.Aspergillus nidulans K.AlternariaFig.1 Culture results of each strain(×100)
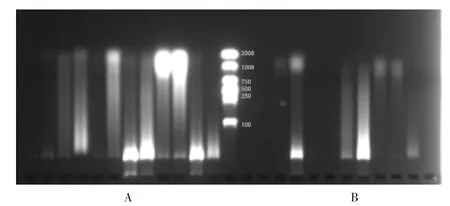
A.Ezup 柱式真菌基因组抽提试剂盒 B.柱式植物基因组抽提试剂盒Marker图2 两种不同试剂盒DNA 琼脂糖凝胶图像A.Ezup column fungal genome extraction kit B.Column plant genome extraction kit MarkerFig.2 DNA agarose gel images of two different kits
取材方式:采用Ezup 柱式真菌基因组抽提试剂盒提取各菌的DNA,按1.2.2 项下方法处理样品。结果第1 种取材方式总DNA 直接电泳,条带显示率为16.7%,第2 种为50.0%,第3 种为100.0%(见图4);以真菌共有ITS 序列为目标基因进行扩增,结果第1 种取材方式ITS 扩增率为75.0%,第2 种为91.7%,第3 种为100.0%(见图5)。故选用液氮研磨法处理样品。
2.3 单重PCR 检测特异性与基因序列比对
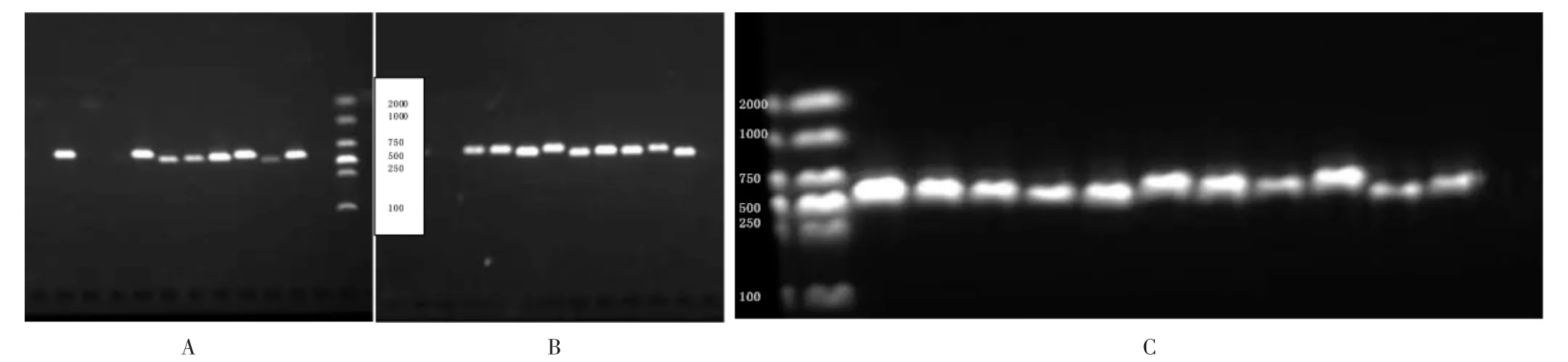
将11 种 菌株的DNA 用3 个引物(ITS,Ver-1,VerB)进行PCR 扩增后,仅黄曲霉和寄生曲霉出现3 个条带,分别为600,800,1 000 bp 的特异片段,其余9 种仅获得600 bp 的特异片段,详见图6。
测序后与GenBank 中已知基因序列对比(见图7),可见600,800,1 000 bp 片段分别对应的是各菌株的ITS 片段、黄曲霉和寄生曲霉的Ver-1 与VerB 基因序列,表明针对目的DNA 片段检测的引物设计成功。
2.4 多重PCR 检测的特异性及灵敏性
特异性分析:将1.1 项下11 种菌株以液氮研磨处理,按1.2.4 项下方法扩增(图8 A)。黄曲霉、寄生曲霉是已知可产毒的菌株,均出现了3 个条带(泳道1 和2),除了构巢曲霉ITS 条带较弱以外,其余菌株均仅出现了1 个明亮的ITS 条带(泳道3~11)。
灵敏性分析:将已知浓度的黄曲霉DNA 进行梯度稀释(0.1 pg/μL~10 ng / μL),按1.2.4 项下方法扩增(见图8 B)。结果表明,在DNA 质量浓度达到1 ng/μL 时,出现明亮的多重条带(泳道5);而DNA 质量浓度在0.1 ng/μL 时,ITS 条带亮度很弱,另外2 个目标条带则完全不显现(泳道4)。
A.第1 种 B.第2 种 C.第3 种图5 不同取材方式下各菌株的ITS 图像A.The first kind B.The second kind C.The third kindFig.5 ITS images of each strain under different sampling methods

1.ITS 2.Ver-1 3.VerB图6 11 种菌株3 个目的基因单重PCR 检测结果1.ITS 2.Ver-1 3.VerBFig.6 Single PCR detection results of target genes of 11 strains
2.5 多重PCR 检测的重复性与稳定性
平行提取3 份黄曲霉的DNA,进行多重PCR 检测(图9 A)。取同1 份黄曲霉总DNA,分别在第1,4,7 天进行PCR 检测(图9 B)。结果表明,所建立的体系连续3 次检测结果一致,且在7 d 内稳定性良好。
3 讨论
3.1 DNA 提取方式对多重PCR 体系的影响
DNA 质量对多重PCR 结果的影响较大,常用的DNA 提取方式有CTAB 法、SDS 法、改良SDS 法等,本研究中根据DNA 提取方式的不同,考察了2 种提取试剂盒,发现以CTAB 法为原型的Ezup 柱式提取试剂盒所提取的DNA 效果更佳。
以真菌为原材料的DNA 提取主要有菌株冻干粉直接提取、菌株复苏培养后收集菌丝体提取、菌株培养后菌丝体用液氮研磨后提取等多种方式,本研究中对不同提取方式均进行了尝试,结合实际发现,菌株用平皿扩大培养后,刮取菌落用液氮研磨后再提取DNA,所得总DNA 质量最佳。原因可能是真菌的细胞裂解程度相关,液氮冷冻处理后,再加裂解液水浴,可显著提高细胞破碎度、增加DNA 溶出率,从而提高DNA 产量。
3.2 引物设计对多重PCR 体系的影响
在进行黄曲霉素产毒真菌的检测中发现,若想获得高灵敏度、高重复性、高稳定性的PCR 体系,优质、合适的引物也是关键。本研究初期共设计了20 对引物,通过单重PCR 筛选,最终获得3 条最佳引物。在引物设计中,将引物长度控制在18~27 bp、产物长度控制在200~500 bp、引物GC 含量控制在40%~60%,并尽量减少引物二聚体的形成和发卡结构的形成,可有效提高引物有效性和特异性。

A.ITS B.Ver-1 C.VerB图7 基因序列比对结果A.ITS B.Ver-1 C.VerBFig.7 Results of gene sequence alignment
综上所述,本研究中设计的引物具有良好的特异性,且引物灵敏度较高,平行重复3 次,均可呈现明亮条带,7 d 内稳定性良好。这说明建立的多重PCR体系具有较好的适用性,可用于后续黄曲霉素产毒真菌的检测。

A.特异性 B.灵敏性注:图A 中,1-11 分别为黄曲霉、寄生曲霉、土曲霉、杂色曲霉、红曲霉、烟曲霉、毛霉、链格孢酶、青霉、黑曲霉、构巢曲霉;图B 中1-6 分别为0.1,1,10,100 pg/μL,1,10 ng/μL。图8 多重PCR 检测各菌株基因组基因特异性与灵敏性检测A.Specificity B.SensitivityNote:In Fig.A,1 -11 respectively represent Aspergillus flavus,Aspergillus parasiticus,Aspergillus terreus,Aspergillus versicolor,Monascus,Aspergillus fumigatus,Mucor,Alternaria,Penicillium expansum,Aspergillus niger and Aspergillus nidulans;In Fig.B,1-6 respectively represent 0.1 pg/μL,1 pg/μL,10 pg/μL,100 pg/μL,1 ng/μL,10 ng/μL.Fig.8 Multiplex PCR detection of gene specificity and sensitivity of each strain genome

A.重复性 B.稳定性注:图A 中,1~3 分别表示平行提取的3 份黄曲霉DNA 样品,图B 中,1~3 分别表示第1、4、7 天用同一份DNA 进行多重PCR。图9 多重PCR 检测的重复性与稳定性A.Repeatability B.StabilityNote:In Fig.A,1-3 respectively represent the three Aspergillus flavus DNA samples extracted in parallel,and in Fig.B,1-3 respectively represent the multiplex PCR with the same DNA on day 1,4 and 7.Fig.9 Repeatability and stability of multiplex PCR detection
