妊娠合并糖原累积病Ⅰa型一例并文献复习
2022-01-05殷红宇李丽玲陈悦
殷红宇,李丽玲,陈悦
糖原累积病(glycogen storage disease,GSD)是由糖原代谢相关酶缺乏或活性降低引起的一组临床和遗传异质性疾病,可导致糖原在多个组织脏器中如肝脏、肾脏中累积[1]。GSDⅠ型为最常见的类型,约占所有GSD 的25%,发病率约为1/10 万[2]。GSDⅠ型是缺乏葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)引起的,此酶是糖原代谢的关键酶之一,缺失可致糖原分解和糖异生减少[3]。G6Pase 基因(G6PC)催化单位位于染色体17q21 上,全长12.5 kb,由5 个外显子组成[4]。GSDⅠa 为GSDⅠ中最常见的亚型,肝肿大、低血糖、乳酸血症、高脂血症、高尿酸血症和生长迟缓是其常见症状[5]。近年来基因检测成为诊断GSD的主要方法[6]。该疾病目前还无法根治,主要靠饮食疗法改善代谢,防止远期并发症。患者有可能成功妊娠,但存在的特殊风险较多,目前国内外关于GSDⅠa型患者成功妊娠的案例罕见。本文报告1 例妊娠合并GSDⅠa型患者的临床经过。
1 病例报告
1.1 病例特征患者 女,20 岁,因停经37 周,反复头晕6个月,发现肝脏占位2 个月,于2020年7 月8 日收住广西医科大学第一附属医院(我院)产科。平素月经规律,末次月经2019年10 月23 日,12 月3 日B 超提示宫内早孕,孕5 周;双肾实质回声增强,未见占位性病变;肝胆脾胰未见异常。妊娠早期反复出现头晕乏力,偶伴心悸,期间查:血红蛋白60 g/L,血清铁蛋白8.07 ng/mL,尿酸716.6 μmol/L,尿蛋白(+)。相关检查排除α、β 地中海贫血,考虑为妊娠合并缺铁性贫血。在孕11+~36+周因重度贫血曾3 次在外院住院予输血治疗,并长期口服补血药物(具体不详),期间监测血红蛋白波动于49~82 g/L,时有头晕不适。孕24 周胎儿B 超相当于孕22+周。75 g口服糖耐量试验示:空腹血糖3.61 mmol/L,餐后1 h血糖11.39 mmol/L,餐后2 h 血糖8.02 mmol/L,诊断为妊娠期糖尿病,予糖尿病饮食,监测空腹血糖波动于3.38~6.40 mmol/L。妊娠6 个多月时外院查腹部及泌尿系超声提示新发肝左叶实质性占位(2 个,较大者直径约7 cm,考虑为肝腺瘤?肝癌?),双肾弥漫性病变,肝功能未见异常。2020年7 月4 日外院复查腹部超声示肝脏占位大小较前未见明显改变,甲胎蛋白(AFP)289.10 ng/mL。为进一步诊治,2020年7 月8 日孕37周至我院就诊。胎儿B 超:双顶径86 mm,头围307 mm,腹围295 mm,股骨长61 mm,诊断胎儿生长受限。肝肾B 超:肝大,肝左叶多发高回声团(较大者约7.3 cm×6.9 cm 肝血管瘤?),双肾弥漫性病变。患者妊娠期体质量增加约6 kg。
1.2 既往史、月经婚育史、家族史2016年因生长发育迟缓及月经未来潮并反复头晕至外院检查发现贫血(具体不详)。17 岁月经来潮,经期规律,经量一般,未曾服用过避孕药,孕0 产0,未婚有性生活史。父母非近亲结婚,父亲身高168 cm,体质量65 kg,母亲身高162 cm,体质量48 kg。弟弟18 岁,身高145 cm,体质量35 kg。
1.3 体格检查身高153 cm,体质量43 kg,体质量指数(BMI)18.38 kg/m2。贫血貌,体型消瘦,腹部隆起小于孕月,肝缘位于右侧肋弓下2 cm、剑突下3 cm,圆钝,质地软,脾缘位于左侧肋弓下2 cm,双下肢无水肿。专科情况:宫高28 cm,腹围86 cm,头先露,未入盆,胎心150 次/min,估计胎儿体质量2 200 g。
1.4 辅助检查血常规:红细胞2.97×1012/L,血红蛋白71 g/L;血清铁蛋白13.77 ng/mL;尿酸660 μmol/L;血脂:总胆固醇7.37 mmol/L,三酰甘油14.08 mmol/L;糖化血红蛋白(HbA1c)5%;凝血功能检查示纤维蛋白原(FIB)5.55 g/L;血栓弹力图示FIB 及血小板功能活性高;D-二聚体定量552 ng/mL。余未见显著异常。肝脏普美显磁共振成像(MRI)示:①肝脏肿大,符合慢性肝病;②肝S2、4 多发占位(一大一小类圆形异常信号灶,较大者约7.6 cm×6.2 cm×6.6 cm,边界清:肝腺瘤可能性大;③双肾弥漫性病变;④双肾小囊肿。
1.5 入院诊断①肝脏占位(肝腺瘤?肝血管瘤?肝癌?);②妊娠期糖尿病;③胎儿生长受限;④妊娠晚期(孕1 产0 妊娠37 周);⑤头位;⑥双肾弥漫性病变;⑦中度贫血;⑧铁缺乏。
1.6 诊治经过患者体型消瘦,肝脏占位,顽固性贫血同时存在严重的高胆固醇血症及高三酰甘油血症、高尿酸血症、糖尿病,多次进行多学科讨论后,临床怀疑为罕见的代谢性疾病——GSD,建议行基因检测明确诊断。因肝脏占位较接近肝包膜,顾虑阴道分娩可能导致瘤体破裂,孕妇及家属要求剖宫产,于7 月14 日妊娠37+6周剖宫产一男婴,出生Apgar评分10 分,体质量2 460 g,生后血糖2.5 mmol/L。产后当天患者曾多次出现低血糖(2.3~3.3 mmol/L),静脉滴注及口服葡萄糖液缓解。产后第4 天开始规律口服生玉米淀粉治疗(每次1.5~2.0 g/kg,每隔4 h 1 次)。术后第7 天出现右足肿痛,伴行走困难,诊断痛风予对症处理后稍有改善。产后多次复查血红蛋白波动于70~80 g/L。新生儿住院期间心脏超声提示:房间隔膨出瘤(宽约6 mm,深约4 mm)形成并房间隔小缺损(2 mm)可能;余未见明显异常,血糖正常,人工喂养,一般情况好,术后7 d 母儿出院。患者、弟弟及父母的基因全外显子测序(北京迈基诺医学检验所)结果示:患者G6PC 基因在17 号染色体上存在2 个杂合突变。1 个来自父亲,为c.664G>A(p.G222R)位点;1 个来自母亲,为c.648G>T(p.L216=)位点,见图1。其胞弟也确诊为同型GSD(Ⅰa型),见图2。患者2020年9 月至我院肝胆外科住院,血红蛋白92.50 g/L,予行肝S2段切除术。病理检查及免疫组织化学结果均支持肝细胞腺瘤的诊断,大部分肿瘤细胞呈脂肪变性。
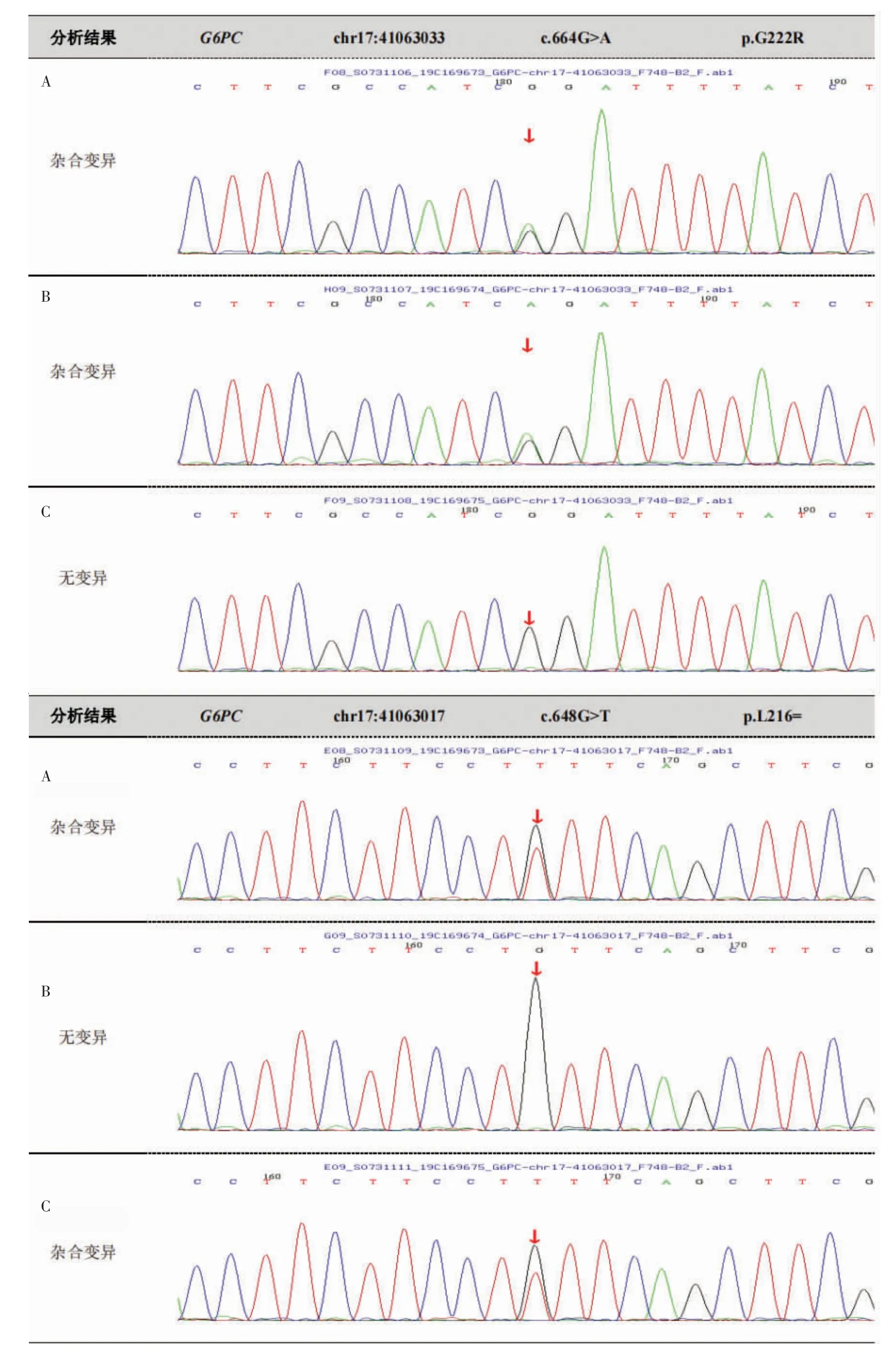
图1 患者及其父母G6PC 基因5 号外显子部分序列图
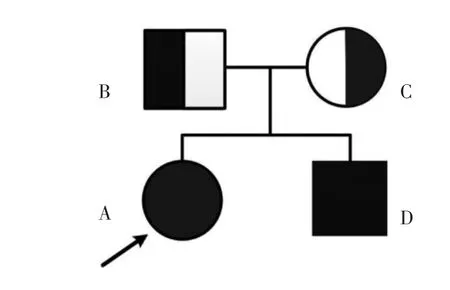
图2 患者家系图
1.7 随诊结果患者2020年12 月30 日复查血常规:红细胞3.50×1012/L,血红蛋白91.7 g/L;腹部超声未见异常。患者目前未再服用生玉米淀粉,主食为大米,体质量37.5 kg,婴儿未能定时体检,人工喂养,体质量8 kg,生长发育尚可,生后1个月行G6PC 基因检测未见致病基因。
2 讨论
随着对GSD 的逐渐重视及患者预期寿命的延长,女性患者妊娠期管理成了新的关注点。一项对于32 例GSDⅠ型女性生育力的研究发现,尽管月经周期紊乱和多囊样卵巢的发生率较高,但其生育力似乎并未受到影响[7]。妊娠成功的案例时有报道,因合并症复杂多变,妊娠结局不一,因此,了解并掌握其妊娠期管理对产科医生来说尤为重要。
2.1 肝腺瘤肝腺瘤是GSDⅠa型最常见的并发症,继发肝腺瘤的严重后果为腺瘤破裂出血和恶变,而妊娠恰恰是其高危因素。据报道与妊娠相关的高雌激素状态可能导致腺瘤形成和瘤体增长[8],有关GSDⅠ型患者妊娠期间新发肝腺瘤的病例报道相对罕见,1 例GSDⅠb 患者在首次妊娠期间发现腺瘤,第2 次妊娠时出现多发性腺瘤;1 例GSDⅠa 患者妊娠期出现腺瘤的增大[7];而一项关于11 例GSDⅠa 女性15 次妊娠的回顾性研究中,大多数患者均未观察到肝腺瘤大小或数量在妊娠期显著增加[9]。
欧洲糖原累积病Ⅰ型研究(European Study on Glycogen Storage Disease TypeⅠ,ESGSDⅠ)指南建议GSD 患者在已知合并肝腺瘤的情况下,每3 个月进行1 次腹部超声并监测AFP 及癌胚抗原(carcinoembryonic antigen,CEA)水平,有研究亦提出维生素K 缺乏或拮抗剂Ⅱ诱导的蛋白质(protein induce by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)将成为预测腺瘤恶变的可靠肿瘤标志物[10]。当超声提示病灶增大、边缘模糊或自发性出血时,可用成像更清晰的CT 或MRI 检查来明确诊断,但针对这一结果的处理目前仍有待商榷[11-12]。妊娠前发现直径≥5 cm 的腺瘤,建议及时手术切除;妊娠期间发现的腺瘤也可结合孕周及患者自身状况适时考虑手术切除;若病变直径<5 cm,可每6 周通过肝脏超声密切监测[13-14]。研究表明与腺瘤形成关系最密切的指标是血清三酰甘油浓度,三酰甘油浓度低于500 mg/dL 的患者,肝腺瘤的发生率会明显降低[15-16]。
2.2 贫血肝腺瘤患者更易表现出慢性贫血,可能与腺瘤组织中铁调素的高表达有关,这是一种由炎症诱导的肽类激素,可阻止巨噬细胞释放铁,干扰肠道铁的吸收[17]。贫血程度越严重,肿瘤负担亦越重[16,18]。本例患者腹部超声首次提示肝腺瘤存在时,正是贫血严重住院输血治疗期间,重度贫血、缺铁性贫血可能与肝腺瘤的形成有关[16]。有学者指出,大多数肝腺瘤贫血患者在腺瘤切除或肝移植后血红蛋白水平恢复正常。在无替代治疗方案时,继发于肝腺瘤的严重缺铁性贫血最好是手术切除[19]。有研究报道经积极使用生玉米淀粉治疗后贫血症状逐渐改善[20]。本例患者产后未坚持生玉米淀粉饮食,产后1 个月余复查血红蛋白上升至92.50 g/L,行肝腺瘤切除术后3个月余复查血红蛋白较前无改善,无法证实患者贫血改善与生玉米淀粉治疗及切除肝腺瘤有关。
2.3 基因分型本例患者G6PC 基因发现有2 个杂合突变。经家系验证分析,c.664G>A(p.G222R)受检人之父该位点杂合变异,664 号的核苷酸由鸟嘌呤G变为腺嘌呤A(c.664G>A)的杂合突变导致第222 号氨基酸由甘氨酸变为精氨酸为错义突变;c.648G>T(p.L216=)受检人之母该位点杂合变异,(p.G222R)在648 号核苷酸由鸟嘌呤G 变为胸腺嘧啶T(c.648G>T)的杂合突变,导致氨基酸发生同义突变(p.L216=)。有文献报道,部分基因型如c.648G>T 纯合突变,患者可无明显低血糖表现。本例患者呈重度贫血,而低血糖不明显,考虑可能与其基因型有一定关系[21]。
2.4 孕期及新生儿血糖管理有学者提出,GSD 孕妇不适宜行糖耐量试验,因其不耐受空腹血糖的监测,而口服大剂量的葡萄糖又存在诱发反跳性低血糖、急性乳酸酸中毒及肝肿大的风险,妊娠期糖尿病的诊断只能基于频繁监测血糖来作为参考[22]。建议在整个妊娠期进行严格的代谢控制,一项针对GSDⅠa患者饮食干预的系统评价与荟萃分析提出,长期间歇服用生玉米淀粉较夜间持续葡萄糖溶液喂养及持续生玉米淀粉喂养相比,能有效避免低血糖发生[23]。分娩期及产后应持续静脉输注葡萄糖液维持血糖稳定,每小时监测血糖及乳酸水平,在加强代谢控制的前提下才可考虑母乳喂养。因GSD 患者自身糖原储备不足,其新生儿出生后应严密监测血糖,若血糖水平低于60 mg/dL,必要时可加测乳酸及血脂,并及时行基因检测[22]。除先天性心脏病,GSD 患者早产、极低出生体质量儿与正常人群无明显差异[11],低血糖发病率尚不知晓。
2.5 分娩方式的选择对于GSDⅠ型孕妇分娩方式的选择国际上尚未达成共识,GSD 并非剖宫产的绝对指征,仅在合并如巨大肝脏占位、先兆子痫[24]等不适宜阴道分娩的并发症时,可放宽剖宫产指征,孕期代谢控制良好且合并症不严重者可尝试阴道分娩。在已报道的研究中,仅少数患者因合并与GSD无关的疾病行剖宫产终止妊娠,大部分均可成功经阴道分娩[9]。因多数GSD Ⅰ型患者合并血小板及凝血功能异常[25],妊娠期产后大出血风险较高,剖宫产相对来说更安全。
综上,妊娠合并GSDⅠa 患者计划妊娠时应行妊娠前咨询,有条件者可妊娠期行产前诊断,应经常监测血糖,停用一切可疑致畸药物,如别嘌呤醇、降脂药物、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂(ACEI/ARB)等,定期监测血脂、血尿酸、肝肾功能、全血计数及尿蛋白等实验室指标,腹部/泌尿系超声等影像学检查。患者应在具有危急重症抢救能力的综合医院定期产检,妊娠期需行多学科参与协助诊治。只有严格的妊娠期管理,才能确保母胎安全。
