SPOP蛋白MATH结构域特异性结合寡肽的抗肾癌作用研究
2022-01-04刘改娟邢龙龙强亚欣吕贯廷
刘 薇,沈 磊,刘改娟,邢龙龙,强亚欣,吕贯廷
(1. 河北省健海生物芯片技术有限责任公司,河北 石家庄 050035;2. 河北健海医学检验实验室,河北 石家庄 050035)
肾细胞癌(renal cell carcinoma,RCC),是起源于肾实质泌尿小管上皮系统的恶性肿瘤,在肾脏恶性肿瘤中的占比为80~90%,在成人恶性肿瘤中约占2%~3%[1]。临床研究表明,肾癌的主要治疗方法是手术切除[2],然而,对于已经发生肿瘤转移的肾癌患者,极少数人可以通过手术获得生存期的延长。据研究,20%~25%的肾癌患者在疾病早期即发生转移,而转移后肾癌患者的5年生存率低于10%[3]。虽然目前国际上已批准的肾癌治疗药物多达十余种,但这些药物对转移性肾癌的治疗效果均十分有限,且易产生耐药性,治疗效果不佳。因此,研发针对肾癌的新型特异性药物是一项十分紧迫并具重大意义的任务。
SPOP蛋白作为E3泛素连接酶cullin3的接头分子,组成的E3泛素连接酶复合体,在很多蛋白的泛素化以及降解的过程中起重要作用[4]。2009 年Liu J等发表在Science上的论文指出,在99%的透明细胞肾癌的肿瘤组织中,SPOP均过表达[5],而在正常肾组织中SPOP的表达很低,并且在转移性肾癌中SPOP同样过表达。研究人员在对SPOP的作用机制进一步研究时发现,胞质中的SPOP可以与抑癌因子PTEN 和ERK 磷酸酶DUSP7结合,之后通过泛素化通路使抑癌因子降解,进而激活PI3K-Akt和ERK肿瘤信号通路[6]。此外,肾癌组织中的SPOP还可以通过降解Daxx和Gli2来抑制细胞凋亡,促进癌细胞的增殖,导致肿瘤发生。相对应的,敲除SPOP基因可以显著抑制肾癌细胞的生长。以上结论表明,SPOP可以作为透明细胞肾癌的生物标志分子用于诊断或者疾病治疗。
因此,本研究将SPOP蛋白作为潜在的药物靶标展开研究,以小分子寡肽为研究对象,应用细胞转染技术研究其对肾癌细胞的增殖抑制作用,以期获得新的抗肾癌药物研究方向,为建立抗肿瘤药物的筛选方案打下基础。
1 材料与方法
1.1 材料
1.1.1 细胞株及主要试剂
786-O细胞与Hek293细胞株:购自中国科学院典型培养物保藏委员会细胞库;细胞培养基:RPMI 1640培养基(ThermoFisher )、胎牛血清(Gibco );质粒提取试剂盒:无内毒素质粒提取试剂盒(天根);转染试剂:TransIntroTM PL Transfection Reagent(全式金TransGen Biotech);MTT法细胞增殖检测试剂盒:MTT Cell Proliferation and Cytotoxicity Assay Kit(碧云天Beyotime)。
1.1.2 主要仪器设备
BioFlash全自动酶联免疫扫描仪(Werfen,西班牙),生物安全柜(Thermo Scientifc 1300,美国),高速台式离心机(ThermoFisher),细胞培养箱(Thermo Scientific Forma,美国),微量移液器(eppendorf,德国)。
1.2 方法
1.2.1 SBC寡肽编码基因序列的设计及质粒载体基因合成
利用计算机程序分析SPOP(MATH)结构,确定SPOP(MATH)蛋白表面的一些特异疏水性位点,随后用计算机程序模拟可能和SPOP(MATH)热点位置结合的小分子多肽,完成SPOP寡肽分子的虚拟筛选:标记为SBC01-SBC08。
1.2.2转化及质粒提取
根据模拟SBC的氨基酸序列,转换成核酸序列,选择pcDNA 3.1载体,提交基因合成公司,构建SBC真核表达载体。
取50 μL的大肠杆菌感受态细胞,分别加入适量的SBC01-SBC08质粒(体积不超过4μL),冰浴30 min 后,于水浴锅中42℃热激活90 s,马上放冰浴2 min;加入400μL LB培养基,于37℃摇床中振荡摇培45-60 min;分别取50-100 μL 涂布在含有氨苄青霉素(100μg/mL)的 LB固体培养基上,37℃倒置培养过夜。
挑取8种质粒的单克隆菌落于LB液体培养基中,再次37℃摇培过夜后,分别收集菌体,使用无内毒素质粒提取试剂盒进行SBC01-SBC08 8种质粒的分别提取,提取操作严格按照说明书的步骤进行。
1.2.3 细胞培养与转染
(1)细胞培养:肾癌细胞786-O及对照Hek293细胞,使用10%胎牛血清+1%青霉素-链霉素的RPMI 1640,DMEM培养基培养,细胞在5% CO2的37℃细胞培养箱中培养,根据细胞生长情况2-3 d换液一次,细胞融合度达到90%后,进行传代或者其他后续实验操作。
(2)细胞转染:收集对数生长期的细胞,制成单细胞悬液后进行细胞计数,在6孔培养板中,每孔接种4-5×105个细胞,设置9个培养孔,培养24h后,细胞融合度达到大约70%,分别转染空载质粒及pcDNA3.1(+)-SBC组,转染步骤严格按照转染试剂说明操作。
1.2.4 细胞克隆形成实验及MTT法测细胞增殖
(1)克隆形成实验:转染后24 h,收集细胞并计数,取1×104个细胞接种于24孔培养板,继续培养,2 d后用瑞吉氏染液对细胞进行染色拍照,A液染色1 min,在A液的基础上,再加B液染色5 min,用纯水冲洗染液后,显微镜拍照。
(2)MTT法检测细胞增殖:转染后24 h,收集细胞并计数,取1×104个细胞接种于96孔培养板,每个转染组设置3个复孔,培养72 h后每孔加入MTT溶液20 μL ,4 h后吸去 MTT,加入 DMSO溶液200 μL,以溶解甲臜结晶,30 min后用酶标仪在A570nm测各孔的吸光度值。
1.2.5 Western Blot测定蛋白表达
将上述步骤中效果最佳的SBC寡肽转染进细胞后离心收集细胞,提取细胞总蛋白,用Western Blot法测定细胞中SPOP、PTEN、DAXX三种蛋白的表达水平差异。
2 结果
2.1 SBC序列
根据计算机程序设计的SBC寡肽的氨基酸序列,转换成核酸序列如表1所示,利用基因合成技术插入到pcDNA3.1-eGFP载体上,用于寡肽的真核表达。

表1 SBC序列
2.2 细胞转染效果
细胞转染SBC质粒后,经过细胞爬片、固定、通透等步骤后,可在荧光倒置显微镜下观察细胞转染效率及表达情况,细胞转染结果见表2。
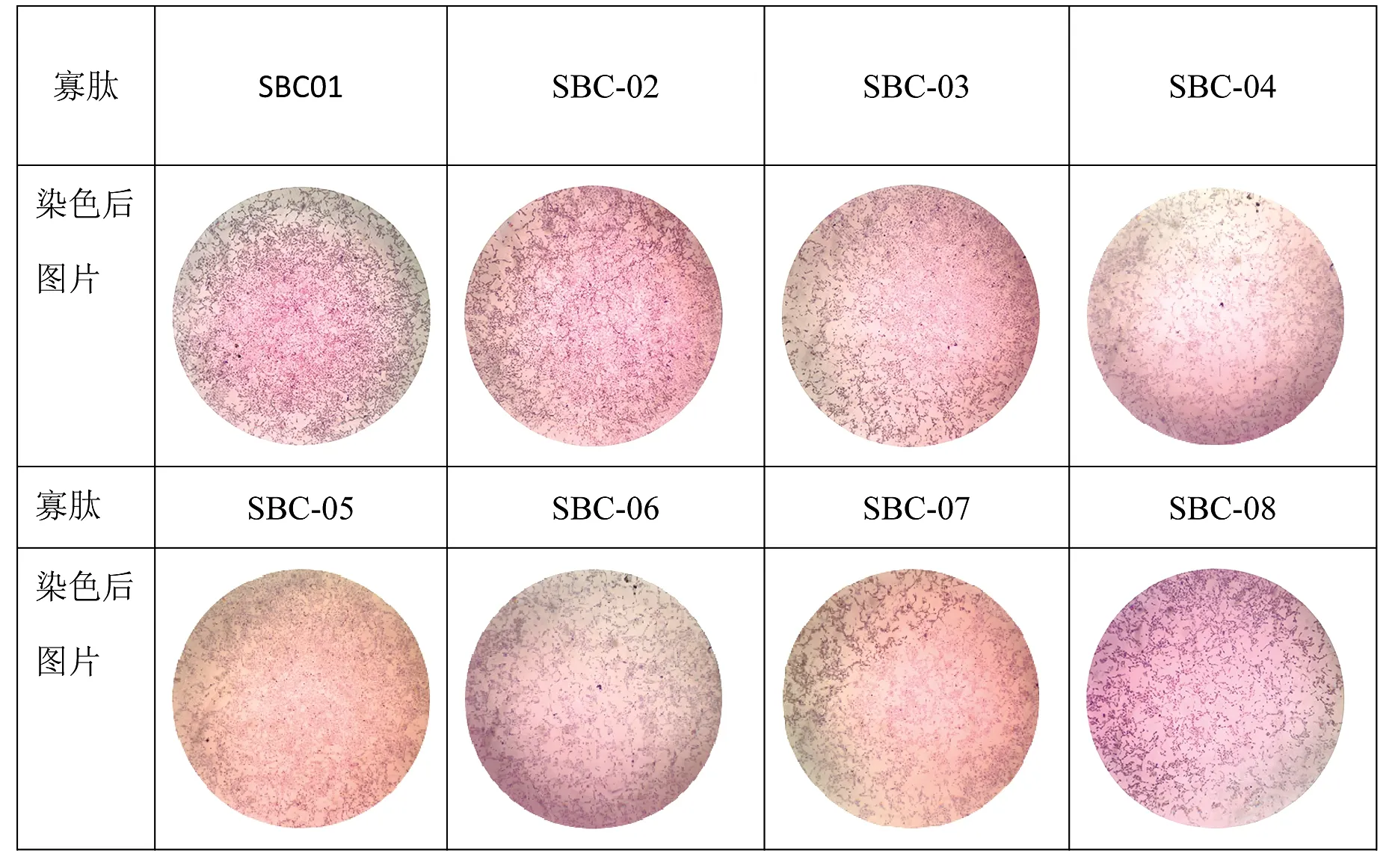
表2 细胞克隆染色结果
2.3 细胞克隆形成实验及MTT法测细胞增殖
转染24h后,取出细胞片,染色后的结果如表2所示,转染SBC-04和SBC-06多肽的细胞较其他组细胞克隆数明显较少,即SBC-04和SBC-06的抑制效果相对较强。
MTT法检测细胞增殖活性,OD值越高代表细胞增殖及生长状态越好,表3和图1展示了8组多肽转染后的MTT测定结果。其中SBC-04组测得的OD值最低,即该组细胞增殖最慢。

表3 MTT法检测细胞增殖活性

图1 MTT细胞活力检测
2.4 Western Blot结果
收集转染SBC-04和SBC-06寡肽后的细胞,进行了Western Blot实验,观察转染后细胞内SPOP、PTEN及DAXX的表达变化,如图2所示,SPOP蛋白表达减弱,而SPOP作用的下游蛋白PTEN、DAXX相对表达增加,抑制癌细胞生长的作用增强,与细胞增殖结果相符合。

图2 Western Blot结果
3 讨论
近年来, 关于蛋白-蛋白相互作用的小分子抑制剂研究已经成为药物学家关注的热点,已有多种蛋白-蛋白相互作用小分子抑制剂(small molecular protein-protein interaction in-hibitors, 简称 SMPIIs)得以报道[7]。例如:P53-MDM2相互作用小分子抑制剂[8]、作用于Bcl家族的小分子抑制剂等[9]。国内外研究表明,透明肾癌细胞的不正常增殖与 SPOP 蛋白的高表达存在一定的相关性和必然性。SPOP可通过泛素化和降解多种肾癌中的抑癌基因PTEN、ERK磷酸酶 DUSP7,凋亡分子Dax以及Hh信号通路转录因子G[10]。有研究显示,敲除SPOP可以抑制肾癌细胞的生长和诱导凋亡[11-13],因此我们根据SPOP的MATH结构域的特征,合成了特异性结合的寡肽,从而通过寡肽与SPOP的结合来竞争性抑制其与底物蛋白质的结合,以干预SPOP介导的调控PTEN、DUSP7等抑癌蛋白的泛素化修饰,进而抑制肾癌细胞在体内外的生长。
在以上设计思路下,筛选了8种寡肽分子来研究其抑制透明肾癌细胞系正常生长的效果,评估出SBC-04具有最佳抑制细胞生长的效果,验证了利用计算机模型进行蛋白结构分析进而获得抗肿瘤小分子寡肽技术路线的可行性。在后期的实验研究中,计划进一步研究并观察其在动物模型体内的的抑癌效果,同时开展横向扩展肾癌细胞种类,纵向确定寡肽的作用机制的研究,并继续以目前的寡肽为核心,进行分子的结构改造,引入一些增效基团,以获得更有效的抑癌效果,为寡肽分子作为药物的理论研究做好进一步的技术研究基础。
