乙型肝炎患者血清miR-27a miR-625表达及与肝硬化和肝癌的相关性研究
2022-01-04刘成敏叶知瑶吴成凤徐理茂
吴 攀, 刘成敏, 叶知瑶, 吴成凤, 徐理茂
(成都医学院第三附属医院消化内科, 四川 成都 611730)
乙型肝炎病毒(hepatitis B virus,HBV)感染是严重的公共卫生问题,在机体免疫应答的过程往往会造成肝细胞损伤和破坏,进而引起肝组织发炎,导致一系列症状和肝功能检查异常,即发生乙型肝炎[1]。HBV感染后在多种因素作用下可能逐步演进为慢性肝炎、肝硬化、肝癌。据调查,由于慢性炎症的反复发作,20%~30%的患者会发展为肝硬化或肝癌[2]。乙型肝炎给患者及社会均带来了沉重的负担,研究其发病机制具有重要价值。微小RNA(microRNA,miRNA)是近年来备受关注的一类分子,广泛参与细胞生长、分化、凋亡、肿瘤发生及病毒感染发病机制等多种生命过程[3]。其中,微小RNA-27a(miR-27a)、微小RNA-625(miR-625)分别在肝癌、肝硬化中差异表达,但在乙型肝炎的表达尚不明确[4,5]。本研究将通过检测乙型肝炎患者血清miR-27a、miR-625表达水平,研究二者与肝硬化、肝癌的相关性。
1 资料与方法
1.1一般资料:选取2019年11月至2021年2月在成都医学院第三附属医院消化内科就诊的慢性乙型肝炎患者67例作为乙型肝炎组、乙型肝炎后肝硬化患者63例作为肝硬化组、乙型肝炎后肝癌患者65例作为肝癌组,选取同期健康体检者65例作为对照组。四组受试者性别、年龄、体质量指数(BMI)比较,差异均无统计学意义(P>0.05),见表1。纳入标准:①慢性乙型肝炎诊断符合《慢性乙型肝炎防治指南(2019年版)》中的相关内容[6],年龄>40岁;②乙型肝炎后肝硬化诊断符合《肝硬化诊治指南》[7]中的相关内容,年龄>40岁;③乙型肝炎后肝癌诊断符合《原发性肝癌诊疗规范(2019年版)》[8]中的相关内容,且经病理检查确诊;④临床检查资料完整者;⑤无精神疾患,可正常沟通。排除标准:①伴有其他恶性肿瘤、其他肝炎病毒感染、其他肝病、严重全身性疾病者;②近6个月内使用过干扰素、核苷酸类似物抗病毒治疗者;③近6个月内使用过激素等免疫调节剂者;④妊娠妇女。本研究经医院伦理委员会批准,所有受试者及其家属签署知情同意书。
1.2主要试剂与仪器:逆转录试剂盒(货号:AB-4366596)购自美国Invitrogen公司;Trizol试剂盒(货号:SK1321)、荧光定量PCR试剂盒(SYBR Green Mix)(货号:K1002S)购自美国Promega公司;实时荧光定量PCR(qRT-PCR)仪(型号:ABI 7500)购自美国Applied Biosystems公司。
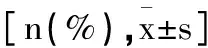
表1 四组受试者一般资料比较
1.3qRT-PCR法检测血清miR-27a、miR-625表达水平
1.3.1总RNA提取:四组受试者均于清晨取空腹外周静脉血5mL,4℃ 3000r/min离心10min,分离血清。按Trizol试剂盒说明书提取总RNA,加Trizol试剂,3000r/min离心10min,收集上清。用紫外分光光度计测定RNA浓度及纯度,以260、280nm波长处RNA样本吸光度值比值处于1.8~2.0为合格。采用琼脂糖凝胶电泳鉴定RNA完整性。
1.3.2cDNA合成:使用逆转录试剂盒将提取的总RNA逆转录成cDNA。加1μL总RNA、1μL通用引物、9μL ddH2O于无菌Eppendof管中,置于65℃水中5min,冰上5min;依次加入5×buffer 4μL、RNA酶抑制剂1μL,10mmoL/L dNTP 2μL和逆转录酶1μL,使用DEPC水补至20μL,充分混匀后在水浴锅中42℃水浴60min,70℃水浴5min。使用qRT-PCR仪按45℃ 25min、95℃ 5min进行逆转录反应。检验合成cDNA的质量,合格后-80℃保存备用。
1.3.3qRT-PCR法检测miR-27a、miR-625水平:以U6为内参基因,采用qRT-PCR仪对miR-27a、miR-625进行扩增。miR-27a、miR-625、U6上下游引物由上海捷瑞生物工程有限公司合成,10μL反应体系:SYBR Green Mix 5μL、50 ng/μL cDNA 1 μL、10 μM上下游引物各0.5μL、ddH2O 3μL。反应条件:95℃ 90 s;95℃ 30 s,63℃ 30 s,40个循环终止。miR-27a上游引物:5′-GCGCTTCACAGTGGCTAAG-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;miR-625上游引物:5′-AGGGGGAAAGTTCTATAGTCC-3′,下游引物:5′-TGGTGTCGTGGAGTCG-3′;内参U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。miR-27a、miR-625相对表达量以2-ΔΔCt法表示,Ct值为扩增产物量达到临界阈值时对应的循环数。

2 结 果
2.1四组血清miR-27a、miR-625水平:与对照组比较,乙型肝炎组、肝硬化组、肝癌组血清miR-27a水平显著升高,miR-625水平显著降低(P<0.05);与乙型肝炎组比较,肝硬化组、肝癌组血清miR-27a水平显著升高,miR-625水平显著降低(P<0.05);与肝硬化组比较,肝癌组血清miR-27a水平显著升高,miR-625水平显著降低(P<0.05)。见表2。

表2 四组血清miR-27a miR-625水平比较
2.2影响乙型肝炎后肝硬化发生的多因素分析:将乙型肝炎后肝硬化是否发生作为因变量,以血清miR-27a、miR-625水平为自变量进行多因素Logistic回归分析,结果显示,血清miR-27a水平为影响乙型肝炎后肝硬化发生的独立危险因素(P<0.05),血清miR-625水平为影响乙型肝炎后肝硬化发生的保护因素(P<0.05)。见表3。
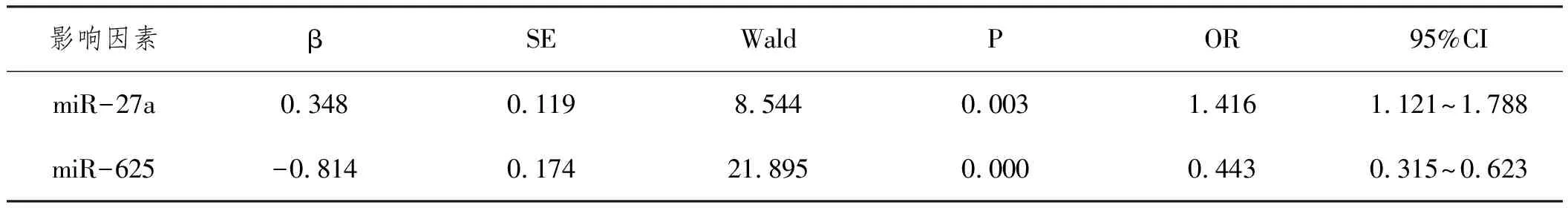
表3 影响乙型肝炎后肝硬化发生的多因素分析
2.3ROC曲线分析血清miR-27a、miR-625水平对乙型肝炎后肝硬化发生的预测价值:血清miR-27a水平预测乙型肝炎后肝硬化发生的曲线下面积(AUC)为0.708(95%CI:0.620~0.797),截断值为1.24,敏感度为73.02%,特异度为61.19%,约登指数为0.342;血清miR-625水平预测乙型肝炎后肝硬化发生的AUC为0.761(95%CI:0.680~0.843),截断值为0.80,敏感度为68.25%,特异度为73.13%,约登指数为0.414。血清miR-27a、miR-625二者联合预测乙型肝炎后肝硬化发生的AUC为0.815(95%CI:0.743~0.888),敏感度为65.08%,特异度为85.07%,约登指数为0.502。见图1。
2.4影响乙型肝炎后肝癌发生的多因素分析:将乙型肝炎后肝癌是否发生作为因变量,以血清miR-27a、miR-625水平为自变量进行多因素Logistic回归分析,结果显示,血清miR-27a水平为影响乙型肝炎后肝癌发生的独立危险因素(P<0.05),血清miR-625水平为影响乙型肝炎后肝癌发生的保护因素(P<0.05)。见表4。
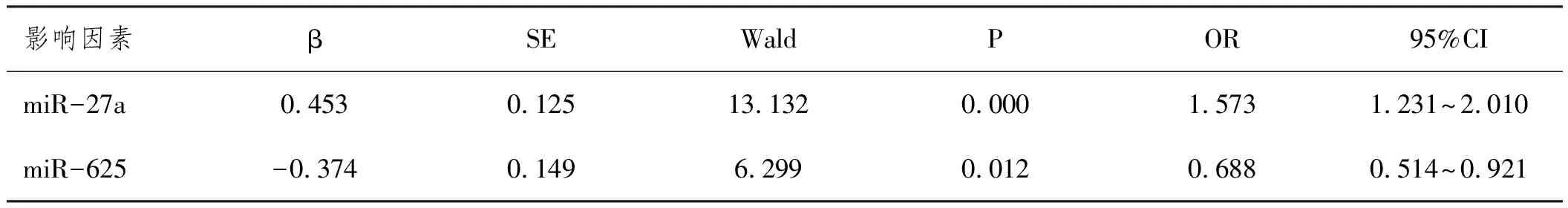
表4 影响乙型肝炎后肝癌发生的多因素分析
图1 血清miR-27a、miR-625水平单独及联合预测乙型肝炎后肝硬化发生的ROC曲线
2.5ROC曲线分析血清miR-27a、miR-625水平对乙型肝炎后肝癌发生的预测价值:血清miR-27a水平预测乙型肝炎后肝癌发生的AUC为0.870(95%CI:0.812~0.929),截断值为1.42,敏感度为79.23%,特异度为66.57%,约登指数为0.458;血清miR-625水平预测乙型肝炎后肝癌发生的AUC为0.913(95%CI:0.864~0.963),截断值为0.71,敏感度为76.92%,特异度为72.54%,约登指数为0.495;血清miR-27a、miR-625二者联合预测乙型肝炎后肝癌发生的AUC为0.966(95%CI:0.938~0.993),敏感度为73.64%,特异度为89.55%,约登指数为0.632。见图2。
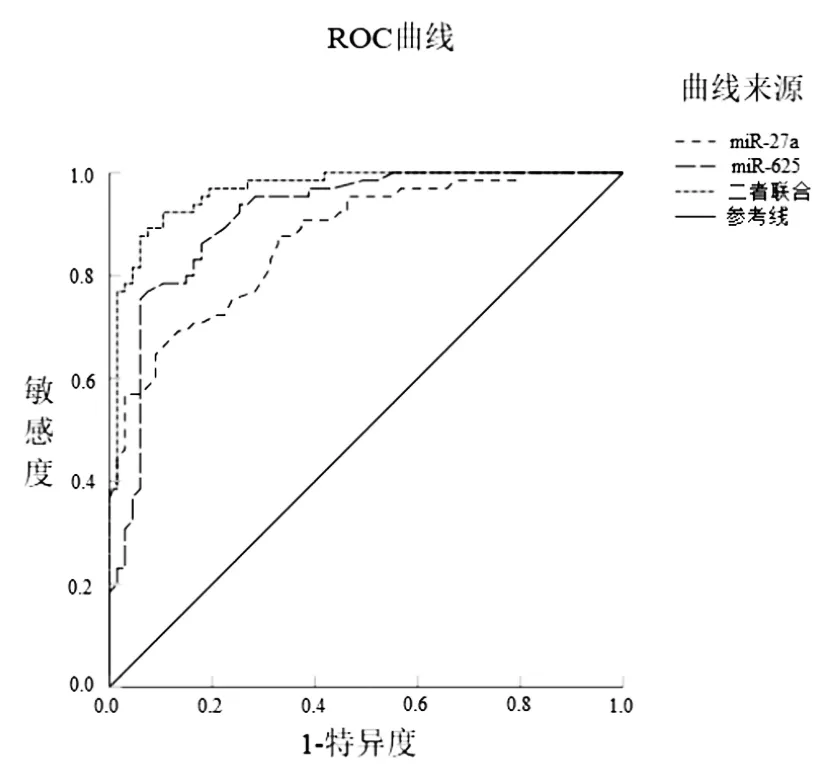
图2 血清miR-27a、miR-625水平单独及联合预测乙型肝炎后肝癌发生的ROC曲线
3 讨 论
HBV是一种亲肝且具有泛嗜性的DNA病毒,中国HBV表面抗原携带者占全国人口的7.18%[9]。感染HBV后,患者的肝脏经历反复损伤和修复过程,引发慢性乙型肝炎,可进一步发展为肝硬化及肝癌,严重影响患者的生命健康。而在HBV感染后的发展过程中,患者临床表现不明显,不易作出准确诊断。因此,寻找与HBV感染后发展过程有关的生物标志物,对防治乙型肝炎进一步发展恶化具有重要意义。
miRNA是一类非编码小分子单链RNA,可在转录或翻译水平上调控相关基因表达,参与肿瘤发生及病毒感染发病机制等过程。据报道,miRNA在HBV引起的肝脏慢性损伤过程中存在差异性表达,参与该进程的发生、发展,且具有更高的组织特异性和可靠性[10]。徐兰锋等[11]研究表明,血清miR-122、miR-130a水平对隐匿性乙型肝炎有重要诊断价值。miR-27a、miR-625是癌症中发挥重要作用的miRNA,在大多数癌症中差异表达,分别发挥促癌及抑癌作用。有研究表明,miR-27a在食管鳞状细胞癌中表达上调,而miR-625可抑制非小细胞肺癌的进展[12]。近年研究发现,miR-27a、miR-625在HBV感染发展中差异表达。本研究结果显示,从对照组、乙型肝炎组、肝硬化组到肝癌组,受试者血清miR-27a水平依次升高,miR-625水平依次降低,提示在乙型肝炎发生及向肝硬化、肝癌进展过程中,miR-27a、miR-625的表达受到严重影响,二者很可能参与HBV感染后乙型肝炎、肝硬化、肝癌的发生发展过程。有研究亦表明,miR-27a可促进肝癌细胞增殖[13]。而肝硬化患者miR-625表达下调,可作为肝硬化的生物标志物[5]。回归分析显示,血清miR-27a、miR-625水平分别为影响乙型肝炎后肝硬化、肝癌发生的独立危险因素和保护因素,提示血清miR-27a、miR-625水平的变化可能改变乙型肝炎发生肝硬化、肝癌的可能性,推测通过降低血清miR-27a水平、升高miR-625水平可能有助于预防乙型肝炎进展为肝硬化、肝癌。ROC曲线分析结果显示,表明血清miR-27a、miR-625对乙型肝炎后肝硬化、肝癌的发生均有一定的预测价值,二者联合预测乙型肝炎后肝硬化、肝癌发生的效果更好。
综上所述,随着乙型肝炎的发生及向肝硬化、肝癌进展,血清miR-27a、miR-625水平分别升高和降低,且两者分别为影响乙型肝炎后肝硬化、肝癌发生的独立危险因素和保护因素,对乙型肝炎后肝硬化、肝癌的发生均有一定的预测价值。本研究虽初步明确了miR-27a、miR-625与乙型肝炎进展的关系,但纳入样本量相对较少,可进一步扩大样本探讨两者在乙型肝炎预后中的作用。
