不同生长时期红螯螯虾肌肉和肝胰腺内氨基酸和脂肪酸变化分析*
2022-01-04秦高婵陈红林储天琪钱豪杰
秦高婵 陈红林 储天琪 钱豪杰 楼 宝
不同生长时期红螯螯虾肌肉和肝胰腺内氨基酸和脂肪酸变化分析*
秦高婵1陈红林2①储天琪1钱豪杰3楼 宝2①
(1. 浙江海洋大学水产学院 浙江 舟山 316022;2. 浙江省农业科学院水生生物研究所 浙江 杭州 310021; 3. 海宁市鸿海养殖有限公司 浙江 嘉兴 314400)
为了研究不同生长时期红螯螯虾()肌肉和肝胰腺内脂肪酸和氨基酸的动态变化,选取90 d (第二性征未发育)、140 d (第二性征发育成熟)和180 d (性腺发育成熟)的红螯螯虾,分别测定其肌肉和肝胰腺内氨基酸和脂肪酸的含量。结果显示,90 d红螯螯虾肌肉中的必需氨基酸总量显著高于其他2个时期(<0.05);而红螯螯虾肝胰腺内必需氨基酸总量和非必需氨基酸总量均随着日龄增加而逐渐下降。比较不同生长时期肌肉中脂肪酸含量发现,随着日龄增长,饱和脂肪酸(SFA)含量呈下降趋势;而单不饱和脂肪酸(MUFA)含量呈先上升后下降的变化趋势,140 d含量最高[(25.69±0.42)%];多不饱和脂肪酸(PUFA)含量呈上升的变化趋势。肝胰腺中SFA含量在 3个生长时期内无显著性差异(>0.05),MUFA含量呈先上升后下降的变化趋势,140 d含量最高[(37.44±0.59)%],而PUFA含量变化与MUFA正好相反。营养价值评估结果显示,180 d (可上市销售)的红螯螯虾肌肉内必需氨基酸指数(49.96%)高于联合国粮农组织/世界卫生组织(FAO/WHO)评分模式(31.50%)和全鸡蛋蛋白质模式(43.10%),是较为理想的优质食物蛋白源。由上可知,在不同生长时期,肌肉和肝胰腺中的氨基酸、脂肪酸的主要消耗不同,研究结果对了解不同生长时期红螯螯虾营养需求、开发红螯螯虾配合饲料提供了参考依据。
红螯螯虾;生长时期;肌肉;肝胰腺;氨基酸;脂肪酸
红螯螯虾()又名“澳洲淡水龙虾”,属软甲纲(Malacostraca)、十足目(Decapoda)、拟螯虾科(Parastacidae)、滑螯虾属(),原产于澳大利亚,外形与克氏原螯虾()相似(石义元, 2004),是世界名贵淡水经济虾种之一(吴志新等, 2000)。红螯螯虾营养丰富、出肉率高、耐长途运输、市场需求广泛,是具有较高市场潜力的养殖品种之一(李进, 2009)。随着红螯螯虾人工育苗和养殖技术的突破,营养需求不明确和专用配合饲料缺乏成为红螯螯虾养殖业可持续发展的限制性因素(郭占林, 2010)。红螯螯虾的生长发育除了受到光照、盐度和水温等环境因素的影响(吴志新, 1997; 李彤等, 1998; 张彦娇, 2010),还与体内脂类和蛋白质组成密切相关(王友慧等, 2004)。随着虾类的生长发育,其组织中氨基酸和脂肪酸的含量会有所不同(姚翠鸾等, 2001)。日本对虾()从卵发育到幼虾的过程中,体内游离氨基酸含量逐渐上升(Marangos, 1990)。斑节对虾()随着虾体长大,其肌肉内甘氨酸、精氨酸的含量呈下降趋势,而脯氨酸含量逐渐上升(梁亚全等, 1995)。克氏原螯虾幼虾肌肉内二十二碳五稀酸(EPA)和二十二碳六烯酸(DHA)的含量显著高于中虾和成虾(封功能等, 2011)。肌肉和肝胰腺作为虾类的主要食用部位,氨基酸和脂肪酸的不同可能导致其在营养和口感上的差异(Chen, 2010)。同时,肝胰腺作为虾蟹类储存脂肪和提供能量的主要器官(靳立兵等, 2013),研究其不同生长时期氨基酸与脂肪酸组成,对了解红螯螯虾营养消耗具有重要意义。
迄今为止,有关虾蟹类体内氨基酸和脂肪酸的研究日益增多,如中华绒螯蟹()生长发育过程中氨基酸的需求分析(江洪波, 2003)、黑斑口虾蛄()不同发育时期脂类和脂肪酸组成分析(王春琳等, 2007)、日本沼虾()和蓝蟹()胚胎发育过程中脂肪酸组成变化等(李红等, 2003; 李树国等, 2011),但有关红螯螯虾不同发育阶段脂肪酸和氨基酸组成分析的研究尚未见报道。因此,本研究对3个生长时期的红螯螯虾肌肉和肝胰腺内脂肪酸和氨基酸组成进行对比分析,探究不同生长阶段红螯螯虾肌肉和肝胰腺内脂肪酸和氨基酸的变化规律,旨在更好地了解红螯螯虾生长的促进和限制因素,为其专用配合饲料的研发提供参考。
1 材料与方法
1.1 实验材料
本研究所用红螯螯虾取自浙江省海宁市鸿海养殖有限公司孵化的同一批幼虾,分别养殖于3个土塘中,每个池塘均为2000 m2,水深为1 m,养殖密度均约为5000尾/667 m2,3个池塘养殖管理方式、环境条件保持一致,养殖过程中均投喂江苏省天邦全熟化虾饲料。
1.2 实验设计
随机挑选90 d (第二性征未发育) (18.34± 0.17) g、140 d (第二性征发育成熟)[(35.76±1.56) g]、180 d (性腺完全成熟)[(54.28±2.55) g] 3个时期的红螯螯虾各30只,其中,每个时期、每个池塘各取 10只,所取红螯螯虾体表无伤、无病害。每尾个体冰冻后取肌肉和肝胰腺组织,置于2 mL离心管液氮速冻后保存于–80℃冰箱,用于后续脂肪酸和氨基酸的测定。
1.3 指标测定及方法
1.3.1 脂肪酸及氨基酸的测定 使用冷冻干燥机(浙江省宁波市双嘉仪器有限公司,SJIA-10N/12N/18N) –60℃干燥48 h,将干燥后的样品用研磨机(北京瑞百利商贸有限公司,SG-350C)打磨成均匀的粉质,保存备用。
根据GB 5009.168-2016《食品中脂肪酸的测定》标准,利用气相色谱分析仪(Agilent 6890, 美国),采用气相色谱分析法测定肌肉和肝胰腺的脂肪酸含量。根据GB 5009.124-2016《食品中氨基酸的测定》的标准,利用Biochrom 30氨基酸自动分析仪(英国),采用酶水解法进行氨基酸测定。在水解过程中,色氨酸和胱氨酸被破坏,因此,未对二者进行测定分析。
1.3.2 氨基酸营养评定 将红螯螯虾肌肉中氨基酸含量单位换算为g/mg,基于FAO/WHO建议的氨基酸标准模式和鸡蛋蛋白质的氨基酸标准模式进行测评,测得氨基酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI)。计算公式如下(张昌吉等, 2006):
AAS=试样样品中氨基酸含量/(FAO/WHO评分标准模式中同种氨基酸含量);
CS=试样样品中氨基酸含量/鸡蛋蛋白质中同种含量;

式中,为比较的必需氨基酸数量,、…、为红螯螯虾肌肉中必需氨基酸含量(mg/g prot);AE、BE、…、JE为全鸡蛋蛋白质中同种氨基酸含量(mg/g prot)。
1.4 数据分析
所得脂肪酸数据为相对含量,氨基酸数据为绝对含量,结果以Mean±SD表示,采用SPSS 19.0进行单因素方差(one-way ANOVA)分析,显著性水平<0.05。
2 结果
2.1 红螯螯虾不同生长时期肌肉和肝胰腺内氨基酸的变化
由表1可知,除色氨酸和胱氨酸在样品水解过程中被破坏,红螯螯虾肌肉中共检测到16种氨基酸,包含人体所需的7种必需氨基酸、2种半必需氨基酸及7种非必需氨基酸。其中,谷氨酸占总氨基酸含量最高,且在3个时期内差异显著(<0.05),在90 d时含量最高,为(14.14±0.14)%。而脯氨酸含量在180 d时为(3.00±0.10)%,显著高于90 d和140 d。赖氨酸、缬氨酸、苯丙氨酸和精氨酸含量在90 d时显著高于其他2个时期(<0.05),与必需氨基酸总量变化趋势一致,而非必需氨基酸含量在3个生长时期内没有显著差异(>0.05)。鲜味氨基酸含量在3个时期内差异显著(<0.05),呈先上升后下降的变化趋势,在140 d时含量最高,为(38.01±0.32)%。
由表2可知,红螯螯虾肝胰腺中检测到16种氨基酸,总氨基酸含量较低(17.07%~24.06%),与肌肉氨基酸含量相比,仅占1/4,表明肝胰腺中蛋白质含量较少。其中,必需氨基酸、非必需氨基酸和鲜味氨基酸含量在3个生长时期具有显著性差异(<0.05),且均呈下降的变化趋势。蛋氨酸、甘氨酸和丙氨酸在3个不同时期无显著性差异(>0.05),除此之外,其他氨基酸含量均与总氨基酸变化趋势一致。

表1 不同生长时期的红螯螯虾肌肉氨基酸的变化

表2 不同生长时期的红螯螯虾肝胰腺氨基酸的变化
2.2 红螯螯虾不同生长时期肌肉和肝胰腺内脂肪酸的变化
由表3可知,不同生长时期红螯螯虾肌肉中脂肪酸组成一致,均检测到15种脂肪酸组分,起始碳链长度在18~22碳之间,以中长链为主。其中,包括7种饱和脂肪酸(SFA),占总脂肪酸含量的36.78%~39.69%,C16:0含量最高(16.22%~16.78%);3种单不饱和脂肪酸(MUFA),占总脂肪酸含量的23.78%~25.69%,其中C18:1n9c含量最高(21.32~22.86%);5种多不饱和脂肪酸(PUFA),占总脂肪酸含量的35.29%~39.42%,包含亚油酸(C18:2n6c)、亚麻酸(C18:3n3)、花生五烯酸(C20:5n3)和二十二碳六烯酸(C22:6n3) 4种必需脂肪酸,其中,C18:2n6c含量最高(16.15%~22.18%)。

表3 不同生长时期的红螯螯虾肌肉脂肪酸的变化(%,总脂肪酸)
在90~180 d的生长过程中,SFA含量呈下降的变化趋势,90 d时含量最高[(39.69±0.86)%],其中,SFA中只有C15:0、C17:0和C20:0在3个时期内有显著性差异(<0.05),且变化趋势与SFA保持一致。MUFA含量在3个生长时期有显著性差异(<0.05),呈先上升后下降的变化趋势,在140 d时含量最高[(25.69±0.42)%]。PUFA含量在3个生长时期同样具有显著性差异(<0.05),呈上升的变化趋势,在180 d时含量最高[(39.42±1.16)%[,与C18:2n6c变化趋势一致,而C20:5n3则呈先上升后下降的变化趋势,在140 d时含量最高[(14.27±0.73)%]。
由表4可知,不同生长时期红螯螯虾肝胰腺内脂肪酸组成一致,共检测到27种脂肪酸,碳链长度在12~24碳之间,包括了10种SFA,占总脂肪酸含量的28.03~29.39%,其中C16:0含量最高(19.20%~20.32%)。7种MUFA,占总脂肪酸含量的29.48%~37.44%,其中C18:1n9c含量最高(28.96%~33.54%)。10种PUFA,占总脂肪酸含量的35.64%~42.44%,其中C18:3n3含量最高(3.80%~5.21%)。
SFA含量在3个不同时期无显著性差异(>0.05),单一饱和脂肪酸含量与SFA含量变化趋势保持一致,表明在不同生长时期,SFA含量趋于稳定。MUFA含量呈先上升后下降的变化趋势,在140 d时含量最高[(37.44±0.59)%],主要体现在C18:1n9c含量的变化。而PUFA与MUFA变化趋势完全相反,呈先下降后上升的变化趋势,在90 d时含量最高(42.44±0.77)%,其中以C18:3n3和EPA变化为主。
表4 不同生长时期的红螯螯虾肝胰腺脂肪酸的变化

2.3 营养价值评定结果
由表5可见,通过分析180 d的红螯螯虾肌肉中的氨基酸组成,可以发现第一限制性氨基酸为缬氨酸,第二限制性氨基酸为异亮氨酸,AAS介于0.76%~1.31%之间,CS介于0.58%~1.03%之间,必需氨基酸占总氨基酸的50%左右,显著高于FAO/WHO评分标准(31.50%)和全鸡蛋蛋白模式评分标准(43.10%) (Seligson, 1984)。
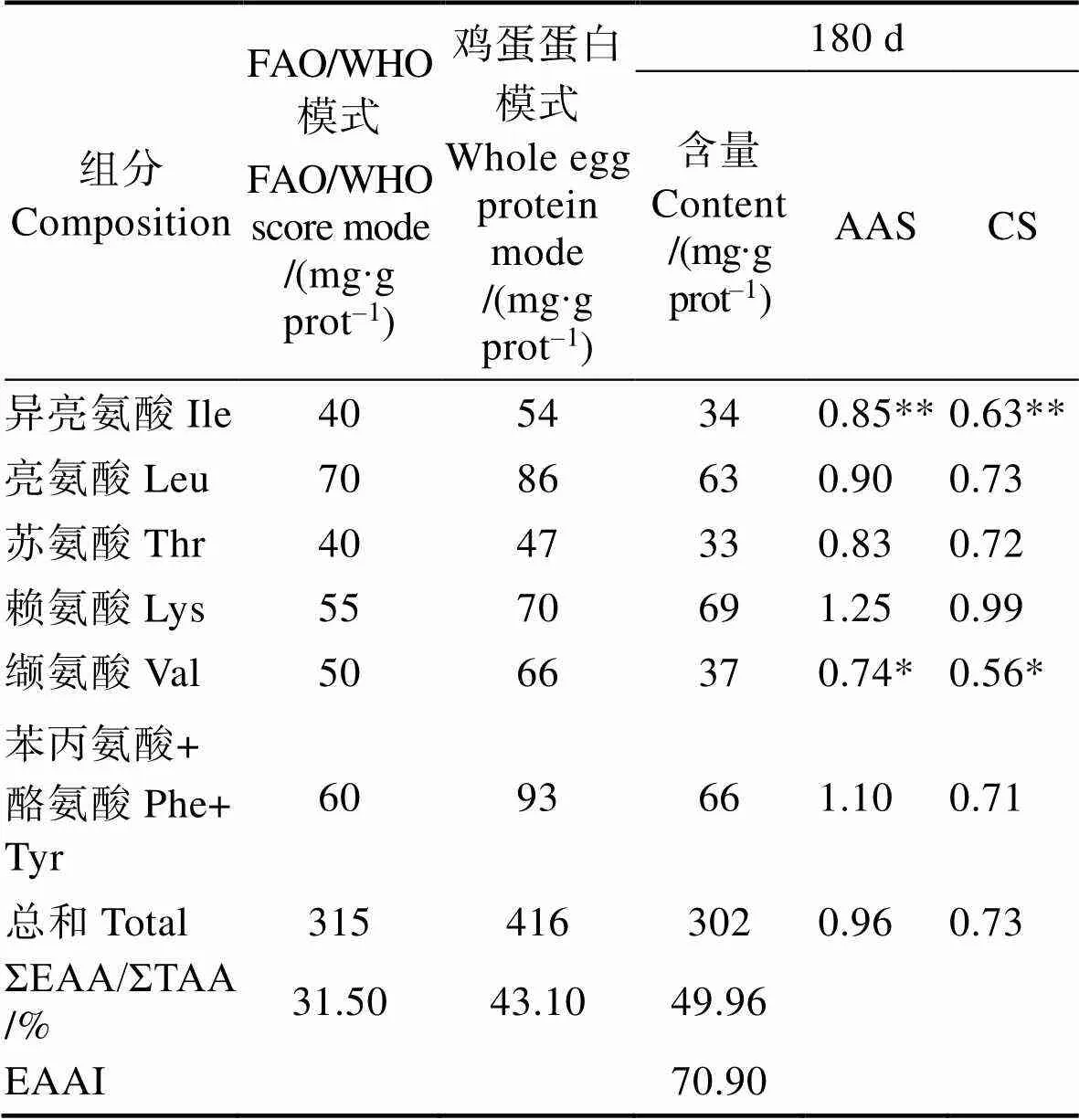
表5 180 d红螯螯虾肌肉中必需氨基酸的组成与评价
3 讨论
3.1 不同生长时期红螯螯虾肌肉和肝胰腺中氨基酸组成变化分析
蛋白质是构成生命体的物质基础,是机体细胞的重要组成部分,能够为生命活动提供能量(陈晴, 2014)。氨基酸作为蛋白质的基本单位,在调节生理机能和催化新陈代谢过程中发挥重要作用(刘峰等, 2018)。Coloso等(1980)和Shewbart等(1972)研究发现,在缺乏亮氨酸、赖氨酸和缬氨酸等必需氨基酸时,斑节对虾蜕壳受阻、生长缓慢。因此,在生长发育过程中,需要添加外源性氨基酸来满足动物体自身对必需氨基酸的需求(黄凯等, 2003)。在本研究中,不同生长时期红螯螯虾肌肉中必需氨基酸含量具有显著性差异,呈下降趋势。此现象可能与Ghanawi等(2012)的研究结果一致,即在甲壳类动物的生长发育过程中,蛋白质主要用于性腺组织结构发育,且在蜕壳和性腺发育前期,机体会储存一定的营养物质,以保证生理活动的正常进行。由此可见,在140~180 d性腺发育成熟的过程中,红螯螯虾肌肉中亮氨酸等必需氨基酸消耗量逐渐增多。谷氨酸能够在谷氨酰胺合成酶的作用下与氨基酸代谢过程中产生的氨转化为谷氨酰胺(刘胜男等, 2015; 李少飞, 2014),谷氨酰胺反过来又能参与蛋白质代谢调控,提高动物的摄食率和生长速度(van Acker, 1999; 卢志杰等, 2019)。在本研究中,谷氨酸含量在90 d时显著高于其他2个时期,说明在性腺发育时期,氨基酸代谢增强,谷氨酸消耗随之增加,以此满足机体的正常代谢和生命活动。因此,140~180 d时,应在红螯螯虾饲料中补充蛋白质,为机体发育提供必需的氨基酸。
在生长发育过程中,甲壳类动物肝胰腺中的蛋白质和氨基酸除了能维持组织正常的生理活动,还能促进机体性腺发育(李旭骁等, 2015a)。因此,本研究中,3个不同时期肝胰腺中氨基酸含量逐渐降低,可能参与了性腺的发育,且肝胰腺中氨基酸变化较为保守,单一氨基酸含量占总氨基酸比例的变化不大,变化趋势与总氨基酸含量保持一致,猜测氨基酸等比例参与了这一生理过程。李旭骁等(2015b)在中华绒螯蟹的研究中发现,外源性添加蛋白质和氨基酸还能够促进亲体交配,提高抱卵率和幼蟹成活率。因此,在红螯螯虾不同时期的生长过程中,可以适当添加蛋白质,以保证各项生理功能的正常进行。
3.2 不同生长时期红螯螯虾肌肉和肝胰腺中脂肪酸组成变化分析
脂肪酸对动物体具有重要的生理功能,其中,PUFA能够调节脂质代谢、促进生长发育、提高幼体的成活率(蔡双莲等, 2003; 贡艺等, 2018)。此外,肌肉中的脂肪酸能够提高肌肉的口感和风味(蒋克勇, 2012)。本研究表明,红螯螯虾肌肉中含有C18:3n3、C18:2n6c、C20:5n3和C22:6n3等必需脂肪酸,能够满足人体对PUFA的需求,促进体内饱和脂肪酸的代谢、降低心血管疾病的发病率并减少肥胖病的产生(周晶晶等, 2019)。PUFA还是甲壳类动物蜕壳期间新膜构建的主要物质,在本研究中,90 d时肌肉内PUFA的含量显著低于其他2个时期,可能是由于甲壳类动物的生长和发育存在拮抗关系,在性腺发育和胚胎发育时期,蜕壳频率会有所下降。因此,140和180 d时,对PUFA的消耗减少(Assaf, 1997)。在红螯螯虾不断生长的过程中,机体物质消耗不断增多,由于肌肉中纤维组织较多,而脂肪组织较少,SFA在90~180 d里含量逐渐降低,猜测其仅作为肌肉的正常代谢被消耗,与刘穗华等(2010)在不同亚麻酸/亚油酸对凡纳滨对虾()幼虾生长性能和脂肪酸组成的研究中结果一致。
脂质在甲壳类动物性成熟过程中发挥着重要作用(Lautier, 1988),而肝胰腺作为红螯螯虾储存和加工脂质的主要器官,还有向其他组织提供营养物质的功能,由于性腺内合成脂质的速度有限,大部分脂类来自于肝胰腺(Robert, 1989)。因此,与肌肉相比,肝胰腺内脂肪酸种类较多。C18:1是肝胰腺内含量最高的脂肪酸,郭占林(2010)在红螯螯虾幼虾脂质营养的研究表明,C18:1能够促进脂肪酸链延长酶从头合成长链不饱和脂肪酸,进而提高代谢和生长速度。鉴于生长蜕壳和性腺发育存在拮抗关系,本研究中,在140 d时,C18:1含量最高,由此推测C18:1在性腺发育时期可能不作为主要的能源物质被利用。应雪萍等(2004)在中华绒螯蟹的研究中发现,C18:3n3和C18:2n6c能够影响其生长和蜕壳,且与出苗率和成活率有关,C18:2n6c还参与了细胞膜的构建。因此,红螯螯虾肝胰腺内高含量的C18:3n3和C18:2n6c能够较为稳定地为生长发育提供物质基础。由此可知,在140和180 d时,适当增加EPA、C18:3n3和C18:2n6c的含量,能够更好地促进红螯螯虾性腺的发育。
3.3 红螯螯虾肌肉营养价值评定
肌肉作为红螯螯虾主要的食用部位,其鲜味和风味主要取决于氨基酸和脂肪酸的种类和含量(吴志新等, 1995)。红螯螯虾一般在体重达90 g,养殖5个月左右时上市销售(张占魁等, 2014),因此,本研究选取180 d时的红螯螯虾,即具有商业价值的成虾,对其肌肉中氨基酸进行氨基酸评价。结果显示,红螯螯虾肌肉中必需氨基酸指数为70.90%,远远高于克氏原螯虾(56.36%)和南美白对虾() (47.79%)(易瑞恺等, 2013)。肌肉中鲜味氨基酸含量高达45%以上,能够显著提高肌肉的鲜味。在肉类加工制作过程中,由于不饱和脂肪酸易被氧化,其含量能影响肉质的风味(韦克林等, 2012)。红螯螯虾肌肉中不饱和脂肪酸含量高达60%以上,且富含人体所需的亚油酸(C18:2n6c),能够降低人体心血管病的发生。由此可见,红螯螯虾肌肉是一种营养价值较高且味道鲜美的食物蛋白源。
4 小结
在不同生长时期,红螯螯虾肌肉和肝胰腺中脂肪酸、氨基酸含量发生了显著变化,表明不同时期肌肉和肝胰腺对氨基酸和脂肪酸的利用程度不同。研究结果为了解红螯螯虾不同时期营养物质的消耗和需求提供了基础资料,对更好地进行红螯螯虾健康养殖具有指导作用。
ASSAF B, TAL L, GIDEON H. Annual cycle of spawning and molting in the red-claw crayfish,, under laboratory conditions. Aquaculture, 1997, 157(3/4): 239–249
CAI S L, LI M. Advances in polyunsaturated fatty acids. Life Science Research, 2003, 7(4): 289–292 [蔡双莲, 李敏. 多不饱和脂肪酸的研究进展. 生命科学研究, 2003, 7(4): 289–292]
CHEN G, XIONG Y L, NEWMAN M C,. Effect of vacuum packaging on the quality of red claw crayfish,, tail muscle during frozen storage. Journal of the World Aquaculture Society, 2010, 41(3): 358–368
CHEN Q. Application of phosphomolybdate in protein separation and purification. Master′s Thesis of Northeastern University, 2014 [陈晴. 磷钼氧酸盐在蛋白质分离纯化中的应用研究. 东北大学硕士研究生学位论文, 2014]
COLOSO R M, CRUZ L J. Preliminary studies in some aspects of amino acid biosynthesis in juveniles of: I. Incorporation of14C from (U-14C) acetate into amino acids to precipitable proteins. Bulletin of the Philippine Biochemistry Society, 1980, 3(1/2): 12–22
FENG G N, WANG A M, SHAO R,. Analysis and evaluation of nutritional components ofat different growth stages. Jiangsu Agricultural Sciences, 2011, 39(4): 395–397 [封功能, 王爱民, 邵荣, 等. 克氏原螯虾不同生长阶段营养成分分析与评价. 江苏农业科学, 2011, 39(4): 395–397]
GHANAWI J, PATRICK S I. Molting, reproductive biology, and hatchery management of redclaw crayfish(von Martens 1868). Aquaculture, 2012, 358–359: 183–195
GONG Y, LI Y K, CHEN L,. A comparative analysis of fatty acid profiles in muscle offrom different harvest locations in the eastern Pacific Ocean. Progress in Fishery Sciences, 2018, 39(6): 149–156 [贡艺, 李云凯, 陈玲, 等. 东太平洋不同海区茎柔鱼肌肉脂肪酸组成分析与比较. 渔业科学进展, 2018, 39(6): 149–156]
GUO Z L. The study on lipid nutrition of juvenile and post-larval redclaw crayfish,. Master′s Thesis of East China Normal University, 2010 [郭占林. 红螯光壳螯虾()仔虾及幼虾脂质营养的研究. 华东师范大学硕士研究生学位论文, 2010]
HUANG K, WANG W, LI C H. Requirement of essential amino acids inJournal of Fisheries of China, 2003, 27(5): 456–461 [黄凯, 王武, 李春华. 南美白对虾必需氨基酸的需要量. 水产学报, 2003, 27(5): 456–461]
JIANG H B. Protein nutrition of Chinese mitten-handed crab,. Doctoral Dissertation of East China Normal University, 2003 [江洪波. 中华绒螯蟹蛋白质营养生理研究. 华东师范大学博士研究生学位论文, 2003]
JIANG K Y. Studies on improvement of meat quality and related candidate genes in aquatic animals. Doctoral Dissertation of Chinese Academy Sciences (Institute of Oceanology), 2012 [蒋克勇. 水产动物肉质风味改良技术及相关候选基因研究. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2012]
JIN L B, MU C K, SONG W W,. Analysis of the nutritional composition and the fatty acid composition in hepatopancreas during the soft shell hardening period of. Journal of Biology, 2013, 30(2): 23–27 [靳立兵, 母昌考, 宋微微, 等. 三疣梭子蟹软壳硬化阶段肝胰腺的营养成分及脂肪酸组成分析. 生物学杂志, 2013, 30(2): 23–27]
LAUTIER J, LAGARRIGUE J G. Lipid metabolism of the crabduring vitellogenesis. Biochemical Systematics and Ecology, 1988, 16(2): 203–212
LI H, ZHAO Y L, WANG Q,. Variations in biochemical composition during embryonic development ofJournal of Fisheries of China, 2003, 27(6): 545–549 [李红, 赵云龙, 王群, 等. 日本沼虾胚胎发育不同阶段主要生化成分的变化. 水产学报, 2003, 27(6): 545–549]
LI J. Studies on the effects of physical and chemical factors in water environment on the reproductive performance and larval development inMaster′s Thesis of Ocean University of China, 2009 [李进. 水环境理化因子对红螯螯虾繁殖性能和幼体发育的影响研究. 中国海洋大学硕士研究生学位论文, 2009]
LI S F. cDNA cloning and expression analysis of the enzyme genes related to ammonia metabolism inand study on effect of these enzymes in the detoxification of ammonia following ambient ammonia stresses. Master′s Thesis of Dalian Ocean University, 2014 [李少飞. 中国对虾氨氮代谢酶基因的cDNA克隆及其在氨氮解毒代谢过程中的作用. 大连海洋大学硕士研究生学位论文, 2014]
LI S G, CHENG Y X, ZHOU B,. Changes of main fatty acids and lipid classes in second ovarian development of spawning blue crab,. Journal of Fishery Sciences of China, 2011, 18(3): 194–201 [李树国, 成永旭, 周波, 等. 蓝蟹抱卵期间卵巢第二次发育过程中主要脂肪酸和脂类的变化. 中国水产科学, 2011, 18(3): 194–201]
LI T, JIAO W M, LI Y,. Effects of light and temperature on artificial cultivation of red crawfish (). Aquaculture of Tianjin, 1998(1): 32–35 [李彤, 焦万明, 李颖, 等. 光照与温度对红螯螯虾人工育苗的影响. 天津水产, 1998(1): 32–35]
LI X X, GONG Y S. Protein nutrition ofFood Safety Guide,2015a(29): 80 [李旭骁, 龚月生. 中华绒螯蟹蛋白质营养. 食品安全导刊, 2015a(29): 80]
LI X X, GONG Y S. Analysis of nutrition demand ofAnimals Breeding and Feed,2015b(11): 42–44 [李旭骁, 龚月生. 中华绒鳌蟹养殖营养需求分析. 养殖与饲料, 2015b(11): 42–44]
LIANG Y Q, SUN M, HAN A S,. Amino acid analysis of the protein ofMarine Sciences, 1995(3): 27–30 [梁亚全, 孙谧, 韩阿寿, 等. 斑节对虾()蛋白质的氨基酸分析. 海洋科学, 1995(3): 27–30]
LIU F, LÜ X K, LIU Y Y,. Effect of starvation on amino acids and fatty acids of juvenileProgress in Fishery Sciences,2018, 39(5): 58–65 [刘峰, 吕小康, 刘阳阳, 等. 饥饿对大黄鱼幼鱼肌肉中氨基酸和脂肪酸组成的影响. 渔业科学进展, 2018, 39(5): 58–65]
LIU S H, CAO J M, HUANG Y H,Effects of different linolenic acid/linoleic acid ratios on growth performance and fatty acid composition of juvenile. Chinese Journal of Animal Nutrition, 2010, 22(5): 1413–1421 [刘穗华, 曹俊明, 黄燕华, 等. 饲料中不同亚麻酸/亚油酸比对凡纳滨对虾幼虾生长性能和脂肪酸组成的影响. 动物营养学报, 2010, 22(5): 1413–1421]
LIU S N, PAN L Q, LIU M Q. Effects of ammonia exposure on key detoxification metabolism associated genes expression in swimming crabTransactions of Oceanology and Limnology,2015(2): 99–106 [刘胜男, 潘鲁青, 刘茂琪. 氨氮胁迫对三疣梭子蟹解毒代谢关键基因表达的影响. 海洋湖沼通报, 2015(2): 99–106]
LU Z J, YE C K, SARATH B V,Cloning and expression of glutamine synthetase from giant freshwater prawn (). Journal of Fisheries of China, 2019, 43(3): 3–16 [卢志杰, 叶成凯, SARATH B V, 等. 罗氏沼虾谷氨酰胺合成酶基因的克隆与表达. 水产学报, 2019, 43(3): 3–16]
MARANGOS C, ARAUJO B A C, CECCALDI H J. Variation in the level of free amino acids during larva development of(Crustacea, Decapoda, Penaeidae). Archives Internationales de Physiologie et de Biochimie, 1990, 98(1): 41–51
ROBERT C R, ROBERT R S. Effects of purified dietary fatty acids on the fatty acid composition of freshwater shrimp,. Aquaculture, 1989, 77(2/3): 157–174
SELIGSON F H, MACKEY L N. Variable predictions of protein quality by chemical score due to amino acid analysis and reference pattern. Journal of Nutrition, 1984, 114(4): 682–691
SHEWBART K L, MIES W L, LUDWIG P D. Identification and quantitative analysis of the amino acids present in protein of the brown shrimp. Marine Biology, 1972, 16(1): 64–67
SHI Y Y. The brief description of red crawfish (). Fishery Guide to be Rich, 2004(23): 38–40 [石义元. 红螯螯虾简述. 渔业致富指南, 2004(23): 38–40]
VAN ACKER B A, VON MEYENFELDT M F, SOETERS P B. Glutamine as a key ingredient in protein metabolism. Nederlands Tijdschrift Voor Geneeskunde, 1999, 143(38): 1904–1908
WANG C L, YIN F, SONG W W. Analysis of lipid and fatty acid composition during embryonic and larval development of. Journal of Zhejiang University (Science Edition), 2007, 34(2): 223–227 [王春琳, 尹飞, 宋微微. 黑斑口虾蛄胚胎和幼体不同发育时期脂类及脂肪酸组成分析. 浙江大学学报(理学版), 2007, 34(2): 223–227]
WANG Y H, YE J Y. Current status and prospects of nutritional research on red crawfish. Feed Research, 2004(7): 38–41 [王友慧, 叶金云. 红螯螯虾营养研究现状及展望. 饲料研究, 2004(7): 38–41]
WEI K L, HU T L, LI K. Research progress on the relationship between intramuscular fat, fatty acid and pork meat quality. Chinese Abstracts of Animal Husbandry and Veterinary Medicine, 2012(11): 50–51 [韦克林, 胡天龙, 李坤. 肌内脂肪、脂肪酸与猪肉肉质三者关系研究进展. 中国畜牧兽医文摘, 2012(11): 50–51]
WU Z X, CHEN X X, LIU X L,. Effects of different photoperiods on the reproduction and growth of red crawfish (). Freshwater Fisheries, 2000, 30(3): 4–5 [吴志新, 陈孝煊, 刘小玲, 等. 不同光周期对红螯螯虾繁殖及生长的影响. 淡水渔业, 2000, 30(3): 4–5]
WU Z X, ZHAO G Z. Analysis of nutrient compositions fors. Journal of Hubei Agricultural Sciences, 1995(4): 59–62 [吴志新, 赵桂珍. 澳大利亚红螯螯虾营养成分分析. 湖北农业科学, 1995(4): 59–62]
WU Z X. Study on tolerance of red crawfish () to salinity. Journal of Hydroecology, 1997(4): 20–21 [吴志新. 红螯螯虾对盐度耐受性的研究. 水生态学杂志, 1997(4): 20–21]
YAO C L, WANG W N, WANG A L. Advances in research on nutritional requirements of shrimp amino acids. Feed Research, 2001, 1(1): 15–16 [姚翠鸾, 王维娜, 王安利. 虾类氨基酸营养需求的研究进展. 饲料研究, 2001, 1(1): 15–16]
YI R K, HU H G, WANG S H,. Analysis and estimate on nutritional components in muscle ofin Poyang Lake. Journal of Nanchang University (Science Edition), 2013, 37(3): 255–258, 276 [易瑞恺, 胡火庚, 王尚洪, 等. 鄱阳湖克氏原螯虾肌肉营养成分分析与评价. 南昌大学学报(理科版), 2013, 37(3): 255–258, 276]
YING X P, ZHANG Y P, YANG W X. Comparative study on fatty acid composition of hepatopancreas ofmature crab, egg crab, abortion crab. Oceanologia et Limnologia Sinica, 2004, 35(2): 141–148 [应雪萍, 张永普, 杨万喜. 中华绒螯蟹()成熟蟹、抱卵蟹、流产蟹肝胰腺脂肪酸组成的比较研究. 海洋与湖沼, 2004, 35(2): 141–148]
ZHANG C J, LIU Z, WANG S Y. Muscle percentage in rainbow trout and analysis on the nutritional composition of the muscle. Reservoir Fisheries, 2006, 26(4): 83–85 [张昌吉, 刘哲, 王世银. 虹鳟含肉率及肌肉营养成分分析. 水利渔业, 2006, 26(4): 83–85]
ZHANG Y J. Effect of salinity, temperature on the non-specific immunity of turbot (L) and study on some immune related genes in crayfish (). Doctoral Dissertation of Ocean University of China, 2010 [张彦娇. 盐度和温度对大菱鲆非特异性免疫力的影响及淡水螯虾相关免疫因子的研究. 中国海洋大学博士研究生学位论文, 2010]
ZHANG Z K, GONG L J. Cultivation technology of red crawfish in alpine region. Scientific Fish Farming, 2014(5): 32 [张占魁, 巩伦江. 高寒地区红螯螯虾当年养成技术. 科学养鱼, 2014(5): 32]
ZHOU J J, LI J S, WANG Q J. Advances in regulation of omega-3 polyunsaturated fatty acids on fat metabolism. Academic Journal of Second Military Medical University, 2019, 40(1): 76–81 [周晶晶, 李家速, 王奇金. Omega-3多不饱和脂肪酸对脂肪代谢调节作用研究进展. 第二军医大学学报, 2019, 40(1): 76–81]
Amino Acid and Fatty Acid Analyses in the Muscles and Hepatopancreas of Red Crayfish at Different Growth Stages
QIN Gaochan1, CHEN Honglin2①, CHU Tianqi1, QIAN Haojie3, LOU Bao2①
(1. School of Fishery, Zhejiang Ocean University, Zhoushan, Zhejiang 316022, China; 2. Institute of hydrobiology, Zhejiang Academy of Agricultural Sciences, Hangzhou, Zhejiang 310021, China; 3. Haining Honghai Breeding Co., Ltd., Jiaxing, Zhejiang 314400, China)
This study investigated changes in fatty acid and amino acid contents in the muscle and hepatopancreas of red crayfish () at different growth stages, i.e., before the second sex development (90 days), at maturation of second sex (140 days), and at gonadal maturity (180 days). Sixteen types of amino acids in the muscle were found, and the content of essential amino acids (EAAs) at 90 days was significantly higher than the other two periods (<0.05). However, the content of EAAs and non-essential amino acids in the hepatopancreas of crayfish decreased gradually. Among fatty acids, the saturated fatty acids (SFA) in the muscle showed a decreasing trend; the monounsaturated fatty acid (MUFA) content first increased and then decreased, reaching peak content of (25.69±0.42%)% at 140 days, whereas the polyunsaturated fatty acid (PUFA) content increased from 90 to 180 days. Furthermore, the SFA content in the hepatopancreas showed no significant difference among the three growth periods (>0.05); the MUFA content first increased and then decreased, peaking (37.44±0.59)% at 140 days, while the PUFA content showed the opposite trend. Moreover, the evaluation of nutritional value revealed that the EAA index (49.96%) of the muscle of 180-day-old (marketable) red crayfish was higher than the FAO/WHO score model (31.50%) and the whole egg protein model (43.10%), which is considered an ideal source of high-quality protein. In conclusion, the consumption of amino acids and fatty acids in the muscle and hepatopancreas is different. These results provide a theoretical reference for understanding the nutritional requirements of red crawfish at different stages of growth and development.
Red crawfish; Different growth stages; Muscle; Hepatopancreas; Amino acid; Fatty acid
LOU Bao, E-mail: loubao6577@163.com; CHEN Honglin, E-mail: shmilyweight@126.com
S963
A
2095-9869(2021)06-0084-09
10.19663/j.issn2095-9869.20200602001
http://www.yykxjz.cn/
秦高婵, 陈红林, 储天琪, 钱豪杰, 楼宝. 不同生长时期红螯螯虾肌肉和肝胰腺内氨基酸和脂肪酸变化分析. 渔业科学进展, 2021, 42(6): 84–92
QIN G C, CHEN H L, CHU T Q, QIAN H J, LOU B. Amino acid and fatty acid analyses in muscles and hepatopancreas of red crayfish at different growth stages. Progress in Fishery Sciences, 2021, 42(6): 84–92
楼 宝,研究员,E-mail: loubao6577@163.com;陈红林,E-mail: shmilyweight@126.com
2020-06-02,
2020-06-29
*浙江省农业科学院水产学科建设项目(SSS2020005)资助[This work was supported by the Aquaculture Construction Project of Zhejiang Academy of Agricultural Sciences (SSS2020005)]. 秦高婵,E-mail: 27459432861@qq.com
(编辑 陈 辉)
