OPN5对鸭颗粒细胞凋亡、增殖及类固醇激素生成的影响
2021-12-31刘付穗潘建秋江丹莉许丹宁田允波黄运茂
刘付穗,潘建秋,江丹莉,沈 栩,许丹宁,田允波*,黄运茂*
(1.仲恺农业工程学院,广州 510225;2.广东省水禽健康养殖重点实验室,广州 510225)
OPN5是2003年首次在哺乳动物神经组织中被发现的一种新型G蛋白偶联受体(G protein-coupled receptors,GPCRs)[1-2],主要在视网膜、下丘脑室旁器(paraventricular organ,PVO)和性腺中表达[3-4]。OPN5是鸟类主要的深脑光感受器(deep-brain photoreceptors,DBPs)之一[2],参与调控鸟类的繁殖功能[5]。目前发现的DBPs主要有3种,包括黑视蛋白(melanopsin,OPN4)、神经视蛋白(OPN5)、脊椎古视蛋白(vertebra ancient opsin,VAOpn)[6-7]。OPN5是一种对短波长敏感的光色素,吸收波长为360~474 nm,被认为可感受紫外光的丝氨酸蛋白酶,能够介导光信号传导[3]。研究表明,OPN5可通过下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis,HPGA)作用调控鸟类繁殖,其中TSH通路发挥着重要介导作用[8-9]。在长日照繁殖型的扬州鹅中,当OPN5表达升高,鹅产蛋率上升[8];在非季节性繁殖动物中,当OPN5表达量上升,原鸡的睾丸重量升高[2]。目前对OPN5调控繁殖的研究主要集中在下丘脑-垂体层面,而关于OPN5在性腺层面直接调控禽(鸟)类卵泡发育的研究鲜有报道。在鸟类卵泡发育过程中,颗粒细胞发挥重要作用[10],颗粒细胞的凋亡和增殖直接决定卵泡的发育及成熟[11-14]。研究表明,Caspase和BC1两大基因家族对细胞凋亡有着重要影响,包括凋亡基因Bax、BAK1、Caspase3及凋亡抑制基因BCl2、BCl6等[12-13],细胞周期蛋白CyclinD1、CDC20、CDK1等则对细胞增殖发挥重要调节作用[14]。在卵泡发育过程中,垂体FSH和LH通过与其颗粒细胞上的受体FHSR和LHR结合,激活类固醇激素生成通路,生成雌二醇和孕酮等类固醇激素,进而影响卵泡发育、成熟及排卵[10]。也有研究表明,颗粒细胞表达GnRH、GnIH及其受体GnRHR、GnIHR,提示GnRH和GnIH能直接对性腺发挥调控作用[15-16]。本课题组前期研究表明,繁殖期颗粒细胞表达高水平OPN5,但对颗粒细胞的增殖、凋亡和类固醇激素生成有何影响尚不清楚。
本试验通过在体外培养的鸭颗粒细胞中过表达或干扰OPN5,从正反两面来研究OPN5对颗粒细胞增殖、凋亡及类固醇激素生成的影响,以期揭示OPN5通过颗粒细胞对卵泡发育的调控机制。
1 材料与方法
1.1 试验设计及材料
本试验所用颗粒细胞为180日龄健康山麻鸭等级卵泡颗粒层分离所得。分离鸭颗粒细胞进行原代培养,待细胞汇合度达70%,分别进行OPN5过表达和干扰试验,均用Lipofectamine 3000试剂(Life Technologies)进行脂质体转染(n=6)。在OPN5过表达试验中,过表达组(pEGFP-OPN5组)转染浓度为1 μg·孔-1pEGFP-OPN5(1.1 kb)重组过表达质粒,空载体组(pcDNA3.1组)转染浓度为1 μg·孔-1pcDNA3.1(6.1 kb)空载体,空白对照组(NC组)仅添加转染试剂Lipofectamine3000+P3000。在OPN5干扰试验中,干扰组(siRNA-OPN5组)转染5 μL浓度为20 μmoL·L-1的siRNA -OPN5,干扰对照组(siRNA组)转染5 μL浓度为20 μmoL·L-1siRNA,空白对照组(NC组)仅添加等量的转染试剂Lipofectamine3000。处理72 h后,检测并比较过表达和干扰OPN5表达对颗粒细胞凋亡、增殖、相关基因表达和蛋白表达以及细胞生殖激素水平的影响。
1.2 主要试剂与仪器
主要试剂:PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒购于TaKaRa;PowerUPTMSYBRTMGreen Master Mix购于Applied Biosystems;Annexin V-FITC细胞凋亡检测试剂盒购于Beyotime;EdU细胞增殖检测(成相检测)购于RIBOBIO;anti-OPN5 rabbit购于BBI Life Sciences;Anti-GAPDH antibody ab181602、Anti-Aromatase antibody ab18995购于Abcam;3β-HSD antibody、FITC-goat anti-rabbit IgG购于Affinity Biosciences;Lipofectamine 3000购于Life Technologies;Omega-EndoFree Plasmid Mini KitⅡ购于Omega;Duck E2 ELISA KIT购于CUSABIO;Duck P4/Human INHBELISA KIT购于Elabscience;pEGFP-OPN5(根据XM_021267766.3序列合成质粒)由华大基因科技有限公司合成;pcDNA3.1(货号:VT9013)购于优宝生物;siRNA-OPN5(根据XM_021267766.3序列设计的siRNA,其中sense:GCAUCAGAUCACAACG-CUUTT;antisense:AAGCGUUGUGAUCUGAU-GCTT)和siRNA -NC(sense:UUCUCCGAACGUGUCACGUTT;antisense:ACGUGACACGUUC-GGAGAATT)由上海生工生物工程股份有限公司合成。
主要仪器:全波长酶标仪Multiskan GO购于Thermo;恒温CO2培养箱购于Thermo;QuantStudio 7 Flex型实时荧光定量仪购于Applied Biosystems;倒置荧光显微镜购于Olympus;Tanon 5200化学发光成像仪购于上海天能生物科技有限公司。
1.3 试验方法
1.3.1 鸭颗粒细胞的分离与培养 选取50只180日龄、体重1.5~2 kg健康山麻鸭蛋鸭,按动物福利原则处死后,采集等级卵泡F1、F2放入装有2%双抗的PBS烧杯中,分离颗粒层放入15 mL离心管;颗粒细胞加入5 mL培养基(无血清),用巴氏吸管反复吹打1 min,500~600 r·min-1离心2~3 min,向离心管内加入5 mL 0.2%Ⅱ型胶原酶,重悬沉淀,置于37 ℃恒温水浴锅中消化15~20 min,每5 min震荡1次。消化结束,加入5 mL M199完全培养基(含10%血清)终止消化,随后用70 μm细胞筛过滤,收集滤液,1 000 r·min-1离心5 min。M199洗涤沉淀1次,室温1 000 r·min-1离心5 min;弃上清后加2~3 mL培养液吹打、重悬,每孔接5×105个细胞于12孔细胞培养板,置于39 ℃、5% CO2细胞培养箱中静置培养。待细胞汇合度达70%,开始试验处理。
1.3.2 细胞凋亡与增殖水平的检测 试验采用Annexin V-FITC细胞凋亡检测试剂盒与Annexin V-APC/7AAD Apoptosis Detection Kit试剂盒对颗粒细胞的凋亡进行检测。采用试剂盒Cell-LightTMEdU Apollo 488 In Vitro Kit对颗粒细胞进行细胞增殖检测。具体操作按照使用说明书进行,对每个处理组进行6次重复,使用3张图片计算凋亡与增殖细胞比例。
1.3.3 细胞培养液中生殖激素测定 细胞培养液中雌激素、孕酮与抑制素β的测定方法按照ELISA试剂盒说明书进行操作。
1.3.4 基因表达水平检测 采用TRIzol传统方法提取组织RNA,并用TaKaRa反转录试剂盒反转录RNA得到cDNA,采用实时定量PCR (real-time quantitative polymerase chain reaction,qRT-PCR)定量测定颗粒细胞中OPN5、TSHβ、FSHR、LHR、GnRHR、GnIHR、GnRH、GnIH、StAR、CYP11A1、3β-HSD、CYP17A1、CYP19A1、Bax、BCl2、BCl6、BAK1、Caspase3、CDC20、CDK1、CyclinD1的mRNA表达水平。根据NCBI上参考序列,利用 Primer 5.0设计以上基因的荧光定量引物和内参β-actin基因引物(表1),送由上海生工生物工程股份有限公司合成。以cDNA为模板,配制10 μL反应体系:Master Mix 5 μL,上、下游引物各0.1 μL,ddH2O 3.8 μL,cDNA模板1 μL。反应条件设定:50 ℃预变性2 min,95 ℃ 10 min,1个循环;95 ℃ 15 s,退火温度退火 1 min,40个循环。每个样品3个 重复,用β-actin作为内参基因进行校正。结果采用相对模板量算法(ΔΔCt法)处理,基因相对表达量用2-ΔΔCt表示。

表1 实时荧光定量PCR引物Table 1 Real-time fluorescence quantitative PCR primers
1.3.5 蛋白表达水平检测 提取颗粒细胞的总蛋白,用BCA测定总蛋白浓度,SDS变性后,将蛋白上样于10%的SDS-PAGE胶,电泳80 V 15 min,120 V 60 min。电泳结束后将蛋白转至PVDF膜200 mA 40 min,5%脱脂牛奶室温封闭1 h。一抗4 ℃孵育过夜,TBST洗5次,每次3 min。二抗室温孵育1 h,TBST洗5次,每次3 min。ECL试剂盒显色,将膜置于化学发光仪中进行曝光,拍照并保存。采用Image J软件对Western blot蛋白条带进行灰度值分析。
1.4 数据统计分析
使用SPSS 19.0软件进行统计学分析,P<0.05视为具有显著性差异,P<0.01视为具有极显著性差异。
2 结 果
2.1 过表达或干扰OPN5载体在颗粒细胞中的转染效率
对颗粒细胞转染过表达OPN5载体,结果显示(图1A),转染48和72 h后,OPN5表达量较对照组升高分别极显著升高32.0和126.8倍(P<0.01),其中转染72 h后表达更高。对颗粒细胞进行OPN5干扰处理,结果显示(图1B),转染48 h,siRNA-OPN5处理组OPN5表达量相对于对照组siRNA-NC有所下降,但未达显著水平(P>0.05);转染72 h,siRNA-OPN5处理组的OPN5表达量则极显著低于对照组siRNA-NC(P<0.01);转染48和72 h的干扰效率分别为24%和45%。据此,后续过表达或干扰OPN5的处理均采用转染72 h。

A.基因相对表达量均按pcDNA3.1=1的标准进行均一化处理;B.基因相对表达量均按siRNA-NC=1的标准进行均一化处理。下同A.Relative gene expressions were homogenized according to the criteria of "pcDNA3.1=1";B.Relative gene expressions were homogenized according to the criteria of "siRNA-NC=1".The same as below图1 不同处理时间过表达或干扰OPN5对颗粒细胞OPN5转染效率的影响Fig.1 Effect of overexpression or interference of OPN5 on the transfection efficiency of OPN5 in granulosa cells at different treatment time
2.2 过表达或干扰OPN5对颗粒细胞凋亡的影响
在AnnexinV-FITC细胞凋亡检测中(图2A),仅绿色荧光染色的为凋亡细胞,绿色和红色荧光双染的为坏死细胞,未荧光染色的为正常细胞,结果显示,过表达和干扰OPN5均明显影响颗粒细胞的凋亡。流式细胞凋亡检测结果显示(图2B、2C和2D),与对照组相比,过表达OPN5显著降低颗粒细胞凋亡数(P<0.05),干扰OPN5则显著升高颗粒细胞凋亡数(P<0.05)。AnnexinV-FITC细胞凋亡检测结果与流式细胞凋亡检测结果一致,表明OPN5能抑制颗粒细胞的凋亡。

A.AnnexinV-FITC细胞凋亡检测结果(100×);B.颗粒细胞流式细胞凋亡检测图;C、D.流式细胞凋亡结果的统计。*.P<0.05,下同A.Results of AnnexinV-FITC apoptosis assay (100×);B.Flow-through apoptosis assay graph of granulocytes;C,D.Statistics of flow-through apoptosis results.*.P<0.05,the same as below图2 OPN5对颗粒细胞凋亡水平的影响Fig.2 The effect of OPN5 on granulosa cells apoptosis level
2.3 过表达或干扰OPN5对颗粒细胞增殖的影响
对颗粒细胞增殖情况进行EdU检测。结果显示(图3),在过表达试验中,相比pcDNA3.1和NC组,pEGFP-OPN5组的EdU阳性率极显著升高(P<0.01),表明过表达OPN5极显著促进细胞增殖,pcDNA3.1和NC组两对照组间则差异不显著。在干扰试验中,相比于siRNA-NC和NC组,siRNA-OPN5组的EdU阳性率极显著下降(P<0.01),表明干扰OPN5表达使细胞增殖明显受到抑制,siRNA-NC和NC组间则无明显差异。
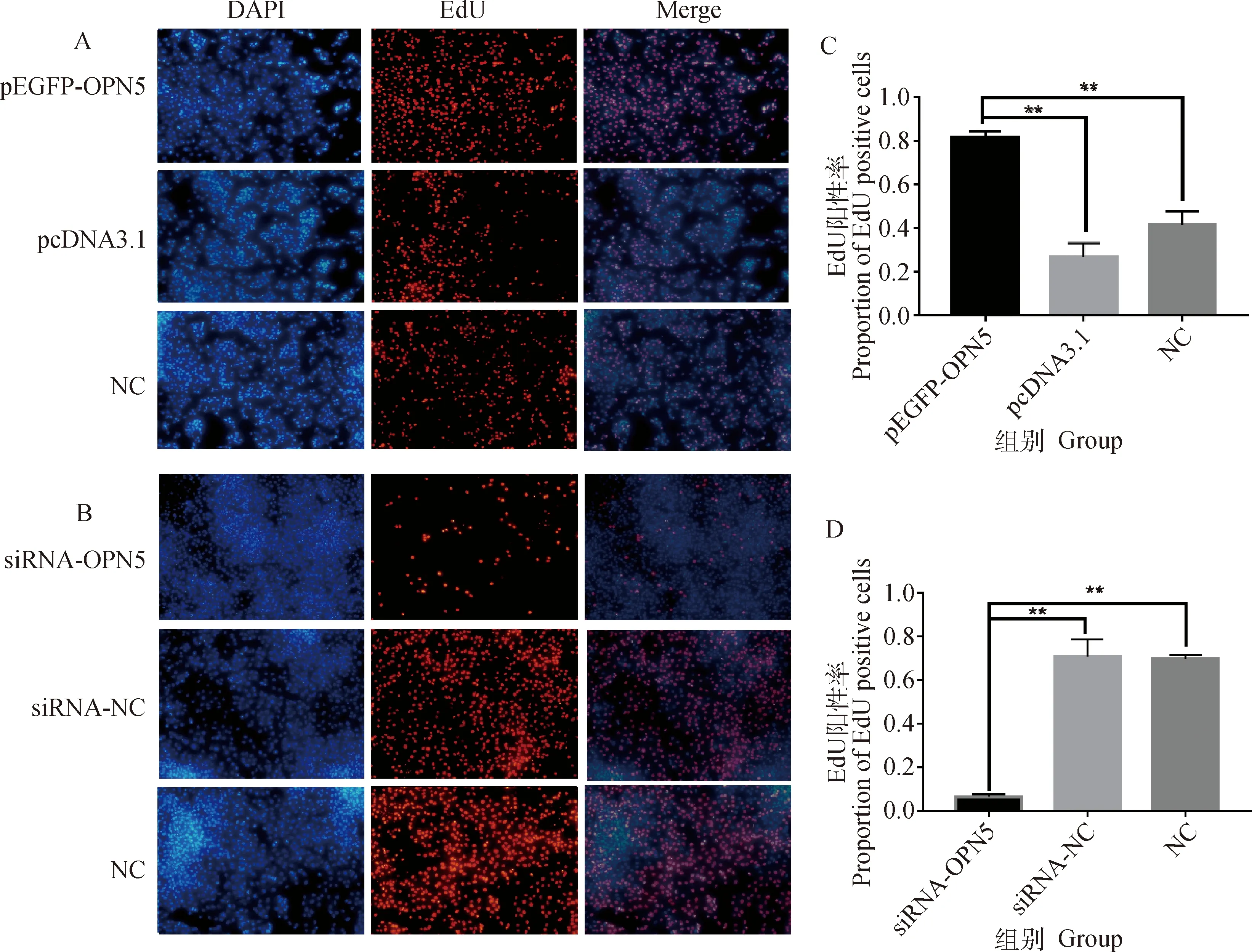
A、B.颗粒细胞EdU检测结果(100×),EdU(红色)荧光表明细胞增殖,DAPI(蓝色)荧光表示细胞核;C、D.EdU染色细胞比例。**.P<0.01,下同A,B.Granulocyte EdU assay results (100×),EdU (red)fluorescence indicates cell proliferation,DAPI (blue)fluorescence indicates nucleus;C,D.Proportion of EdU-stained cells.**.P<0.01,the same as below图3 OPN5对颗粒细胞增殖水平的影响Fig.3 The effect of OPN5 on granulosa cells proliferation level
2.4 过表达或干扰OPN5对鸭颗粒细胞凋亡与增殖相关基因表达的影响
检测颗粒细胞凋亡与增殖相关基因的表达水平。结果显示(图4),OPN5过表达极显著下调凋亡基因Bax与Caspase3的表达(P<0.01),显著或极显著上调抑制凋亡基因BCl2、BCl6表达(P<0.05或P<0.01)和极显著上调增殖基因CDC20、CDK1与CyclinD1的表达 (P<0.01);干扰OPN5对以上基因表达水平的影响均与OPN5过表达的影响结果相反。结果表明,过表达或干扰OPN5能通过影响颗粒细胞凋亡与增殖相关基因的表达来促进或抑制颗粒细胞增殖。
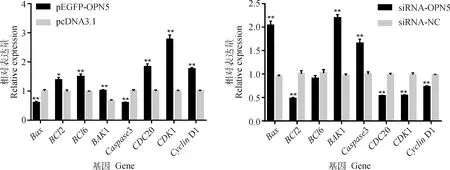
图4 颗粒细胞凋亡、增殖相关基因表达水平Fig.4 Expression levels of apoptosis and proliferation-related genes in granulosa cells
2.5 过表达或干扰OPN5对颗粒细胞生殖相关基因表达的影响
检测颗粒细胞生殖相关基因的表达水平。结果显示(图5),转染OPN5过表达载体能极显著上调OPN5的表达水平(P<0.01);OPN5过表达极显著升高GnRHR、FSHR、LHR的表达量(P<0.01),也增加TSHβ、GnRH的表达,但未达显著水平;极显著抑制GnIH、GnIHR的表达(P<0.01)。干扰OPN5能极显著抑制OPN5表达,干扰效率达60%;干扰OPN5极显著降低生殖相关基因GnRH、GnRHR、FSHR、LHR的表达,极显著增加GnIH、GnIHR的表达(P<0.01),而对TSHβ的表达则无显著影响(P>0.05)。
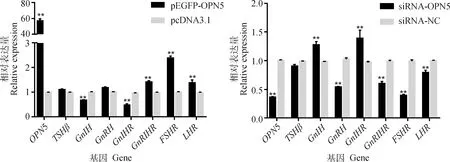
图5 颗粒细胞生殖相关基因表达水平Fig.5 Expression levels of reproduction-related genes in granulosa cells
2.6 过表达或干扰OPN5对颗粒细胞类固醇激素合成通路的影响
检测类固醇合成通路相关基因的表达水平。结果显示(图6A和6B),OPN5过表达显著或极显著上调类固醇合成通道基因StAR、CYP11A1、3β-HSD、CYP17A1、CYP19A1的表达(P<0.05或P<0.01);干扰OPN5对以上类固醇合成通道基因的表达产生相反的影响,显著或极显著下调StAR、CYP11A1、3β-HSD、CYP17A1的表达(P<0.05或P<0.01)。检测颗粒细胞OPN5和类固醇合成通路中3β-HSD、CYP19A1因子的表达水平,结果显示(图6C和6D),OPN5过表达显著上调OPN5、3β-HSD和CYP19A1的蛋白表达(P<0.05);干扰OPN5则显著下调OPN5、3β-HSD和CYP19A1的蛋白表达(P<0.05)。所得结果与基因的表达结果相一致。
2.7 过表达或干扰OPN5对鸭颗粒细胞培养液中生殖激素水平的影响
测定细胞培养液中生殖激素水平。结果显示(图7),过表达OPN5极显著升高细胞液中雌二醇(E2)和孕酮(P4)的水平(P<0.01),极显著降低抑制素β(INHβ)的水平(P<0.01);干扰OPN5则极显著降低细胞液中E2和P4水平和升高INHβ水平(P<0.01)。结果表明,过表达OPN5促进颗粒细胞分泌E2和P4,抑制INHβ表达和分泌,干扰OPN5则呈现相反的结果。

A、B.过表达或干扰OPN5对类固醇通路相关基因表达水平的影响;C.过表达和干扰OPN5对OPN5、CYP19A1、3β-HSD蛋白表达的Western blot结果;D.过表达和干扰OPN5对OPN5、CYP19A1、3β-HSD蛋白表达的影响A,B.Effect of overexpression and interference with OPN5 on the expression levels of steroid pathway-related genes;C.Western blot results of overexpression and interference with OPN5 on the expression of OPN5,CYP19A1,and 3β-HSD proteins;D.Effect of overexpression and interference with OPN5 on the expression of OPN5,CYP19A1,and 3β-HSD proteins图6 颗粒细胞类固醇激素合成通路关键因子表达水平Fig.6 Expression levels of key factors in the steroid hormone synthesis pathway in granulosa cells
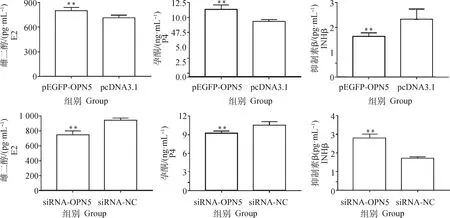
图7 颗粒细胞培养液中生殖激素水平Fig.7 Reproductive hormone levels in granulocyte cultures
3 讨 论
OPN5是深脑光照感受器,能介导光照对禽(鸟)类繁殖活动的调控。国内外对OPN5的研究均围绕生殖轴上游的下丘脑-垂体层来展开,并且大量研究已表明,OPN5可将光信号传导至垂体结节(PT),启动甲状腺激素应答(TH-responsive)信号通路[8-9],通过调节甲状腺素(T3)的分泌来影响GnRH的生成和分泌[17-18],从而调控禽(鸟)类繁殖;但是关于OPN5在生殖轴下游性腺层面的直接作用尚未见报道。有研究表明,OPN5在性腺层面有高浓度表达[1-4],并且主要在颗粒层,这预示OPN5在性腺层对禽(鸟)类的繁殖活性具有直接调控作用。本研究进一步证实了这个结论,并从正反两方面揭示了OPN5在颗粒细胞中的作用机制。所得结果表明,OPN5除了在生殖轴上游的下丘脑、垂体层面发挥调控作用外,还在性腺层面直接发挥作用。
在禽(鸟)类,主要由颗粒细胞和膜细胞来促进卵泡的发育,其中颗粒细胞是合成P4的重要场所,E2则是由膜细胞和颗粒细胞共同合成[19-20],E2和P4互相之间存在正反馈调节。雌激素在卵泡发育过程中具有明显调节作用,可以促进LHR的分化和芳香化酶的合成,从而促进卵泡发育和抑制颗粒细胞凋亡[21-22]。在E2负反馈控制下,INH表达的降低可以使FSH表达水平升高[23]。本研究中,通过检测过表达或干扰OPN5转染效率,发现均是72 h 转染效果最佳,过表达OPN5能够促进鸭颗粒细胞的增殖,抑制颗粒细胞的凋亡。检测凋亡和增殖相关基因的表达,发现过表达OPN5显著抑制细胞凋亡基因Bax与Caspase3的表达,而明显升高凋亡抑制基因BCl2、BCl6的表达,同时也显著升高细胞增殖因子CDC20、CDK1与CyclinD1的表达水平。相反,干扰OPN5则明显抑制颗粒细胞增殖,促进颗粒细胞凋亡,并显著促进以上凋亡基因的表达,降低细胞凋亡抑制基因和细胞增殖因子的表达。本研究结果从正反两方面均表明,OPN5能促进体外培养的颗粒细胞增殖,抑制凋亡,提示其可能在性腺通过调控颗粒细胞的增殖和凋亡来影响卵泡的发育,这与相关研究结果相一致。有研究表明,随着人颗粒细胞的凋亡,细胞凋亡基因Bax、Caspase3表达上升,而凋亡抑制基因BCl2的表达则下降[12];伴随着猪颗粒细胞的凋亡,细胞凋亡基因Caspase3表达明显上升[13],而当牛颗粒细胞增殖时,细胞增殖因子CDC20、CDK1与CyclinD1表达会明显上升[14]。还有研究显示,当小鼠颗粒细胞凋亡时,细胞增殖因子Cyclin D1蛋白表达下调,但细胞凋亡因子Bax的蛋白表达上升[24];当细胞增殖因子CyclinD1 mRNA水平上升时,鸡颗粒细胞的增殖增加[25]。这些结果均提示,当细胞凋亡因子表达增加,凋亡抑制因子和细胞增殖因子表达下降时,会导致细胞凋亡增多,增殖受到抑制;相反,细胞凋亡受抑制,增殖增多时,细胞凋亡因子表达下降,凋亡抑制因子和增殖因子水平均上升。本研究中,当OPN5过表达时,在促进颗粒细胞增殖,抑制其凋亡的同时,相关凋亡因子、凋亡抑制因子及细胞增殖因子的表达变化与以上的结果均一致。
颗粒细胞作为卵泡发育的重要支持细胞,也是类固醇激素生成的主要细胞。在生殖轴调控性腺发育的过程中,尤其是对卵泡发育的影响,下丘脑和垂体层面调控激素均通过与颗粒细胞和膜细胞上特异性受体结合来调控这些细胞的增殖、凋亡及类固醇激素的生成,对卵泡发育产生影响,其中下丘脑GnRH、GnIH和垂体FSH、LH对性腺发育发挥重要调控作用,GnIH能在性腺直接表达并发挥作用。本研究中,过表达OPN5能显著升高生殖相关基因GnRHR、FSHR、LHR和类固醇生成通道基因StAR、CYP11A1、3β-HSD、CYP17A1、CYP19A1的表达,显著下调生殖相关基因GnIH、GnIHR的表达,而干扰OPN5则呈现相反的结果。检测细胞培养液中的类固醇激素水平,发现过表达OPN5能显著升高E2和P4水平,降低INHβ水平,而干扰OPN5则显著降低E2和P4水平和升高INHβ水平。本研究结果表明,过表达OPN5可以增加下丘脑和垂体促进繁殖的调控因子对颗粒细胞的作用,并促进颗粒细胞中类固醇激素生成,从而对性腺发育产生影响,而干扰OPN5则进一步从反向印证了这一结论。这些结果与相关的研究报道一致。大量的研究表明,StAR是类固醇激素合成的重要限速酶,其在卵泡发育的各阶段均有表达[26],黄体能否正常产生P4受StAR表达的调控[27];CYP11A1、CYP19A1与卵泡发育及颗粒细胞成熟有关[28],CYP19A1敲除小鼠无法合成E2[29];3β-HSD则可催化产生有活性的P4来调节卵泡的发育进程[30];CYP17A1可以通过控制雄激素的合成刺激颗粒细胞释放P4而调控排卵,还能影响早期卵泡发育[31-32]。在体外细胞试验方面,GnIH的增加能减少颗粒细胞中类固醇激素的释放,降低LHR和FSHR以及相应类固醇激素合成酶的表达,如StAR、3β-HSD和CYP19A1,会导致E2和P4的分泌减少,并伴随有颗粒细胞的凋亡,细胞增殖受抑制[11]。另外,也有研究表明,E2和P4可以降低GnIHR的表达,GnIHR的表达量在性成熟的鸟类卵巢中较未性成熟的鸟类更低[33];在E2的负反馈下,低水平的INH可以使FSH在繁殖期内表达水平升高[19]。
在季节性繁殖禽(鸟)类中,繁殖活动的季节性变化主要受光照控制,不同光照时间或波长在调控动物繁殖活动的同时会导致OPN5表达的升高或降低。有研究表明,延长光照在升高OPN5和TSHβ表达的同时会提高匈牙利白鹅的产蛋率[8];在白光和红光照射下,OPN5的表达量会高于蓝光和绿光的照射,并会升高扬州鹅产蛋性能[9]。另外,有研究发现,OPN5表达量的降低能显著抑制鹌鹑TSHβ的表达[34]。在非季节性繁殖禽(鸟)类中,不同的光照处理也会影响繁殖性能,相应OPN5的表达也会升高或降低。研究发现,延长光照时间会促进原鸡睾丸发育,OPN5表达量升高,且OPN5的表达对光照反应非常迅速[2];在山麻鸭上,47 d的观察期内,24 h光照时长的产蛋率显著高于18 h[35]。结合以上研究结果,本研究结果提示,OPN5在光照调控禽(鸟)类繁殖活动中发挥了重要的介导作用,也提示其能在生殖轴的3个层面同时发挥对性腺发育的调控作用,但其作用机制及相互关系,目前仍需进一步研究。
4 结 论
OPN5能促进体外培养的鸭卵泡颗粒细胞增殖,抑制其凋亡,通过影响颗粒细胞中类固醇生成通路中相关因子的表达来促进类固醇激素的生成和分泌。
