太赫兹波对钾离子通道蛋白二级结构影响的分子动力学模拟*
2021-12-31孙远昆郭良浩王凯程王少萌宫玉彬
孙远昆 郭良浩 王凯程 王少萌 宫玉彬
(电子科技大学电子科学与工程学院(示范性微电子学院),微波电真空器件国家级重点实验室,成都 610054)
钾离子通道在神经细胞动作电位复极过程中起着重要作用.钾离子通道蛋白种类繁多,钾离子通道允许钾离子特异性穿过细胞膜,从而维持神经细胞静息电位.离子通道蛋白的二级结构决定其功能特性,皮秒尺度内二级结构的波动会对离子通道蛋白的功能,即离子通过速率有很大的影响.本文使用分子动力学模拟方法,模拟施加不同幅值的53.7 THz 的太赫兹波对真实KcsA 钾通道蛋白二级结构和钾离子通过速率的影响.研究发现,在53.7 THz 的太赫兹波的作用下,KcsA 钾通道蛋白中α 螺旋数量减少,β 折叠以及卷曲数量增加.此外,53.7 THz 的太赫兹波能够加速钾离子通过KcsA 钾通道.本文从蛋白质的二级结构分析太赫兹波对钾离子通道蛋白的影响,为太赫兹波和生物功能分子相互作用之间提供了新的观察角度.
1 引言
钾离子通道广泛分布于神经、血管、血液等的细胞中,在调节细胞,尤其是神经细胞的膜电位和兴奋性中起重要作用[1-4].电压门控K+通道是典型的电压门控通道,是最大的钾通道基因家族,是神经元兴奋性的关键调节因子[5-7].人体中的电压门控钾离子通道包括40 个不同的基因编码,分为12 个亚科,从Kv1 到Kv12.哺乳动物电压门控钾通道是由围绕离子传导孔的4 个相同α 亚基组成的四聚体结构,其中每个亚基有6 个α 螺旋跨膜结构域(S1—S6),选择性过滤器由S5 和S6 之间的回路形成,其中S1—S4 序列对于通道电压感应和门控至关重要[5].
太赫兹波对研究生物系统的重要性在于其频率对应于脱氧核糖核酸(DNA)、核糖核酸(RNA)和蛋白质等生物功能分子的构象振荡范围,以及其量子能量与氢键和范德瓦耳斯力等分子间相互作用的能量重合,作用于生物分子上的太赫兹波和生物分子内部可能发生非线性共振,导致其构象和功能发生剧烈变化,从而对生物系统产生非热效应[8-13].因此,太赫兹波有望具有广泛的潜在生物医学和安全相关应用.已有研究表明,太赫兹波和细胞内移动离子的相互作用主要是电作用[14].太赫兹波能够影响膜蛋白的功能从而对生理过程进行调制.研究发现,太赫兹波通过和离子通道蛋白某些基团形成共振,影响离子通过速率,进而影响生物体的记忆以及感知等功能[15-18].太赫兹波还可通过引起碱性磷酸酶的结构发生变化从而影响其活性[19].太赫兹波会引发各种细胞反应,例如改变基因表达模式、改变基因组的结构和完整性以及影响细胞骨架的组装过程[20-22].近年来,有研究报道了太赫兹波对细胞内遗传物质的影响.太赫兹波能够通过与弱氢键相连的嘌呤振动之间形成共振,破坏碱基对之间的氢键,从而大大加速DNA 的解螺旋速度[23].太赫兹波还可通过影响细胞内Zn2+离子的局部浓度变化来影响基因表达[24].上述研究表明,具有特定频率的太赫兹波会对生物功能分子产生影响,分布在细胞膜上的离子通道蛋白是太赫兹波的潜在分子靶标.此外,在模拟太赫兹波对生物功能分子的调制过程中,大多使用仅包含主要基团的近似结构,且对太赫兹波作用过程中离子通道蛋白二级结构的变化知之甚少.本文采用分子动力学方法,模拟太赫兹波对真实钾离子通道的作用,并分析在此过程中钾离子通道蛋白二级结构的变化,从而为太赫兹波和钾离子通道蛋白作用的动力学关系提供新的视角.
本文分析了太赫兹波对钾离子通道蛋白二级结构的影响,计算不同幅值太赫兹波作用下钾离子通道蛋白氢键网络的变化,以研究太赫兹波对蛋白质内部氢键的影响.此外,计算了不同幅值太赫兹波作用下钾离子通道蛋白各种二级结构的数目,统计分析太赫兹波对各种二级结构的变化趋势的影响,结果表明,太赫兹波对蛋白质二级结构的影响主要体现在α 螺旋、β 折叠和卷曲这3 种二级结构.最后,计算了不同幅值太赫兹波作用下,钾离子通过钾离子通道的速率.
2 钾离子通道蛋白四聚体结构模型与分子动力学计算方法
2.1 钾离子通道蛋白四聚体结构
从蛋白质结构数据库(RCSB PDB)中获得钾离子通道蛋白KcsA 的单体结构,并使用VMD 将其转化成四聚体结构.在计算前,用CHARMMGUI网站补全原始结构中缺失的残基,并用VMD 检查补齐后的四聚体结构.如图1(a)所示,KcsA 通道结构包含1 个胞内门,将细胞质和充满水的空腔分开,这个门是由4 个TM2 螺旋的羰基末端聚集在一起形成束交叉从而收缩通往孔道区的通道.图1(b)是从正前方观察到的KcsA 通道结构,图中黄颜色为β 折叠,紫色为α 螺旋,β 折叠和α 螺旋之间通过卷曲连接.
2.2 分子动力学模拟体系的构建
如图1(c)所示,将钾离子通道蛋白的四聚体结构正确嵌入二棕榈酰磷脂酰胆碱(DPPC)膜中,并用SPC 水填充整个盒子[25].为了模拟真实的生理环境,在模拟体系中加入0.15 mmol 的KCl,对应于模拟体系中含有315 个K+和331 个Cl—.为了充分限制蛋白质和磷脂的位置,在模拟之前,先进行400 ps 的预平衡.之前的研究表明,钾离子通道中负责钾离子特异性传输的基团是羰基,羰基自发的振动频率为53.7 THz[16].因此,在模拟盒子中应用53.7 THz 的太赫兹波从上表面垂直入射,模拟的时间步长为2 fs.
从图1(a)和图1(b)可以看到,KcsA 过滤器有向内朝向孔中心的骨架羰基氧,以协调通过的钾离子,从而取代它们的溶剂化水.已有研究表明,钾离子通道的孔区域通过氢键网络固定在恰当的位置[26].
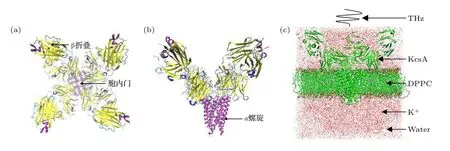
图1 (a) KcsA 四聚体结构(从上往下);(b) KcsA 四聚体结构(从前往后);(c)钾离子通道模型Fig.1.(a) KcsA tetramer structure (from top to bottom);(b) KcsA tetramer structure (from front to back);(c) potassium channel model.
蛋白质内或蛋白质与溶剂分子之间的氢键网络的动态波动通过平均氢键对的相关函数[Chb(τ) ]来表征[27]:
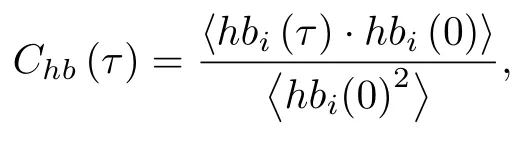
式中t时刻特定氢键i的存在函数是0 或1 (hb(τ)[0,1]).在分析中,氢键是使用几何标准定义的,即质心距离小于3.5 Å,O···H 的距离小于2.6 Å,HO和O 之间的角度小于30°.蛋白质系统中其他弱相互作用(范德瓦耳斯力、静电等)被识别为近似截止距离内的接触.
二级结构,如α 螺旋和β 折叠,是以骨架氢键、骨架原子、Cα 原子等连接[26].氢键和任何分子相互作用一样,在短距离内很强并在无穷远处不断减小为零.为了计算方便,氢键被视为阶跃函数.氢键的判定标准有能量准则、电子结构准则、几何准则等,其中能量准则和电子结构准则的计算量大,不易实现[27].在本文的计算中,使用几何标准对氢键进行定义,氢键是由氢原子-施体-受体所成角度的截断值与施体-受体之间距离的截断值共同决定的.OH 和NH 被作为氢键施体,O 总是作为氢键受体,N 默认为受体,以便对KcsA 四聚体中的氢键网络和各种二级结构进行区分.
3 不同强度太赫兹波对体系氢键网络的影响
钾离子通道蛋白质在脂质膜的复杂环境中起作用,蛋白质原子不仅彼此相互作用并与水相互作用,还和周围脂质分子的原子相互作用.氢键可在蛋白质中氨基酸的残基内起作用,是蛋白质三维结构稳定性和灵活性的驱动力之一,对于膜蛋白的组装、结构和功能至关重要[28].天然膜环境中的膜蛋白不像在晶体结构中所观察到的是静态的,相反,它们是动态的.理论和实验的研究结果都表明,蛋白质二级结构中发生的皮秒时间尺度的波动对蛋白质的功能有很大影响[29-31].分子动力学模拟允许我们通过重建溶剂化膜蛋白的生理脂质膜环境扩展实验的观察范围,从而研究原子细节的动力学[32].计算了不同幅值的太赫兹波辐射下钾离子通道蛋白氢键网络中氢键的数量,结果如图2 所示.可以看出:随着时间的增加,氢键数量开始缓慢增加,经过800 ps 后,氢键数量趋于稳定.随着太赫兹波幅值从0 增加到0.5 V/nm,稳定后的氢键网络中的氢键数量在减少,且随着幅值的增大,减少趋势越来越明显,下文也可以得出氢键数量的改变主要是由钾通道蛋白质中二级结构的数目变化引起的,氢键的数量对蛋白质的稳定性具有重要作用,氢键数量减少说明此时蛋白质的稳定性变弱,钾离子通道蛋白的构象容易发生改变,进而影响通道中钾离子通过速率.
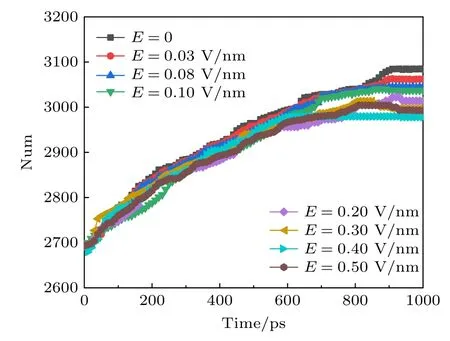
图2 太赫兹波强度不同时钾离子通道蛋白中氢键的变化Fig.2.Changes of hydrogen bonds in potassium channel proteins at different terahertz intensities.
4 不同强度太赫兹波对钾离子通道蛋白二级结构的影响
二级结构允许简单描述蛋白质的复杂三维结构.分子动力学软件Gromacs 采用DSSP 程序将通过X 射线晶体学或核磁共振确定的原子坐标转换为供体和受体之间的主链氢键,然后将重复键合模式转换为螺旋、片和匝等类别,进一步可细分为α 螺旋、卷曲、β 折叠、β 桥、弯曲、转角、回折等二级结构.本文计算了在不同幅值太赫兹波作用下钾离子通道蛋白二级结构(总数=α 螺旋+β 折叠 +β 桥+转角)的变化趋势.如图3 所示,在经过近700 ps 的稳定后,钾离子通道蛋白的二级结构数目也趋于稳定,从图3 可以看出,当外加太赫兹波时,钾离子通道蛋白二级结构数目比不加太赫兹电磁波时多,外加太赫兹电磁波会影响蛋白质二级结构的变化从而影响其功能.并且在外加太赫兹波幅值为0.2 V/nm 时,钾离子通道蛋白二级结构的数目增加最多,此时我们认为是钾离子通道蛋白和太赫兹波形成频率和幅值匹配才造成钾离子通道蛋白结构变化显著.
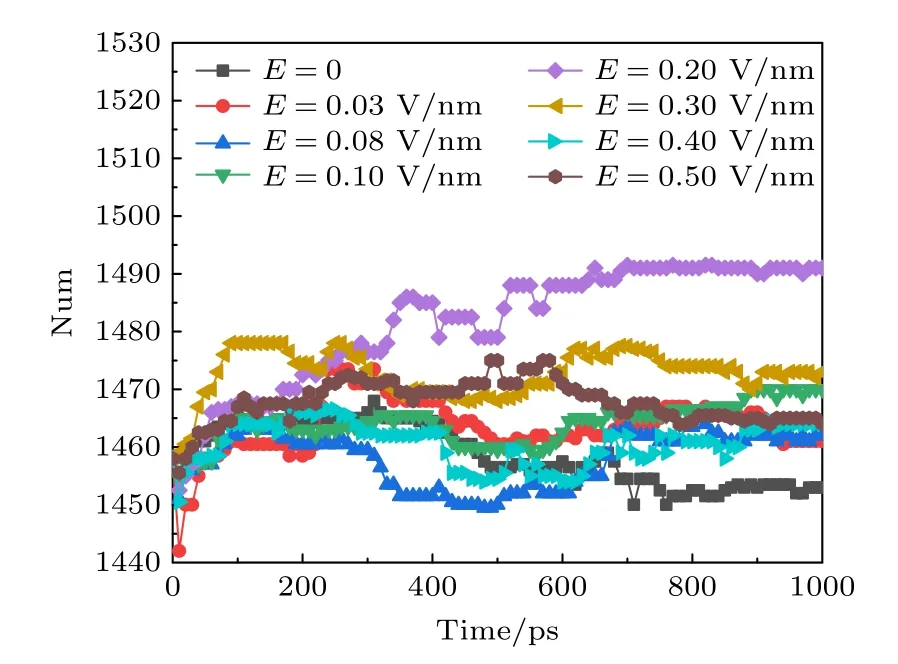
图3 太赫兹波强度不同时钾离子通道蛋白中二级结构数目的变化Fig.3.Changes in the number of secondary structures in potassium channel proteins under different terahertz intensities.
蛋白质的二级结构又可进一步分为α 螺旋、β 折叠、卷曲和转角等结构.α 螺旋是蛋白质肽链主链骨架借助氢键卷曲形成的一种周期性螺旋结构,α 螺旋跨膜结构域的相互作用和动力学在膜蛋白的折叠、组装和功能中起着重要作用[33-35].氢键是α 螺旋稳定的主要次级键,当氢键破坏时,α 螺旋构象即被破坏.借助VMD,我们发现α 螺旋主要集中于S5 和S6 的孔道处,即包围了钾离子通道最窄的地方.不同幅值的太赫兹波作用下α 螺旋的变化趋势如图4 所示,可以看出,在体系平衡后,外加太赫兹波时,钾离子通道蛋白中α 螺旋的数目要比未加太赫兹波时少,并且外加太赫兹波的幅值增大时,对应的α 螺旋的数目也在缓慢减小.因为太赫兹波的能量极低,不能直接破坏共价键,只能通过共振形式破坏氢键.图4 中的结果表明,太赫兹波会破坏钾离子通道蛋白中α 螺旋中的氢键,使其数目减少.
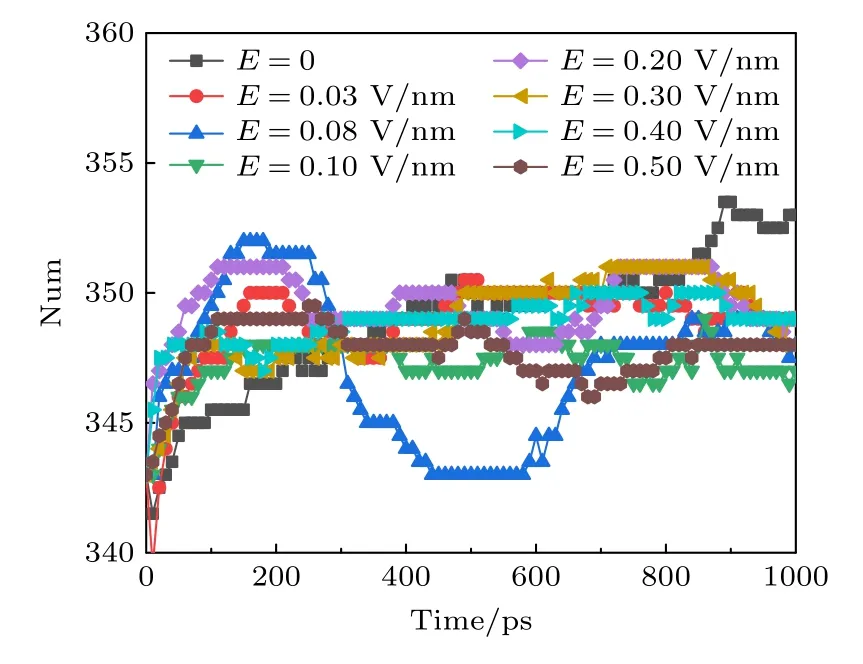
图4 太赫兹波强度不同时钾离子通道蛋白中α 螺旋数目的变化Fig.4.Changes in the number of α-helices in potassium channel protein under different terahertz intensities.
β 折叠是由两条以上肽链或同一条肽链之间的不同部分平行或反平行排列形成股,股与股之间通过氢键固定,氢键主要在股间.β 折叠主要存在于S1—S4 序列,影响通道电压感应和门控.不同幅值的太赫兹波作用下β 折叠的变化趋势如图5所示,可以看出,外加太赫兹波时的β 折叠数量比未加太赫兹波时多.说明太赫兹波可能会促进不同肽链之间或同一条肽链之间不同部分形成新的β 折叠,也有可能是太赫兹波导致部分α 螺旋展开形成β 折叠.从图4 和图5 可知,太赫兹波造成α 螺旋减少,β 折叠增多.β 折叠往往含有较多的非极性残基,并埋在蛋白质内部形成疏水核心,而α 螺旋通常是两性的,亲水面位于表面,疏水一侧朝向蛋白质内部.α 螺旋的减少和β 折叠的增多会导致钾离子通道中疏水核的暴露和亲水面的减少,从而影响钾离子通过速率.
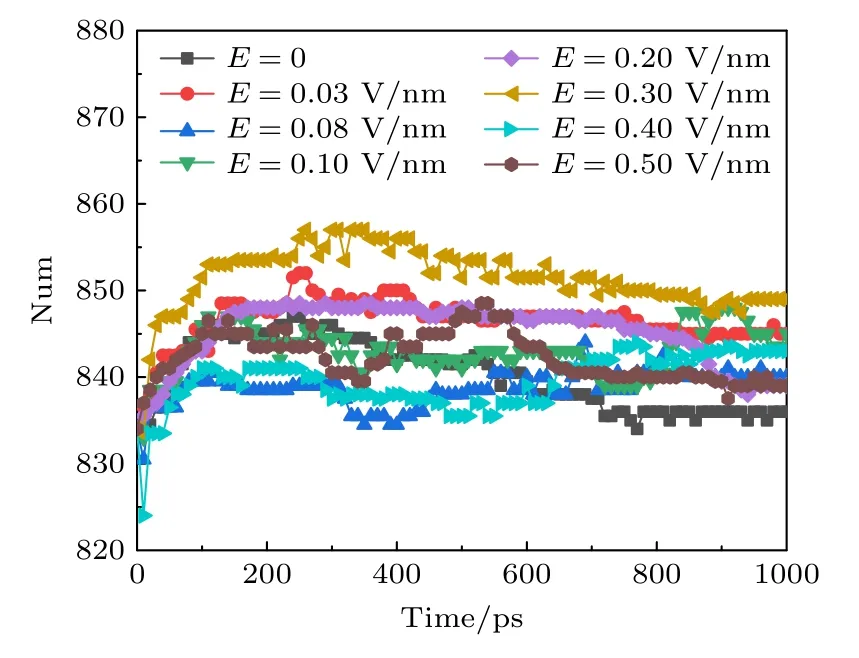
图5 太赫兹波强度不同时钾离子通道蛋白中β 折叠数目的变化Fig.5.Changes in the number of β-sheet in potassium channel protein under different terahertz intensities.
卷曲通过主链间的氢键或主链与侧链间的氢键稳定其构象,其是柔性的,可以使肽链改变走向,且有利于连接结构相对刚性的α 螺旋和β 折叠.从图6 可以看出,外加太赫兹波时钾离子通道蛋白中的卷曲数目减少,并且在外加太赫兹波幅值为0.2 V/nm 时,卷曲的数目变化最大,此时蛋白质的构象变化可能最大.
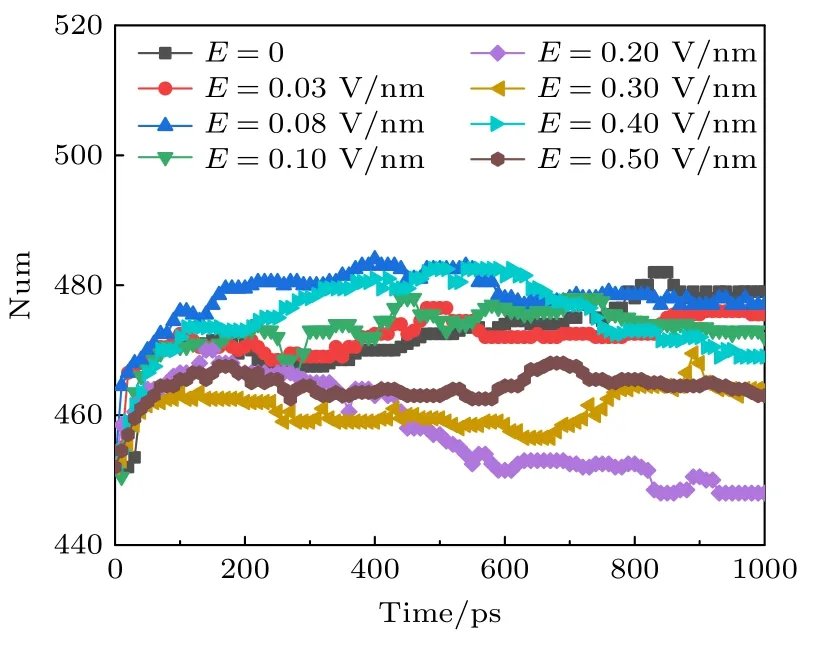
图6 太赫兹波强度不同时钾离子通道蛋白中卷曲数目的变化Fig.6.Changes in the number of coil in potassium channel protein under different terahertz intensities.
5 不同强度太赫兹波对离子通过速率的影响
钾离子通过钾通道的速率对于调节神经细胞的静息电位和动作电位至关重要,并且钾离子通道对一些疾病起着调节作用,是治疗的新靶点.本文分别计算了无太赫兹电场、太赫兹电场强度为0.1,0.2,0.3,0.4,0.5 V/nm 情况下钾离子通过电压门控钾离子通道的速率,从图7 可知,最开始随着外加太赫兹波幅值的增大,钾离子通过钾离子通道的速率也随之增大,但是当幅值增加到0.3 V/nm 及以上时,钾离子通过的速率不再增加,我们推测已经达到了钾离子通道的饱和,这是由于孔道蛋白分子不是电中性的,其对通过的钾离子具有一定的电吸引,限定了它的最大运输速度.并且从图4—图6可知,当外加太赫兹波的幅值为0.2 V/nm 时,对应的二级结构变化最大,但是此时的钾离子通过速率却没有达到最大.静电分析表明,当钾离子沿着狭窄的孔道穿过膜时它必须穿过一个能量闸,太赫兹波除了和钾离子通道蛋白中的羰基形成共振外,还对模拟盒子中的钾离子有库仑力的作用,两者共同作用使钾离子快速通过钾离子通道.
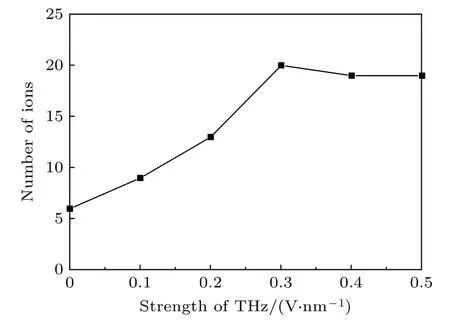
图7 太赫兹波强度不同时钾离子通过钾离子通道的数目Fig.7.Number of potassium ions passing through potassium channels under different intensities of terahertz.
6 结论
本文采用分子动力学的方法模拟了太赫兹波对真实钾离子通道蛋白二级结构的影响,以及太赫兹波对钾离子通过钾离子通道的影响.基于DSSP程序,统计了在不同幅值太赫兹波的作用下,钾离子通道蛋白主要二级结构皮秒时间尺度随时间的波动.结果表明,太赫兹波的作用下,α 螺旋的数目减少,β 折叠、卷曲等二级结构的数目有小幅增加.特别是卷曲数目的改变表明了钾离子通道蛋白构象在太赫兹作用下发生了改变.太赫兹波还能够促进钾离子通过钾离子通道.开始阶段随着外加太赫兹波幅值的增加,钾离子通过速率也跟着增加,当增加到0.3 V/nm 及以上时,钾离子的通过速率不再变化,这主要是由于已经达到了钾离子通道的饱和.本文的研究为理解太赫兹波和离子通道蛋白集体振动的关系提供了一个新的视角.
