无花果叶提取物对重症肺炎大鼠的保护作用及机制的初步探讨
2021-12-31徐志育谢晓红
徐志育,谢晓红,朱 永,李 娜
0 引言
重症肺炎(Severe pneumonia,SP)是一种急性呼吸道感染性疾病,也是全球范围内常见的高死亡率疾病之一[1]。研究表明,包括H1N1、H5N1和H7N9在内的流感病毒可诱发SP,此外,还有一些细菌,如肺炎链球菌和金黄色葡萄球菌也可引起SP[2-3]。SP病理机制复杂,严重影响了人们的生活质量,探索有效的治疗途径是治疗SP的关键。
细胞间黏附分子-1(Intercellular adhesion molecule,ICAM-1)主要在支气管和肺泡的上皮细胞以及间皮和内皮细胞间表达,是免疫球蛋白超家族的成员之一。ICAM-1可与细胞表面的β2整合素特异性结合,导致淋巴细胞与各内皮细胞的黏附性降低,减少细胞之间的信号传导[4]。巨噬细胞炎性蛋白2(Macrophage inflammatory protein 2,MIP-2)是由多种细胞响应感染或损伤而释放的因子,能够调节中性粒细胞的浸润和微脓肿的形成[5]。已有研究表明,MIP-2与NF-κB结合后,与中性粒细胞发挥的作用密切相关,在呼吸道感染过程中参与了肺损伤的发展[6]。由此可见,消除这些引发炎症感染的核心因子对于SP的治疗至关重要。
无花果(FicuscaricaL.)属于桑科无花果属植物,其化学成分较多,具有较高的营养价值和药用价值,此外,无花果叶也具有抗氧化、抗菌、抗肿瘤以及降血脂血糖等作用[7-8]。而无花果叶对于SP是否也发挥作用未见报道,本研究观察了无花果叶提取物对SP大鼠肺组织的影响,并初步探讨其作用机制,以期为SP的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 65只SPF 级雄性 SD 大鼠,体重180~220 g,购于海南医学院实验动物中心。
1.1.2 主要试剂 无花果叶提取物购自西安天瑞生物技术有限公司,肺炎克雷伯菌液由医院检验科细菌室提供,IL-4、IL-6、IL-10、TNF-α ELISA检测试剂盒购自中国碧云天生物技术研究所,HE染色试剂和免疫组化染色试剂购自北京索莱宝科技公司,Trizol试剂购自美国Thermo 公司,SYBR Premix Ex Taq Ⅱ试剂盒购自日本TAKARA公司,PVDF膜与ECL发光液购自中国碧云天生物技术研究所,抗体ICAM-1、MIP-2、NF-κB p65、p65、p-IκBα、IκBα购自英国Abcam 公司,抗体辣根过氧化物酶标记山羊抗兔IgG和GAPDH购自北京中杉金桥生物技术有限公司。其他试剂均为国产分析纯。
1.2 重症肺炎大鼠造模 取50只大鼠,术前12 h禁食不禁水,麻醉后颈部消毒并剃毛,无菌条件下将颈部皮肤切开,暴露上段气管,用1 ml注射器经气管注入 0.3 ml肺炎克雷伯菌液(生理盐水稀释约 3.6×108CFU/只),将大鼠在固定台直立保持20 s,以菌液分布均匀,缝合伤口,进行消毒。接种后,当大鼠出现行动迟缓、呆滞、呼吸急促等现象,且脉搏血氧仪检测大鼠后足部血氧饱和度(SaO2)小于90 %,则判定重症肺炎大鼠建模成功。
1.3 给药处理 将建模成功的 45 只大鼠按照随机数字表法分为模型组、低剂量无花果叶提取物组(低剂量组)及高剂量无花果叶提取物组(高剂量组),另将15只未经任何处理的大鼠设为正常组,共4组,每组15只。低剂量组、高剂量组分别给予无花果叶提取物50 mg/(kg·d)、100 mg/(kg·d)灌胃,对照组和模型组均灌胃等量蒸馏水,连续8周,观察期间大鼠自由摄食、饮水。
1.4 ELISA法检测IL-4、IL-6、IL-10及TNF-α水平 实验结束后,大鼠腹主动脉取血,室温静置2 h,于4 ℃离心机中以3 500 r/min 离心 15 min,分离上清液,按照ELISA试剂盒检测方法,检测各组大鼠血清中IL-4、IL-6、IL-10 及TNF-α水平。
1.5 HE染色检测肺组织病理变化 采血后处死大鼠,摘取肺组织,一部分固定在10%福尔马林溶液中,一部分保存于-80 ℃冰箱。肺组织固定后取出,脱水透明,浸蜡过夜,进行常规石蜡包埋,切成厚度为4 μm的切片,脱蜡至水,加入苏木精染色5 min,滴加盐酸乙醇分化液分化数秒,氨水处理5 s,加入伊红染色3 min,使用二甲苯透明、中性树胶封片,在显微镜下观察肺组织病理变化情况并采集图像。
1.6 免疫组化染色检测ICAM-1和MIP-2表达 取制备的大鼠肺组织石蜡切片,脱蜡至水,在微波炉中进行高温修复,滴加内源性过氧化物酶在37 ℃下孵育15 min,再使用5% 山羊血清在室温下封闭1 h,将切片分别与稀释的鼠抗ICAM-1(1∶200)、MIP-2抗体(1∶200)放在4 ℃下孵育过夜,次日,PBS洗涤,加入稀释的辣根过氧化物酶标记的山羊抗鼠IgG(1∶1 000),加入 DAB 显色后,苏木精复染后洗涤,中性树胶封片,在显微镜下观察并采集图像,使用Image J软件对图像进行测定分析。
1.7 实时荧光定量PCR检测ICAM-1、MIP-2 mRNA表达 取保存于-80 ℃冰箱的各组大鼠肺组织,剪碎后研磨匀浆,Trizol试剂提取总RNA,紫外分光光度计检测 RNA纯度与浓度。逆转录合成cDNA,以cDNA为模板进行qRT-PCR,GAPDH 作为内参基因。反应条件:95 ℃预变性3 min,95 ℃变性20 s,60 ℃ 退火 15 s,72 ℃ 延伸 45 s,循环 40 次,实验重复 3 次。采用2-ΔΔCt 法计算各基因mRNA相对表达量。引物由上海吉玛生物科技有限公司设计合成:ICAM-1 上游引物:5′-CGAATTCGGAGGTGCCCAGACGTC-3′,下游引物:5′-CCGCTCGAGTCAGGGTGTGGT-3′,MIP-2上游引物:5′-CCCAATGTCGCTCACTACTTCC-3′,下游引物:5′-CGTCAGCCCGTATGTCTTCC-3′,GAPDH上游引物:5′-GGCGTGAACCACGAGAA GTATAA-3′,下游引物:5′-CCCTCCACGATGCCAAAGT-3′。
1.8 蛋白质免疫印迹检测NF-κB p65、p65、p-IκBα及IκBα 蛋白水平 大鼠肺组织加入预冷的RIPA 裂解液研磨裂解肺组织,以 12 000 r/min 离心 5 min,获得上清液,BCA试剂盒测定蛋白浓度。取25 μg总蛋白上样,10%SDS-PAGE电泳分离,将分离蛋白转移至聚偏二氟乙烯膜上。TBST 洗涤3 次,5%山羊血清进行封闭 2 h,洗涤并加入一抗抗体,在4 °C下孵育过夜。次日TBST 洗膜 3 次,加入二抗,室温孵育2 h。TBST后,滴加ECL发光液进行显影,采用Image J图像分析软件统计各条带灰度值,以GAPDH为内参计算各蛋白相对表达量。
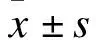
2 结果
2.1 各组大鼠血清炎性细胞因子IL-4、IL-6、IL-10 及TNF-α含量比较 模型组大鼠血清中IL-6、IL-10、TNF-α含量较对照组均显著增加(P<0.05),IL-4的含量较对照组显著下降(P<0.05);与模型组比较,低、高剂量无花果提取物组IL-6、IL-10、TNF-α的含量均显著下降(P<0.05),而IL-4含量显著增加(P<0.05),见表1。

表1 各组大鼠血清中炎症细胞因子表达情况(n=10,pg/ml)
2.2 各组大鼠肺组织病理学变化 对照组大鼠肺组织结构清晰,肺泡腔结构完整,间质无炎性细胞浸润;模型组大鼠肺组织结构受损,肺泡萎陷,腔内有血渗出,肺泡间隔断裂,可见大量炎性细胞浸润;低剂量组、高剂量组大鼠肺泡腔渗血和炎性细胞浸润等现象较模型组减轻,见图1。
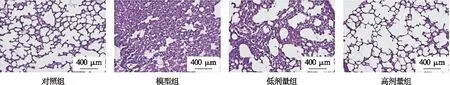
图1 HE染色检测各组大鼠肺组织病理学变化(100×)
2.3 各组大鼠肺组织ICAM-1和MIP-2免疫组化染色结果比较 对照组大鼠肺组织中染色较少较浅,ICAM-1阳性表达率低;模型组中ICAM-1阳性表达率较对照组显著增加(P<0.05);与模型组比较,低剂量组、高剂量组大鼠肺组织中ICAM-1阳性表达率显著下降(P<0.05),见图2。
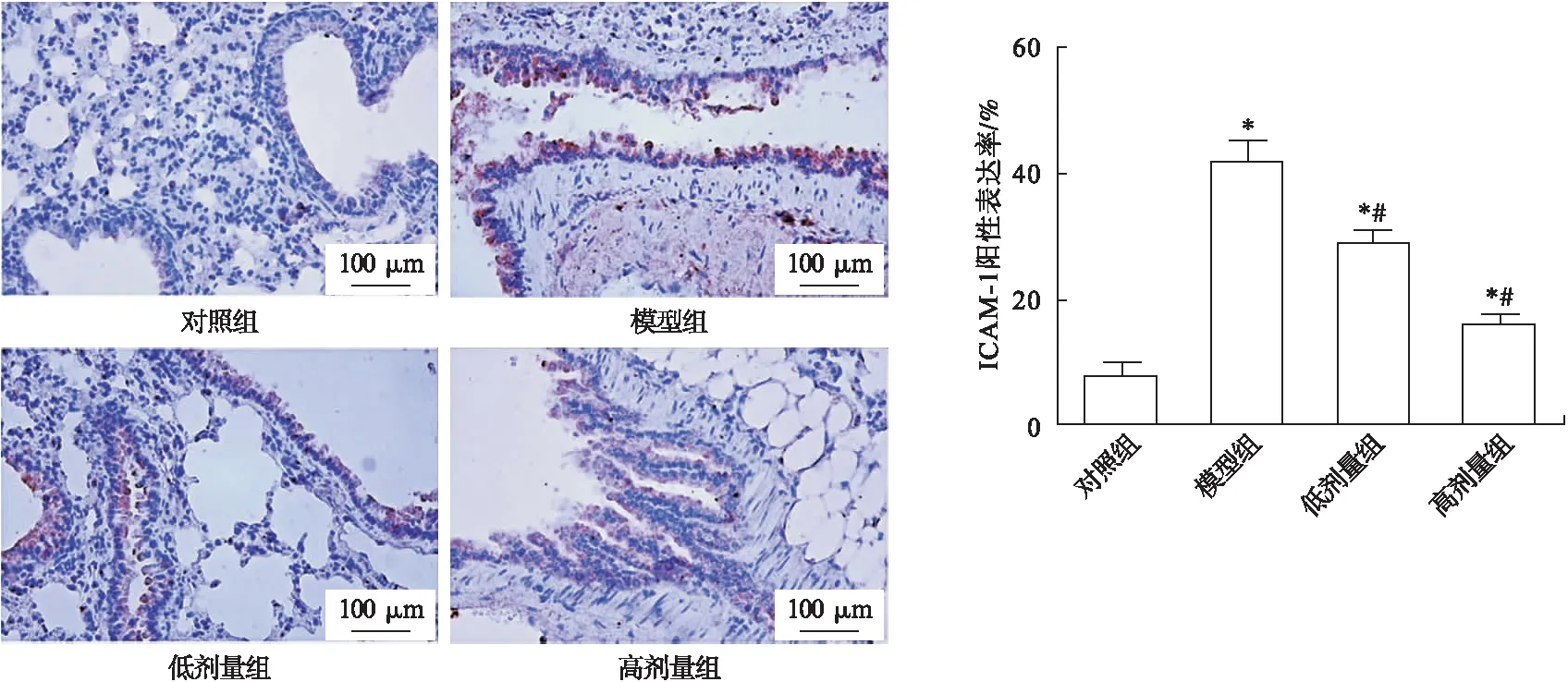
图2 免疫组化染色检测大鼠肺组织ICAM-1表达(100×)
与对照组比较,模型组大鼠肺组织中MIP-2阳性表达率显著增加(P<0.05);低剂量组与模型组之间MIP-2阳性表达率差异无统计学意义(P>0.05),而高剂量组大鼠肺组织中MIP-2阳性表达率较模型组显著下降(P<0.05),见图3。
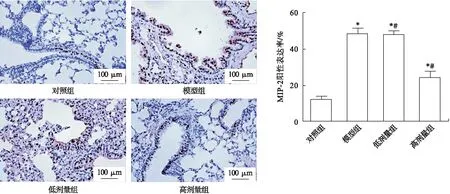
图3 免疫组化染色检测大鼠肺组织MIP-2表达(100×)
2.4 各组大鼠肺组织ICAM-1和MIP-2 mRNA与蛋白表达比较 与对照组比较,模型组与低、高剂量组大鼠肺组织中ICAM-1、MIP-2 的mRNA相对表达量和蛋白相对表达量均显著升高(P<0.05);与模型组比较,低、高剂量组大鼠肺组织中ICAM-1、MIP-2 的mRNA相对表达量和蛋白相对表达量均显著下调(P<0.05),见图4、图5。
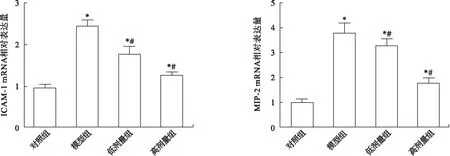
图4 qRT-PCR检测大鼠肺组织中ICAM-1、MIP-2 mRNA表达水平
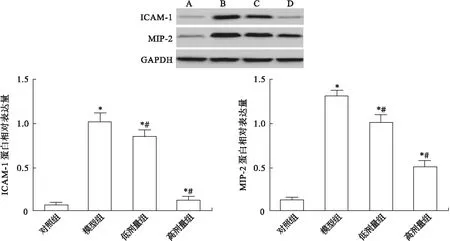
图5 Western blot检测大鼠肺组织中ICAM-1、MIP-2 蛋白表达水平
2.5 各组大鼠肺组织NF-κB p65、p65、p-IκBα 及IκBα蛋白表达比较 与对照组比较,模型组大鼠肺组织中NF-κB p65、p-IκBα蛋白相对表达量均显著升高(P<0.05);与模型组比较,低、高剂量组大鼠肺组织中NF-κB p65、p-IκBα蛋白相对表达量显著下降(P<0.05),见图6和表2。
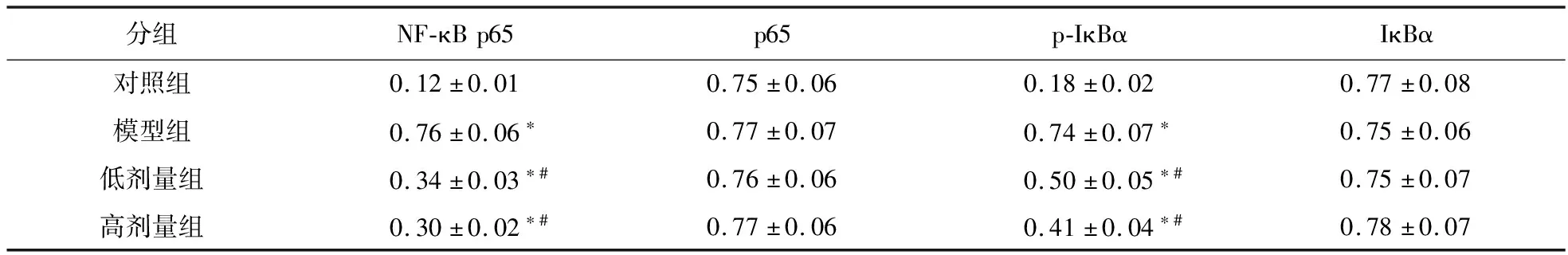
表2 各组大鼠肺组织中NF-κB信号通路相关蛋白相对表达情况(n=6)
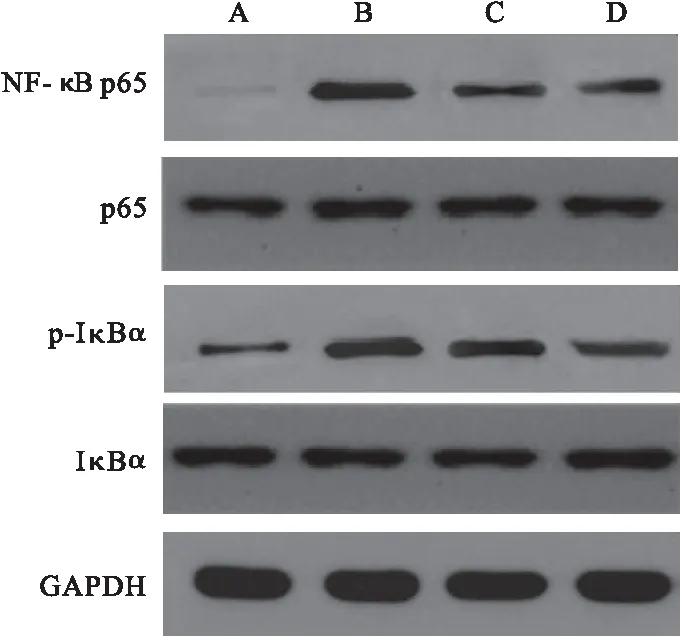
图6 Western blot检测大鼠肺组织中NF-κB信号通路相关蛋白表达
3 讨论
重症肺炎是一种常见的呼吸系统疾病,是各种传染病中死亡的主要原因,如不进行适当的治疗,可在数日内迅速引起呼吸衰竭、感染性休克甚至死亡。肺炎的严重程度取决于两个过程,即免疫抵抗和组织适应力。免疫抵抗是指宿主通过减少、杀死或清除导致感染的活菌的能力。组织适应力是指病原微生物侵入机体时,宿主对病原微生物的承受或耐受能力。其中,抵御途径是通过限制病原体或免疫抵抗途径引起的损害来减少病理生理过程[9]。肺炎克雷伯杆菌是一种革兰阴性致病菌,是肺炎常见的病原体之一,其进入下呼吸道后会引起肺泡毛细血管充血水肿,炎性细胞浸润等现象[10]。本研究通过大鼠经气管注入肺炎克雷伯菌液后发现,模型组大鼠肺组织结构受损,肺泡萎陷,腔内有血渗出,肺泡间隔断裂,可见大量炎性细胞浸润,这表明本研究中SP大鼠模型构建成功。
在本研究中,SP大鼠体内炎症反应加剧,表现为血清中促炎症因子IL-6、IL-10、TNF-α的含量升高,以及抗炎症因子IL-4的含量减少。炎症反应在SP的发生发展过程中发挥重要作用[11]。有报道,无花果叶具有抗炎作用。Che-Ahmad Tantowi等[12]的研究发现,无花果叶提取物通过抑制炎症和软骨降解酶来减轻绝经后骨关节炎的关节破坏。Zakaria等[13]的研究指出,无花果叶提取物通过抑制脂多糖诱导的小鼠急性肺损伤中的促炎细胞因子而发挥抗炎的特性。此外,Joerin 等[14]通过构建高脂血症大鼠模型,发现花果叶提取物干预6周后,可以明显下调血清三酰甘油和 IL-6 水平,从而起到降低血脂的作用。本研究结果显示,给予无花果叶提取物的大鼠,其肺组织中炎性细胞浸润现象减轻,血清中IL-6、IL-10、TNF-α的含量均下降,IL-4的含量增加,表明无花果叶提取物能够抑制SP大鼠的炎症反应,起到保护肺组织的作用。
NF-κB是慢性炎性疾病中的重要转录因子,可调节多种炎症反应,微生物产物和促炎细胞因子都可能触发NF-κB途径,并形成复杂的调控网络[15]。本研究结果显示,在注入肺炎克雷伯菌液后,大鼠肺组织内NF-κB p65、p-IκBα蛋白相对表达量均升高,同时通路相关因子ICAM-1和MIP-2表达增加,但经过一定剂量的无花果叶提取物治疗后,肺组织内NF-κB p65、p-IκBα蛋白表达受到明显抑制,并且下调了ICAM-1和MIP-2的表达。ICAM-1是免疫球蛋白样黏附分子超家族的成员,该家族介导白细胞与血管内皮的黏附,并参与多种心血管疾病,包括缺血-再灌注损伤、心肌梗死、动脉粥样硬化以及其他一些疾病的发生与发展过程[16-17]。当呼吸道受到刺激或损害时,巨噬细胞和中性粒细胞可合成并分泌MIP-2,其进一步诱导炎症因子发生浸润,同时,在NF-κB激活后,可促进MIP-2的产生[18]。结果表明,无花果叶提取物对SP大鼠肺组织的保护作用可能与抑制NF-κB信号通路的激活相关。
综上所述,无花果叶提取物能够改善SP大鼠的肺损伤程度,抑制炎症反应,其机制可能与下调ICAM-1和MIP-2的表达和抑制NF-κB信号通路激活相关,为研究无花果叶提取物在SP中的抗炎作用提供了新的思路。
