海藻中铬形态和含量的检测分析方法研究
2021-12-31蒋丽琴钟莺莺杨震峰徐新颖
蒋丽琴 蒋 立 马 侦 蔡 艳,* 钟莺莺 杨震峰 徐新颖
(1 浙江万里学院生物与环境学院,浙江 宁波 315100;2 宁波海关技术中心 浙江 宁波 315048)
近年来,随着现代工业进程的加快,大量工业废水和生活污水排入水环境中,由此造成近海养殖区域重金属污染不断加剧[1-2]。海藻主要生长和养殖在近海区域,其生长位置比较稳定、移动性差,遇到污染水质后暴污时间较长,并且对重金属的吸附积累能力强,因此极易出现重金属超标。海藻作为宝贵的海洋资源,不仅具有食用价值,深受消费者的喜爱,而且在海洋药物、功能食品、生物活性物质、动物饲料等领域也有重要的作用,具有很大的应用潜力和极高的经济价值[3-4]。
重金属铬(Cr)是海藻中普遍存在的重金属元素,其相关研究主要集中在残留量分析、污染状况评价等方面,且大都针对铬的总浓度[5-7]。而重金属元素的生理及毒性作用不仅与其总含量有关,还与其存在的形态有关。相关研究表明,生物基质中铬一部分与有机配体或蛋白结合形成结合态,另一部分以游离态存在[8-9]。游离态的Cr(Ⅲ)能促进人体葡萄糖、脂肪、蛋白质和核酸代谢,对降血糖、降血脂具有良好的作用[10];而以游离态形式存在的Cr(Ⅵ)具有较强的氧化潜力,能导致蛋白质和DNA损伤,易致癌并诱发基因突变[10-12]。铬的形态和价态不同,其毒性也存在明显差异,以铬的总量来进行评价往往会放大其对人体健康的危害,因此需要对铬的形态进行深入研究。本试验以3种海藻(海带Laminariajaponica、坛紫菜Porphyrahaitanensis、浒苔Enteromorphaprolifera)为研究对象,考察络合剂的种类和浓度、流动相的种类和浓度、pH值、温度及提取方式对海藻中Cr(Ⅲ)与Cr(Ⅵ)的影响;建立同时检测海藻中Cr(Ⅲ)与Cr(Ⅵ)形态的分析方法,以期为海藻中铬形态分析方法的建立和铬形态含量分析提供基础理论和方法支撑。
1 材料与方法
1.1 材料与试剂
3种海藻样品(福建霞浦海带、江苏昆山坛紫菜、浙江象山浒苔)购于当地超市;1 000 mg·L-1Cr(Ⅲ)标准品、1 000 mg·L-1Cr(Ⅵ)标准品,国家有色金属及电子材料分析测试中心;ProElut C18柱,北京迪马科技有限公司;吡啶-2,6-二羧酸(2,6-pyrinedicarboxylic acid,PDCA,纯度99%),美国Sigma Aldrich公司;浓硝酸(色谱纯),美国ThermoFisher Scientific公司;甲醇(色谱纯),美国TEDIA公司;乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,EDTA-2Na,分析纯)、氨水(分析纯)、过氧化氢(优级纯)、硝酸铵(分析纯)、乙酸铵(分析纯)、柠檬酸铵(分析纯),国药集团化学试剂有限公司。
PDCA-硝酸铵溶液的配制:5 mmol·L-1PDCA和50 mmol·L-1硝酸铵的混合溶液,并用氨水调节pH值至7.0。
配制0、5.0、10.0、50.0、100.0、250.0、500.0 μg·L-1的Cr(Ⅲ)和Cr(Ⅵ)混合标准溶液,用PDCA-硝酸铵溶液定容,混合标准溶液现配现用。
1.2 仪器与设备
Agilent 8800型电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometry,ICP-MS),美国Agilent科技公司;UltiMate 3000型高效液相色谱仪-ICAP Q型电感耦合等离子体质谱联用仪(high performance liquid chromatography-inductively coupled plasma-mass spectrometry,HPLC-ICP-MS)、IonPac CG5A(4 mm×50 mm)阳离子色谱柱、ST40R高速冷冻离心机,美国ThermoFisher Scientific公司;Mulitwave PRO微波消解仪,奥地利Anton Paar公司;BHW-09A24S赶酸仪,上海博通化学试剂有限公司;XS205DU分析天平、MPC 227 pH计,瑞士Mettler Toledo公司;CHORUSIa3超纯水系统,英国ELGA公司;JFSD 100粉碎机,上海嘉定粮油仪器有限公司;VORTEX-GENIE2可调速旋涡混合器,美国Scientific Industries公司;SK8210HP超声波清洗器,上海科导超声仪器有限公司;13 mm×0.45 mm水相滤膜,岛津(上海)实验器材有限公司。
1.3 样品前处理
将海藻样品(水分含量分别为:海带13.13%,紫菜14.96%,浒苔17.27%)剪碎后用粉碎机研磨粉碎,充分混匀后备用。
游离态Cr(Ⅲ)与Cr(Ⅵ)测定预处理:称取0.2 g(精确至0.000 1 g)均质后的海藻样品至25 mL容量瓶中,加入5 mmol·L-1PDCA-硝酸铵溶液(pH值7.0)定容至25 mL,40℃超声10 min,4 000 r·min-1离心10 min,取上清液,过C18柱,前2 mL滤液弃去,剩余滤液过0.45 μm滤膜后用HPLC-ICP-MS测定Cr(Ⅲ)与Cr(Ⅵ)的含量。同时做空白试验。滤液和残渣同步做总铬含量测定。
总铬测定预处理:
海藻样品总铬:称取0.2 g(精确至0.000 1 g)均质后的海藻样品于聚四氟乙烯消解罐中,加入6.0 mL浓硝酸和2.0 mL过氧化氢,放置过夜后于微波消解仪消解,微波消解条件为:10 min内由室温上升至190℃, 并保持15 min至消解结束。冷却后取出,在赶酸仪(180℃)上加热至1 mL,冷却至室温,用超纯水定容至50 mL,混匀后用ICP-MS测定。同时做空白试验。
游离态总铬(滤液):移取Cr(Ⅲ)与Cr(Ⅵ)前处理上清液10 mL,加入6.0 mL浓硝酸和2.0 mL过氧化氢,按上述方法进行微波消解后,冷却并定容,用ICP-MS测定滤液中总铬含量。
结合态总铬(残渣):将Cr(Ⅲ)与Cr(Ⅵ)预处理后残渣中加入6.0 mL浓硝酸和2.0 mL过氧化氢,按上述方法进行微波消解后,冷却并定容,用ICP-MS测定残渣中总铬含量。
1.4 条件优化
1.4.1 络合剂的选择及其浓度的优化 在均质后的海带样品中添加一定量的Cr(Ⅲ),与不同浓度(1、2、5、10 mmol·L-1)的 EDTA和PDCA-硝酸铵溶液(pH值7.0)在40℃条件下分别超声处理10、20、40、60、80、100和120 min,然后按1.3中的方法进行游离态Cr(Ⅲ) 前处理和HPLC-ICP-MS含量测定,考察络合剂类型、浓度和络合时间对Cr(Ⅲ)络合效果的影响。
1.4.2 温度和提取方式的优化 在均质后的海藻样品中加入5 mmol·L-1PDCA-硝酸铵溶液(pH值7.0),在不同温度(40、50、60、70℃)下分别超声、水浴处理提取10 min,后按1.3中的方法进行游离态Cr(Ⅲ)与Cr(Ⅵ)、游离态总铬的前处理和含量测定,考察不同温度和提取方式对Cr(Ⅲ)的络合速率、游离态总铬含量及Cr(Ⅵ) 与Cr(Ⅲ)转化的影响。
1.4.3 流动相的选择及其浓度的优化 以相同浓度的硝酸铵,乙酸铵和柠檬酸铵溶液,及不同浓度(25、50、75、100 mmol·L-1)的硝酸铵溶液作为流动相,考察流动相种类和浓度对Cr(Ⅲ)与Cr(Ⅵ)分离效果的影响。
1.4.4 流动相pH值的优化 考察不同pH值(6.0、6.5、7.0、7.5和8.0)的50 mmol·L-1NH4NO3流动相对Cr(Ⅲ)与Cr(Ⅵ)分离效果的影响。
1.5 最佳仪器进样条件
采用ICP-MS测定总铬含量,检测条件为:射频功率1 500 W,载气为高纯氩气,等离子体气流量15.0 L·min-1, 载气流量1.10 L·min-1,辅助气流量0.90 L·min-1, He碰撞模式,氦气流量4.40×10-3L·min-1,采样深度7 mm,检测质量数m/z=52。
采用HPLC-ICP-MS测定Cr(Ⅲ)与Cr(Ⅵ)含量,HPLC条件:流动相:50 mmol·L-1NH4NO3(pH值7.0,氨水调节),流速:0.5 mL·min-1;进样量:20 μL;ICP-MS条件:射频功率1 550 W,载气为高纯氩气,等离子体气流量14.0 L·min-1,载气流量:0.8 L·min-1,辅助气流量0.25 L·min-1,He碰撞模式,氦气流量4.0×10-3L·min-1, 采样深度5 mm,检测质量数m/z=52。
1.6 加标回收试验
向海带样品中分别添加不同浓度梯度(20~300 μg·L-1)的Cr(Ⅲ)和Cr(Ⅵ)标准溶液,然后按1.3的方法进行游离态Cr(Ⅲ)与Cr(Ⅵ)的加标回收率试验,各水平重复3次。
2 结果与分析
2.1 前处理与分析条件的优化与确定
2.1.1 络合剂及其浓度 游离态Cr(Ⅲ)通常以Cr3+、Cr(OH)2+、Cr(OH)2+等阳离子形式存在,Cr(Ⅵ)通常以CrO42-、Cr2O72-、HCrO4-等阴离子形式存在[11,13]。Cr(Ⅲ)配位交换的动力弱,需要络合形成稳定的阴离子才能进行测定。结果显示,EDTA和PDCA两种络合剂在超声10 min时均可实现完全络合,说明超声时间对络合效率的影响不显著;在相同浓度时,Cr(Ⅲ)与EDTA及PDCA络合物的响应值无显著差异。本试验以阳离子交换柱作为分析柱,检测时发现Cr(Ⅲ)-EDTA络合物的出峰时间较早(tR=53 s), 与死时间(t0=46 s)接近,因此,为准确定性分析,后续试验采用PDCA作为Cr(Ⅲ)的络合剂。
当PDCA络合剂浓度增加时,Cr(Ⅲ)的响应值随之增大,而当PDCA络合剂浓度达到10 mmol·L-1时,Cr(Ⅵ)的峰形变宽,分离度降低,影响Cr(Ⅲ)与Cr(Ⅵ)的分离效果。综合研究结果,选择PDCA-硝酸铵溶液作为络合剂的浓度为5 mmol·L-1。
2.1.2 温度和提取方式 由图1可知,随着提取温度的升高,游离态总铬含量略有增加,当温度达到70℃时,游离态总铬含量较40℃时增加了8.57个百分点,这可能是由于温度升高导致海藻中的结合态铬部分释放出来,转化为游离态铬;Cr(Ⅵ)转化为Cr(Ⅲ)的比例随温度上升趋势明显,当温度从40℃上升至70℃时,Cr(Ⅵ)的转化率从19.61%增加至48.15%,这与李登科等[14]的研究结果一致,表明升高温度会提高Cr(Ⅵ)的转化率。此外,试验过程中发现在相同的提取温度下,超声提取较水浴震荡处理下Cr(Ⅲ)络合的效率更高。因此,选择40℃超声对海藻样品进行前处理。
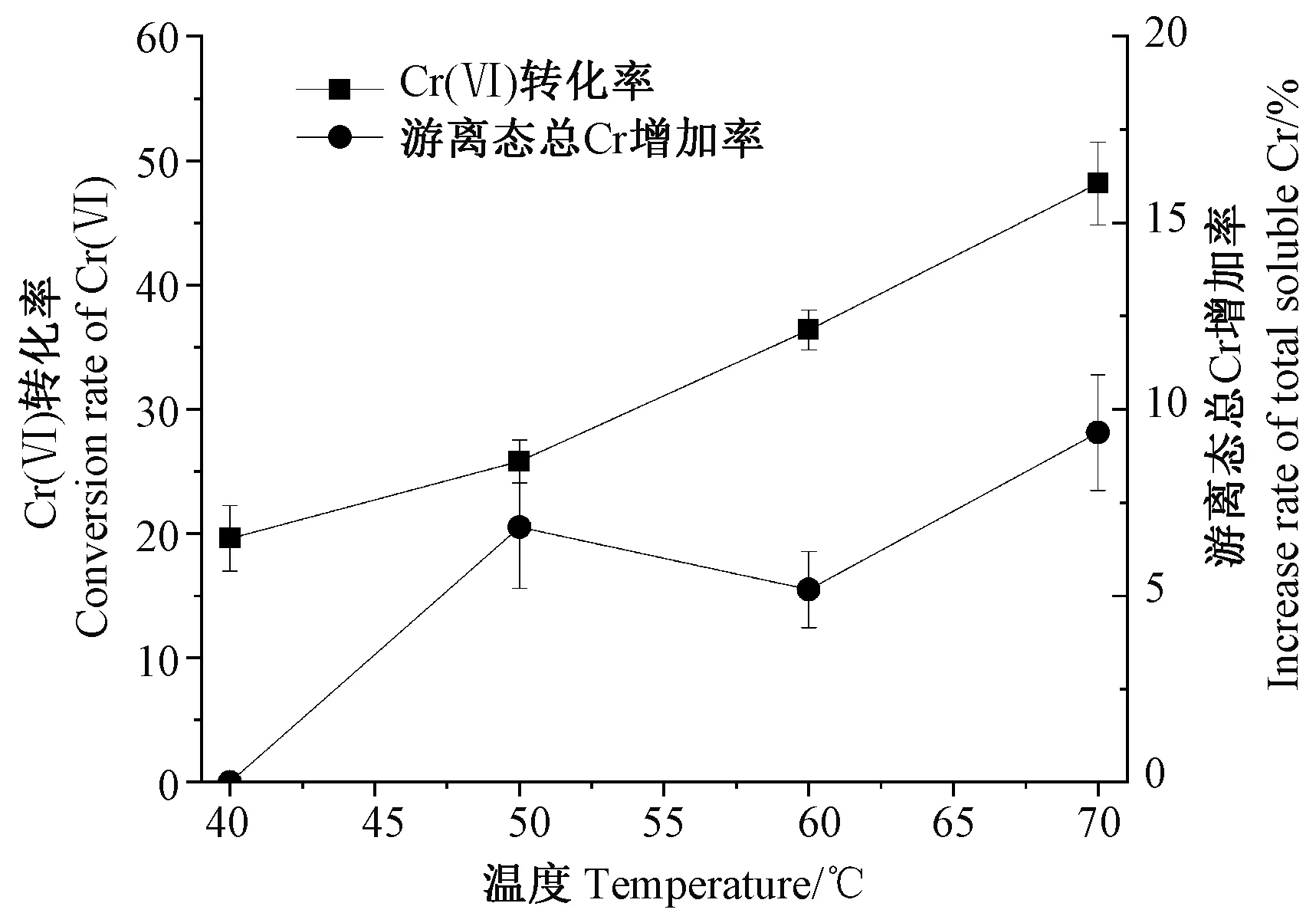
图1 温度对游离态总铬和Cr(Ⅵ)转化的影响Fig.1 Effect of temperature on the increase rate of total soluble Cr and Cr (Ⅵ) conversion
2.1.3 流动相及其浓度 试验通过HPLC-ICP-MS同时分离并检测游离态Cr(Ⅲ)和Cr(Ⅵ),因此需选择能提供分析物所需离子强度,不干扰目标分离物,以及不降低ICP离子化效率的流动相[15]。结果表明,采用乙酸铵和柠檬酸铵作为流动相时,Cr(Ⅲ)与Cr(Ⅵ)的色谱峰峰形拖尾严重,且存在相互重叠;选用硝酸铵溶液时,基线平稳,能实现Cr(Ⅲ)与Cr(Ⅵ)的有效分离。
流动相的浓度对Cr(Ⅵ)的峰形和信噪比,以及Cr(Ⅲ)和Cr(Ⅵ)的分离度有明显影响。随着硝酸铵溶液浓度的增加,色谱峰的响应值增加,而分离度随之下降,结果如图2所示。当硝酸铵溶液浓度为75和100 mmol·L-1时,分离度均小于1.5,而当浓度为25 mmol·L-1时,分析时间较长,且色谱峰的响应值较低。因此,选择50 mmol·L-1硝酸铵作为流动相溶液。
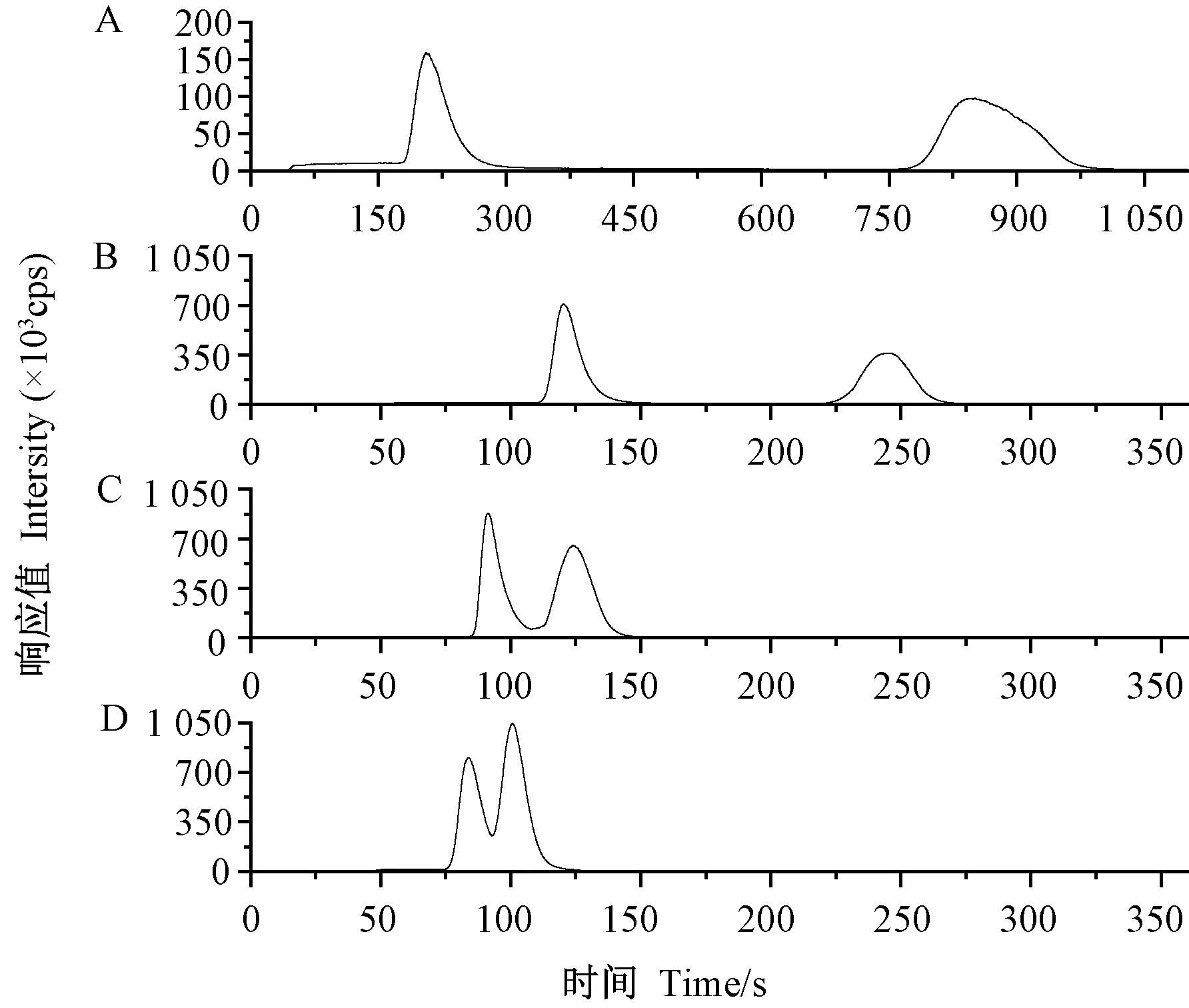
注:A:25 mmol·L-1;B: 50 mmol·L-1;C:75 mmol·L-1;D: 100 mmol·L-1。图2 流动相浓度对Cr(Ⅲ)和Cr(Ⅵ)分离度的影响Fig.2 Effect of mobile phase concentration on the resolution of Cr (Ⅲ) and Cr (Ⅵ)
2.1.4 pH值对铬形态的影响 Cr(Ⅲ)稳定存在于弱酸性环境中,Cr(Ⅵ)稳定存在于中性或弱碱性溶液中[16],因此pH值会影响Cr(Ⅲ)和Cr(Ⅵ)形态之间的转化。由图3可知,随着流动相pH值的增大,Cr(Ⅲ)与Cr(Ⅵ)的分离度呈先增后减的趋势,在pH值为7.0时,分离度达到最佳(分离度为3.14)。因此,流动相的pH值选择7.0。
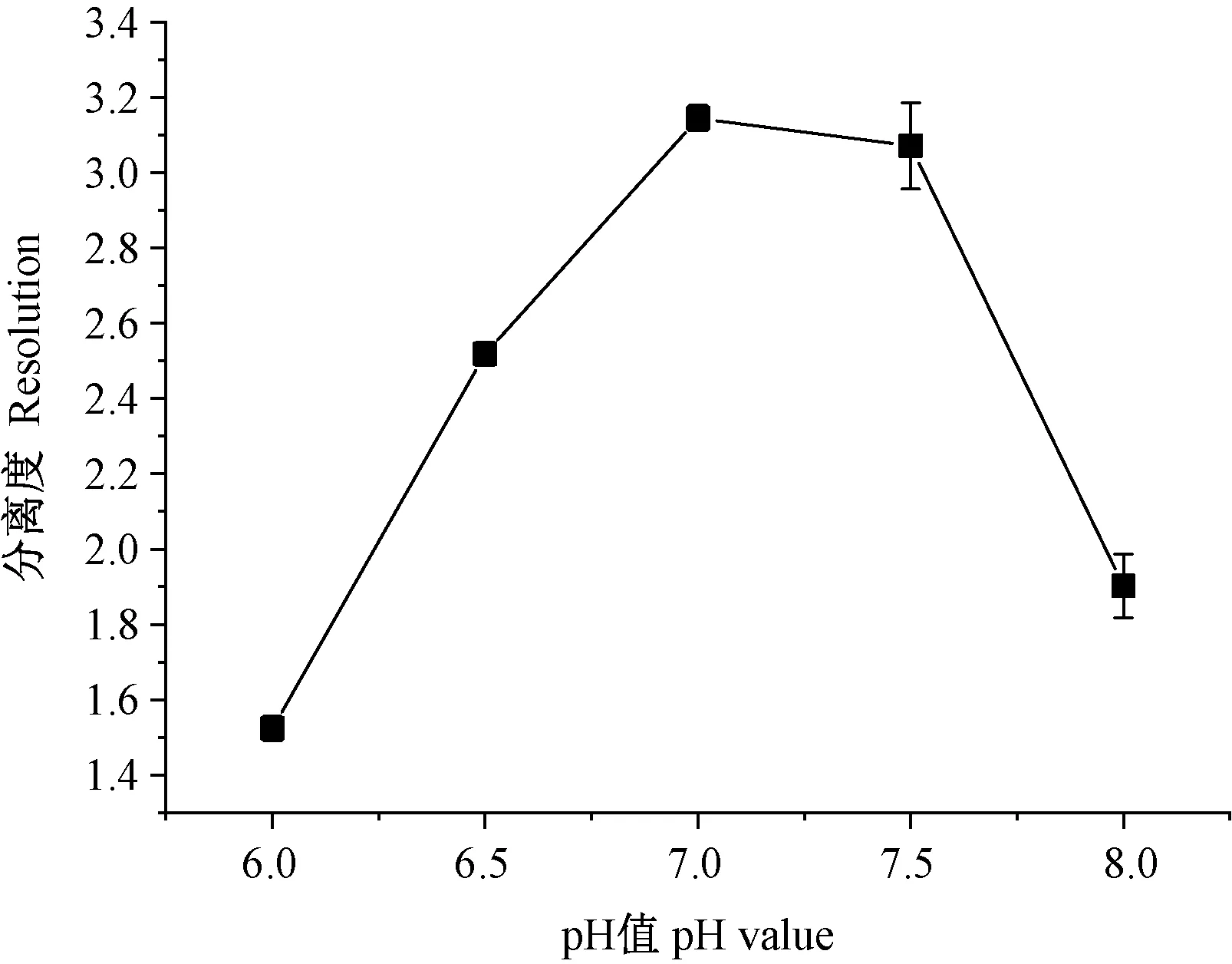
图3 不同pH值对Cr(Ⅲ)与Cr(Ⅵ)分离度的影响Fig.3 Effect of different pH value on separation of Cr(Ⅲ) and Cr(Ⅵ)
此外,由于PDCA溶液呈酸性,将其直接作为络合剂加入海藻样品中,易使Cr(Ⅵ)向Cr(Ⅲ)转化。因此,本试验通过用氨水调节PDCA-硝酸铵溶液的pH值至7.0,使海藻样品中铬形态保持在其初始形态下,从而实现对铬的各种形态进行准确定量。
2.2 工作曲线和方法检出限
由表1可知,以Cr(Ⅲ)和Cr(Ⅵ)的质量浓度X和响应值Y绘制标准曲线。其中标准曲线的线性范围在0~500 μg·L-1之间,相关系数均为0.999 9。以3倍信噪比计算检出限,得到Cr(Ⅲ)与Cr(Ⅵ)的最小质量浓度检出限分别为0.015和0.003 μg·g-1,以10倍信噪比计算定量限,得到Cr(Ⅲ)与Cr(Ⅵ)的最小质量浓度定量限分别为0.049和0.011 μg·g-1。

表1 Cr(Ⅲ) 和Cr(Ⅵ)的线性方程、检出限及定量限Table 1 Linear equations and detection limit of Cr(Ⅲ) and Cr(Ⅵ)
2.3 加标回收率测定
不同Cr(Ⅲ)含量的添加水平下,Cr(Ⅲ)的加标回收率如图4所示,当加标量为20~80 μg·L-1时,回收率在40.88%~49.75%之间;随着Cr(Ⅲ)加标量增加,Cr(Ⅲ)的回收率随之上升,当加标量增加至100~300 μg·L-1时,回收率基本稳定在71.43%~107.98%之间,相对标准偏差在0.61%~9.12%之间。
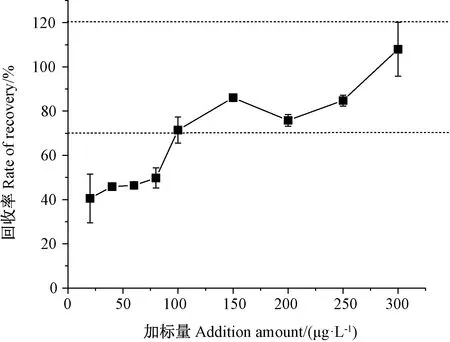
图4 不同添加水平下Cr(Ⅲ)的加标回收率Fig.4 Recoveries of Cr(Ⅲ) at different spiking levels
如表2所示,在Cr(Ⅵ)的加标回收试验中,随着Cr(Ⅵ)加标量的增加,Cr(Ⅲ)的检出含量也呈递增趋势,综合Cr(Ⅲ)和Cr(Ⅵ)的含量,Cr总回收率基本稳定在67.04%~79.48%之间。此外,对比Cr(Ⅲ)和Cr(Ⅵ)的含量发现,添加Cr(Ⅵ)的转化率在15.93%~23.51%之间,平均转化率为19.60%,说明在海藻基质中添加的部分Cr(Ⅵ)还原为Cr(Ⅲ)。
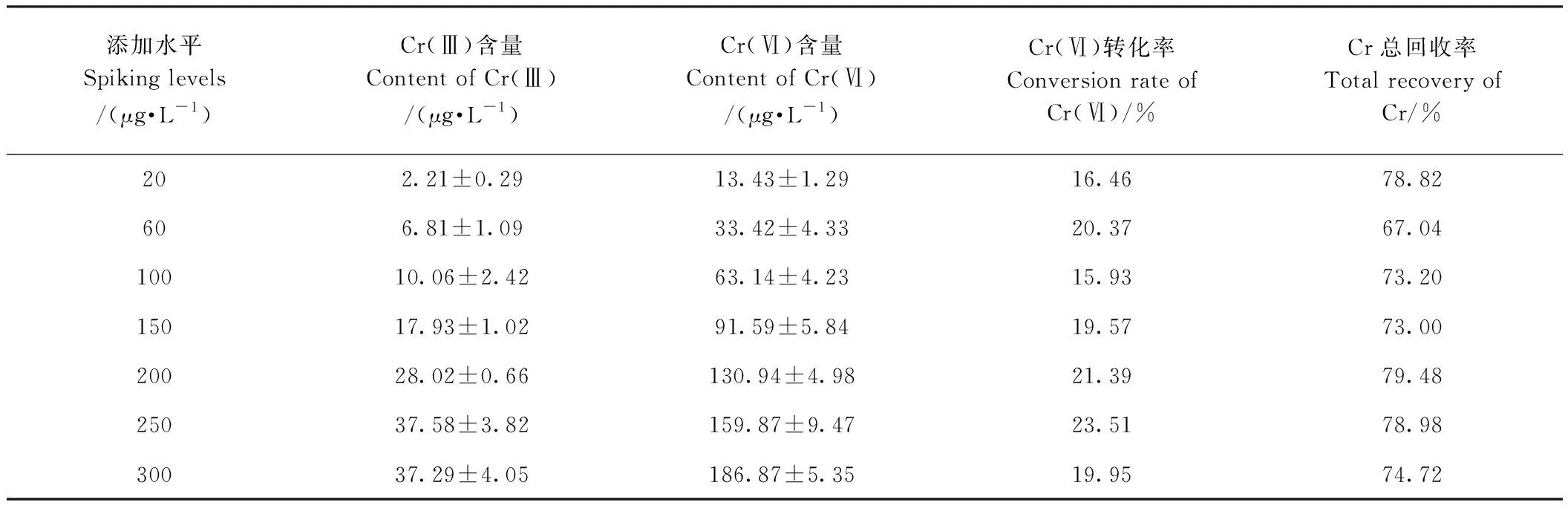
表2 Cr(Ⅵ)加标回收数据Table 2 Recovery data of Cr(Ⅵ)
2.4 实际样品的测定
由图5可知,本试验建立的方法分离度高、基线稳定,且无杂峰干扰。由表3可知,除浒苔样品中总铬含量略高于我国现行GB 2762-2017《食品安全国家标准 食品中污染物限量》[17]中总铬的限值要求(2.0 mg·kg-1) 外,海带和紫菜样品中总铬的含量均低于限值标准。在3种海藻样品中,结合态和游离态铬的含量相加与总铬含量基本相等,说明海藻中的铬主要以这2种形式存在,且以结合态铬为主,占81.12%~93.18%,其中浒苔中结合态铬的占比最高;此外,游离态铬含量与Cr(Ⅲ)含量无明显差异,说明游离态铬主要以无毒的Cr(Ⅲ)形式存在,Cr(Ⅵ)检测含量均低于检出限,表明海藻中基本不存在Cr(Ⅵ)。
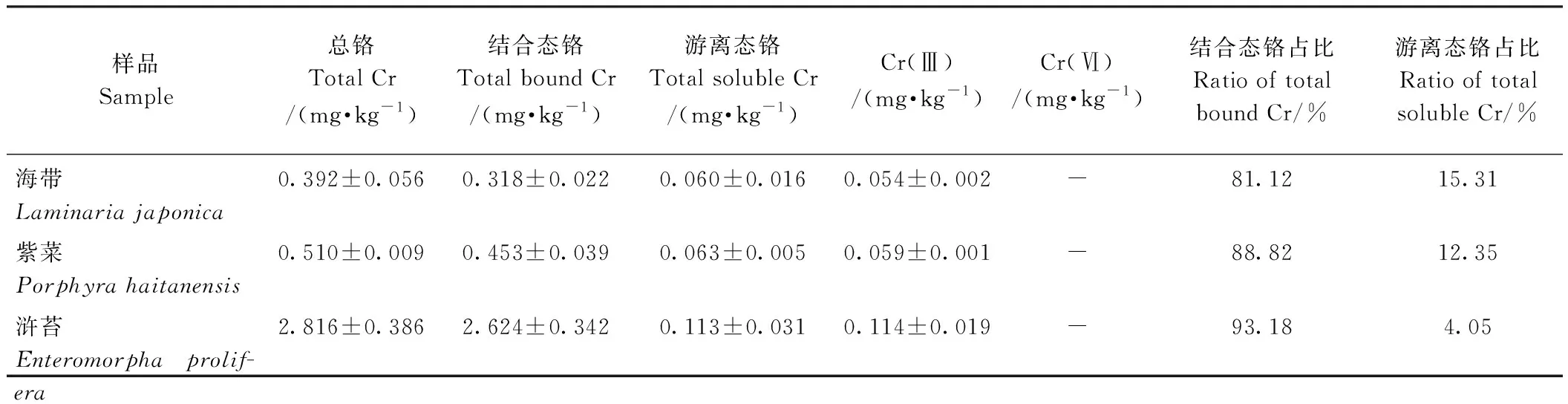
表3 3种海藻样品中铬形态含量Table 3 Chromium speciation in three seaweed samples
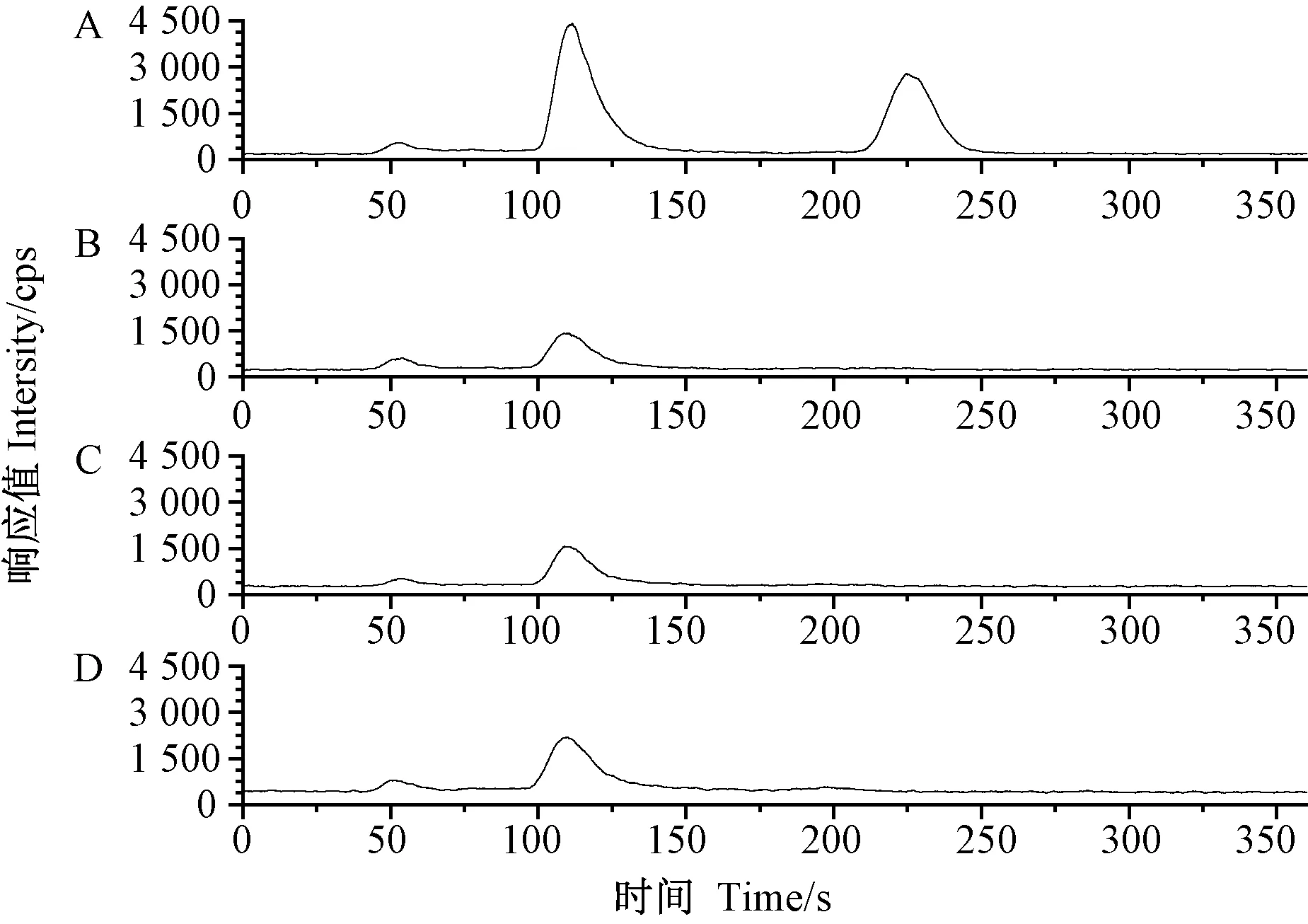
注:A:混合标准溶液;B:海带;C:紫菜;D:浒苔。Note: A:Standard solution. V:Laminaria japonica.C: Porphyra haitanensis. D:Enteromorpha prolifera.图5 Cr(Ⅲ)与Cr(Ⅵ)标准溶液和3种海藻样品色谱图Fig.5 Chromatogram of Cr(Ⅲ) and Cr(Ⅵ) in standard and three seaweed samples
3 讨论
目前,在环境样品如水样[18-20]及土壤[21-22]中Cr(Ⅲ)与Cr(Ⅵ)的形态分析研究较多,由于其基质相对简单,铬形态的转化受提取过程的影响较小;而在食品尤其是海产品中,由于样品基质复杂、干扰物质多,在提取过程中易破坏铬的初始形态从而无法对其各形态进行准确定量。樊祥等[23]和Sadeghi等[24]通过先络合样品中Cr(Ⅲ)或Cr(Ⅵ),后采用差减法获得另一形态铬的含量,无法同时测定Cr(Ⅲ)和Cr(Ⅵ)。本试验通过优化前处理条件,以中性PDCA(pH值7.0)溶液作为络合剂,中性硝酸铵溶液(pH值7.0)作为流动相,保证了提取和检测过程中铬的形态分配不发生变化,从而准确定量Cr(Ⅵ)和Cr(Ⅲ)。
本研究结果表明,在不同Cr(Ⅲ)含量的添加水平下,Cr(Ⅲ)的加标回收率存在差异,这可能是由于海藻细胞壁主要由肽聚糖、磷脂和蛋白质组成,带有一定的负电荷,有许多与金属离子结合的官能团[25-27],当加入少量Cr(Ⅲ)时(20~80 μg·L-1),部分Cr(Ⅲ)被迅速结合,形成稳定的结合态铬,而PDCA类络合剂只能络合游离态的铬,因此Cr(Ⅲ)的检出量明显低于加入量,回收率约为50%;而当Cr(Ⅲ)添加量逐渐增加时(100~300 μg·L-1),海藻中的官能团与Cr(Ⅲ)已趋于饱和,因此其回收率良好。李静等[28]在乳制品中添加0.2~0.8 mg·L-1Cr(Ⅲ),其添加量远高于本试验的添加范围,因此其回收率稳定在96.4%~102.7%之间。
在Cr(Ⅵ)加标回收试验中发现,添加Cr(Ⅵ)中约有20%转化为Cr(Ⅲ),大量研究均发现类似的转化现象,如烟草[14]、茶汤[29]、乳制品[30]等相关基质中Cr(Ⅵ)的转化率接近100%,而在鮸鱼[15]和鸡组织样品[31]中Cr(Ⅵ)的转化率分别为80%和30%。推测添加Cr(Ⅵ)的转化率不同可能由以下两方面原因导致:一是不同样品基质本身的还原性物质存在差异,二是由于EDTA/PDCA络合剂呈酸性,在样品前处理中直接加入会促使Cr(Ⅵ)向Cr(Ⅲ)转化。此外,试验还检测到一未知色谱峰,这与Lin等[32]发现的结果一致,其峰面积随Cr(Ⅵ)添加量的增加而增大,这也导致Cr(Ⅵ)的回收率略低,推测其为铬络合物的另一种形式,具体形式还有待进一步研究。
本试验结果也证实了在海藻中大部分铬呈化合态,少部分呈游离态,且Cr(Ⅲ)是游离态铬存在的主要形态。祝银等[33]在厚壳贻贝暴露研究中加入Cr(Ⅵ),发现其被转化成Cr(Ⅲ)和有机Cr,说明Cr(Ⅵ)无法长期稳定地存在于生物体内。我国现行国家标准GB 2762-2017[17]对总铬进行了限值要求(2.0 mg·kg-1), 旨在通过监控水产品中总铬含量,进而对危害人体健康的Cr(Ⅵ)含量进行限量。而海藻对金属铬虽具有较强的吸附累积能力,但其能将富集的金属离子转化为各种无毒或微毒的有机体,因此即使海藻铬总量超标,但食用海藻对人体不会构成健康风险。因此,目前尚未有因食用海藻而发生铬中毒事件的报道,这也从侧面对本试验进行了验证。
4 结论
本研究通过对络合剂的种类和浓度、流动相的种类和浓度、pH值、温度及提取方式等条件进行优化,建立了HPLC-ICP-MS法同时测定海藻中游离态Cr(Ⅲ)和Cr(Ⅵ)的方法,前处理操作简单、检出限低、精密度高,可实现对海藻样品中铬形态的快速准确分析。此外,利用ICP-MS对3种海藻中铬的不同形态进行分析,结果表明,海藻中铬主要以结合态铬和游离态铬形式存在,且结合态铬是其存在的主要形式,游离态铬以Cr(Ⅲ)为主、Cr(Ⅵ)几乎不存在。
