银杏叶提取物注射液联合丁苯酞软胶囊治疗轻型卒中的临床疗效
2021-12-31李林刘良敏
李林,刘良敏
(安阳市中医院 脑病一科,河南 安阳 455000)
轻型卒中是由血管因素引起的脑卒类型之一,该病发病时,患者临床症状较轻,神经功能损伤较小[1]。轻型卒中具有发病缓慢以及症状多样等特点,其临床主要表现是头晕、头痛、口眼歪斜、肢体感觉异常、肢体偏瘫等,影响患者日常生活。轻型卒中临床主要治疗方式为药物治疗,其中丁苯酞软胶囊属于临床治疗AIS 常用药物,其可重构缺血循环,从而发挥一定治疗效果[2]。银杏叶提取物注射液存在拮抗血小板化因子效果,能一定程度改善血流动力学,故发挥治疗效果[3]。本研究选取安阳市中医院收治的轻型卒中患者80 例作为研究对象,对丁苯酞软胶囊与银杏叶提取物注射液联合治疗轻型卒中的效果进行探究,现报告如下。
1 资料和方法
1.1 一般资料对比
本研究经伦理委员会批准。研究对象选用本院2019年2月~2021年1月期间收治的轻型卒中患者80 例,依据随机数字表法将患者分为2 组,分成研究组与对照组,各40 例。两组一般资料均衡可比(P>0.05),详见下表1。
表1 一般资料对比(± s ,例)Table 1 Comparison of general data (± s , case)
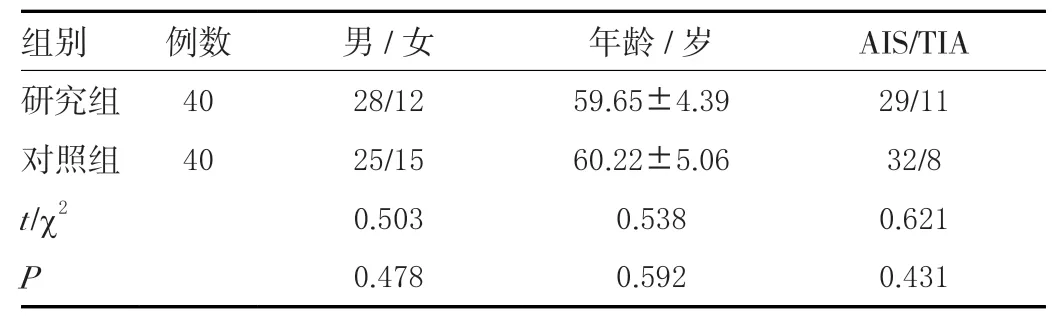
表1 一般资料对比(± s ,例)Table 1 Comparison of general data (± s , case)
组别 例数 男/女 年龄/岁 AIS/TIA研究组 40 28/12 59.65±4.39 29/11对照组 40 25/15 60.22±5.06 32/8 t/χ2 0.503 0.538 0.621 P 0.478 0.592 0.431
1.2 纳入标准及排除标准
纳入标准:年龄>18 岁者;入院时美国国立卫生院神经功能缺损评分(NIHSS) 评分≤5 分者;通过MRI、CT 等检查诊断为脑卒中者;发病到救治时间<4.5 h 者;患者均了解研究内容并签署知情同意书。
排除标准:存在缺血性脑卒中病史者;患有颅内血肿;患有脑部肿瘤;动脑补脉瘤≥10 mm;CT 平扫结果显示脑梗死累及脑叶者;患者具有血液异常;患有凝血功能障碍以及抗凝血疾病者;心肝肾等功能严重不全者;患者处于哺乳期或孕期;近3 个月存在头部重大外伤史者;经3 个月存在心肌梗死病史者。
1.3 方法
两组均行降颅压、神经保护、吸氧、对症支持、抗血小板凝聚等常规治疗。
对照组患者每次2 粒,每天3 次服用丁苯酞软胶囊进行治疗(国药准字H20050139,恩必普药业有限公司,规格:0.1g),持续用药8 d。
研究组取70 mL 银杏叶提取物注射液( 注册证号X20010117,Dr.Willmar Schwabe GmbH, 规 格:17.5 mg/5 mL),加入250 mL 生理盐水中,静脉滴注,每天1 次,再服用对照组等同计量的丁苯酞软胶囊,持续用药8 d。
1.4 观察指标
(1) 统计比较治疗前后患者NIHSS 评分[4]。评估患者神经受损状况,量表包括意识水平、运动、语言能力等方便,总分为42 分,由医生进行评估,分值越低,表明神经功能损伤越轻。。
(2) 统计对比两组治疗前后血清炎性因子水平:即白细胞介素-6(IL-6)、超敏-C 反应蛋白(hs-CRP) 血清含量。于患者空腹状态下,取外周静脉血5 mL,离心(转速:3 500 r/min,10 min,离心半径12 cm) 取上清液,经酶联免疫吸附法检测,试剂盒由江西艾博因生物科技有限公司提供。
(3) 统计对比两组治疗前后血液流变学指标,即血浆、全血高切黏度及全血低切的黏度、血小板聚集情况、红细胞比容等。取上述离心后提取的上清液,采用血液分析仪对上述指标进行检查。
(4) 统计对比两组治疗前后一氧化氮(NO)、内皮素(ET) 水平。血管内皮功能,取上述离心后提取的上清液,经采用比色法测NO、ET 血清含量,该检测所用相关试剂及标准,均由江蓝纯生物试剂有限公司(江西)提供。
(5) 记录两组治疗过程中不良反应发生情况。
1.5 统计学方法
采用SPSS 22.0 统计学软件处理数据,计数资料以n(%) 表示,行χ2检验,计量资料采用±s表示,行t检验,P<0.05 表明差异有统计学意义。
2 结 果
2.1 两组神经缺损状况对比
治疗前,两组NIHSS 评分对比,差异无统计学意义(P>0.05);治疗8 d 后,两组NIHSS 评分均降低,且研究组低于对照组(P<0.05),见表2。
表2 两组神经缺损状况对比(± s ,分)Table 2 Comparison of nerve defects between the two groups (± s , points)
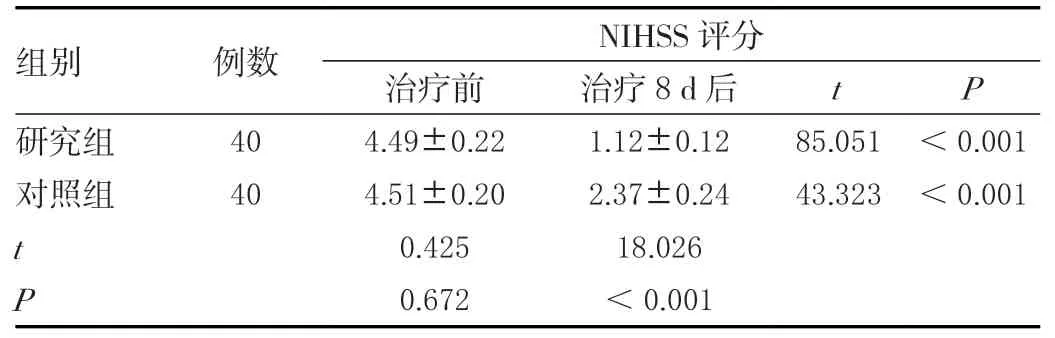
表2 两组神经缺损状况对比(± s ,分)Table 2 Comparison of nerve defects between the two groups (± s , points)
组别 例数 NIHSS 评分治疗前 治疗8 d 后 t P研究组 40 4.49±0.22 1.12±0.12 85.051 <0.001对照组 40 4.51±0.20 2.37±0.24 43.323 <0.001 t 0.425 18.026 P 0.672 <0.001
2.2 两组血清炎性因子水平对比
两组治疗前血清hs-CRP、IL-6 水平对比,差异无统计学意义(P>0.05);治疗8 d 后两组血清hs-CRP、IL-6 水平均降低(P<0.05),且研究组比对照组低(P<0.05),见表3。
表3 两组血清炎性因子水平对比(± s )Table 3 Comparison of serum inflammatory factor levels between the two groups (± s )
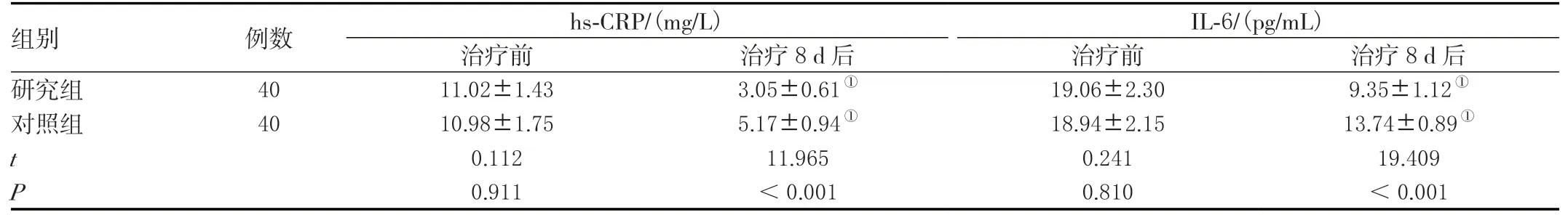
表3 两组血清炎性因子水平对比(± s )Table 3 Comparison of serum inflammatory factor levels between the two groups (± s )
注:与治疗前的同组比较,①P <0.05。
组别 例数 hs-CRP/(mg/L) IL-6/(pg/mL)治疗前 治疗8 d 后 治疗前 治疗8 d 后研究组 40 11.02±1.43 3.05±0.61① 19.06±2.30 9.35±1.12①对照组 40 10.98±1.75 5.17±0.94① 18.94±2.15 13.74±0.89①t 0.112 11.965 0.241 19.409 P 0.911 <0.001 0.810 <0.001
2.3 两组血液流变学指标对比
两组治疗前血浆黏度、全血高切黏度、全血低切黏度、红细胞比容、血小板聚集率对比,差异无统计学意义(P>0.05);治疗8 d 后,两组血浆黏度、全血高切黏度、全血低切黏度、红细胞比容、血小板聚集率均降低,且研究组低于对照组(P<0.05),见表4。
表4 两组血液流变学指标对比(± s )Table 4 Comparison of hemorheological indexes between the two groups (± s )
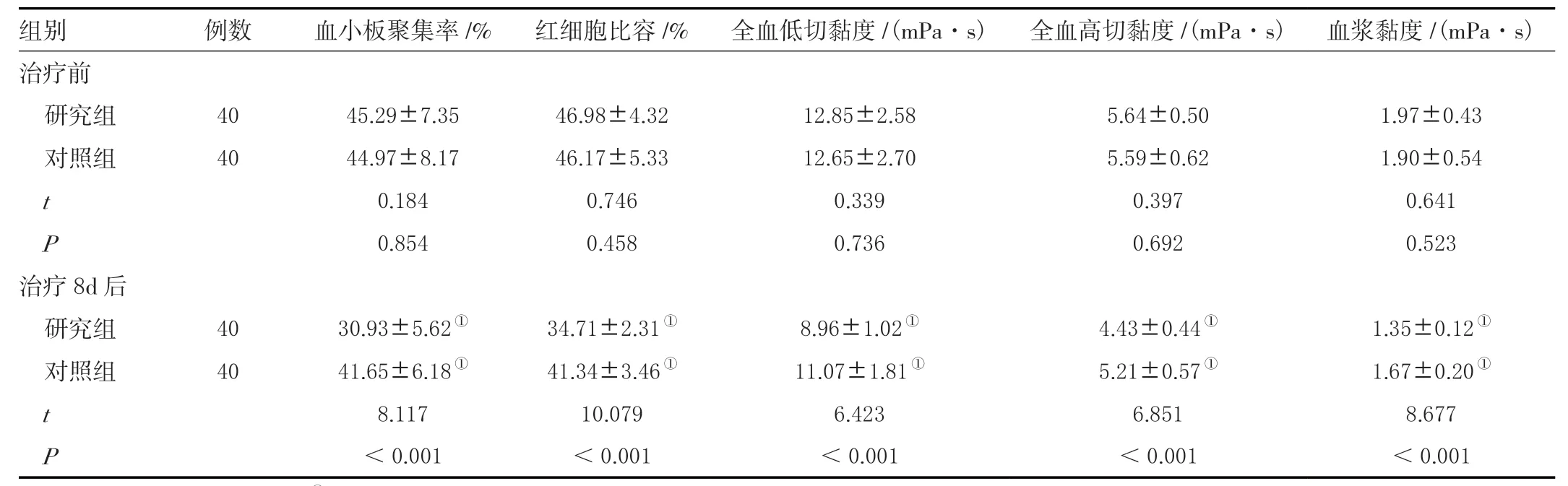
表4 两组血液流变学指标对比(± s )Table 4 Comparison of hemorheological indexes between the two groups (± s )
注:与治疗前的同组比较,①P <0.05。
组别 例数 血小板聚集率/% 红细胞比容/% 全血低切黏度/(mPa·s) 全血高切黏度/(mPa·s) 血浆黏度/(mPa·s)治疗前研究组 40 45.29±7.35 46.98±4.32 12.85±2.58 5.64±0.50 1.97±0.43对照组 40 44.97±8.17 46.17±5.33 12.65±2.70 5.59±0.62 1.90±0.54 t 0.184 0.746 0.339 0.397 0.641 P 0.854 0.458 0.736 0.692 0.523治疗8d 后研究组 40 30.93±5.62① 34.71±2.31① 8.96±1.02① 4.43±0.44① 1.35±0.12①对照组 40 41.65±6.18① 41.34±3.46① 11.07±1.81① 5.21±0.57① 1.67±0.20①t 8.117 10.079 6.423 6.851 8.677 P<0.001 <0.001 <0.001 <0.001 <0.001
2.4 两组血管内皮功能对比
两组治疗前血清ET、NO 水平对比,差异无统计学意义(P>0.05);治疗8 d 后,两组血清ET 水平均降低(P<0.05),且研究组比对照组低(P<0.05);治疗8 d 后,两组血清NO 水平均升高(P<0.05),且研究组比对照组高(P<0.05),见表5。
表5 两组血管内皮功能对比(± s )Table 5 Comparison of vascular endothelial function between the two groups (± s )

表5 两组血管内皮功能对比(± s )Table 5 Comparison of vascular endothelial function between the two groups (± s )
注:与治疗前的同组比较,①P <0.05。
组别 例数 ET/(ng/L) NO/(U/mL)治疗前 治疗8 d 后 治疗前 治疗8 d 后研究组 40 116.91±12.42 54.84±6.71① 36.83±5.34 63.47±7.02①对照组 40 114.97±11.69 85.92±7.93① 37.95±5.15 55.46±6.85①t 0.719 18.923 0.955 5.165 P 0.474 <0.001 0.343 <0.001
2.5 两组的安全性对比
治疗过程中,对照组中1 例恶心、1 例转氨酶升高、1 例皮疹,不良反应发生率为7.50%(3/40),研究组中1例恶心、1 例呕吐、2 例转氨酶升高、1 例皮疹,不良反应发生率为12.50%(5/40),两组治疗过程中不良反应发生率相比差异无显著性差异(χ2=0.556,P=0.456)。
3 讨 论
轻型卒中为颅内脑组织供血动脉出现闭塞之后颅内血液循环出现障碍,致使局部脑组织出现坏死、缺血等系列病理生理改变,并伴神经元、星形胶质细胞以及少突胶质细胞损伤,最终引起神经功能损伤综合征。因脑细胞缺血死亡无法逆转,一旦缺血面积较大时,病死率可得到提高,但患者神经功能会受到不同程度的缺损,继而影响患者生活质量[5]。因此需采取积极有效防治 措施。
本研究结果显示,治疗后两组NIHSS 评分低于治疗前,且研究组低于对照组,提示丁苯酞软胶囊联合银杏叶提取物注射液对于轻型卒中具有一定的疗效,并可改善神经缺损状况。丁苯酞软胶囊能抑制花生四烯酸与其代谢物介导病理生理过程,阻滞形成血栓,缓解微血管痉挛,减少梗死面积,且其可直接作用到脑线粒体,并保护线粒体免受损伤,促进脑部血液循环,优化神经功能缺损,此外,可提高微血管血量,建侧支循环,提高缺血区域的血流量,缓解缺血状况,进而改善临床症状[6-7]。银杏叶含有银杏黄酮甙以及银杏苦内酯等多个活性成分,具备改善脑血液循环、抗氧化、清除自由基、保护血管功能等多个作用,促进缺血血管的再灌注,减缓缺血组织坏死,并逆转缺血神经元作用,进而起到改善神经缺损效果[8], 故采用苯酞软胶囊联合银杏叶提取物注射液治疗轻型卒中,疗效显著,并可改善神经缺损状况。
本研究还从多个方面分析两药联合应用效果。相关研究显示[9],血液黏滞度增加,可减缓血液流速,同时增加血流阻力,降低微循环中血液灌流,增加血管中缺血损伤,尤其是血流缓慢可促进血小板聚集,提高血液凝固性,加快血栓产生,促进脑卒中病情进展。此外血管内皮损伤可刺激凝血因子,引发血小板凝聚,进而引发血液流变紊乱,产生高凝状况,进一步促进病情进展[10]。本研究中,研究组血液流变学指标水平低于对照组,NO 血清水平高于对照组,可知联合治疗能够使血管内皮功能得以改善,加速脑部血液的流动。缺血脑卒中发病之后,脑内神经递质出现紊乱,而紊乱神经递质可过度释放氧自由基、异常表达炎性因子等,继而加剧临床症状[11-12],而血清IL-6、hs-CRP 为敏感性较高炎性反应指标,其水平升高可加剧血管内皮损伤、脑组织细胞缺血氧,加剧病情进展[13-14]。相关研究指出[15-18],银杏叶提取物注射液主要成分包括银杏黄酮、萜烯内酯(含有银杏内酯与白果内酯) 等,其中银杏黄酮清除广谱自由基效果较好,能够清除卒中患者疾病损伤过程中的出现的络合铁离子、氧化自由基等,最终达到脑保护的目的;白果内酯可对氧化磷酸化脱藕联反应产生一定的抑制作用,可减轻钙离子超载,有助于血管舒张,利于机体恢复血液循环功能;银杏内酯能够拮抗血小板活化因子受体,能够对血栓的形成产生一定的抑制作用,此外银杏叶提取物注射液可抑制机体的炎症反应。本研究结果显示,治疗后研究组hs-CRP、IL-6 血清水平低于对照组,说明联合治疗可抑制炎性反应,利于病情转归。此外,本研究结果显示,治疗过程中对照组中3 例不良反应、研究组中5 例不良反应,两组不良反应症状轻微,且两组不良反应发生率对比,差异无统计学意义,提示银杏叶提取物注射液、丁苯酞软胶囊联合用药治疗轻型卒中患者安全可靠。
综上所述,采用银杏叶提取物注射液、丁苯酞软胶囊联合用药能够改善轻型卒中患者神经缺损,增强血管内皮功能,优化血液循环,同时减轻炎性反应,且安全可靠。然而,本研究选取例数有限,且为单中心研究,研究结果可能存在一定的偏差,后续可扩大样本量进行多中心研究来验证本研究结论。
