超小体积肿瘤立体定向放疗计划的点剂量测量方法
2021-12-31陈元华陆中杰
陈元华 陆中杰
(浙江大学医学院附属第一医院放射治疗科 杭州 310003)
立体定向放射外科(SRS)通过对病变部位给予单次大剂量照射以达到外科手术类似的效果,大量研究肯定了它在治疗良性和恶性病变[1-3]以及功能性疾病方面的临床作用[4-5]。立体定向体部放疗(SBRT)则对肿瘤施以很少几个分次的大剂量照射来提升治疗效果,其生物效应与SRS类似[6]。相较于低分次剂量的放射治疗模式,立体定向放射治疗(SRT,包括SRS 和SBRT)在技术、生物以及临床上均存在优势[7-11]。随着直线加速器(LINACs)精度的显著提高[12],加上多种图像引导技术的临床应用,放射治疗的精确度也越来越高[13-14]。目前,基于直线加速器的立体定向放射治疗在欧美国家已被广泛应用,在国内的接受度也越来越高。
相较于常规放疗(1.8~2.2 Gy/次),SRT 的主要特点是分次剂量很高,治疗计划在实施时存在更大的潜在安全风险,每一个SRT 计划在执行之前都必须通过剂量学验证[15]。而对于超小靶体积的SRT 计划,需要执行更加严格的质控以确保治疗安全有效地实施。
绝对点剂量的测量是放疗计划剂量学验证的重要项目,但目前针对超小靶体积的点剂量测量却存在一些困难。第一,点剂量测量的前提是电离室探头的灵敏体积相对于靶体积要小到足以将其视为一个点。对于靶区等效球体直径小于3 cm的病例,不宜再使用标准电离室进行测量。第二,微型电离室具备较好的点特性,但其信噪比低、稳定性较差,而且国内的标准校准实验室一般也不提供微型电离室的校准因子。本研究旨在确立一个稳定且准确的超小靶体积点剂量测量方法。
1 设备与方法
1.1 计划案例
实际临床中超小靶体积SRT 在所有SRT 病例中所占比率较小,本研究共包括10 个相关的计划案例,每周测量一个,共延续10 周。将案例按时间先后顺序进行编号,10 个计划的计划靶体积(PTV)参数如图1所示。PTV体积最小值为2.03 cm3,中位值为3.86 cm3,平均值为5.45 cm3,最大值为12.10 cm3;PTV 等效球直径最小值为1.60 cm,中位值为1.95 cm,平均值为2.09 cm,最大值为2.80 cm。所有临床计划和验证计划均由Eclipse 计划系统(TPS)设计。

图1 所选10个测量案例的PTV体积及其等效球直径分布Fig.1 Distribution of PTV volumes and their equivalent sphere diameters for the 10 selected cases
1.2 验证设备
验证设备包括4 个部分,如图2 所示。图2(a)为SuperMAXTM参考级独立双通道静电计:可独立控制量程、偏置电压和系统因子,测量量程0.001 pA~0.500 μA,0.001 pC~1.000 mC,具备触摸屏界面和一系列高级测量功能。该静电计的读数可以显示为电荷量,也可以显示成吸收剂量。本研究中静电计读数显示为电荷量,计量院给出的吸收剂量校准因子为NC。图2(b)为Exradin A19 典型标准指形电离室:有效电荷收集体积0.620 cm3,探头长度2.62 cm,包壳外径0.71 cm,内径0.61 cm,厚度0.05 cm,中心电极长度1.30 cm,直径0.10 cm。A19 电离室使用方便,剂量测量时的扰动小。图2(c)为Exradin A16 微型电离室:有效电荷收集体积0.007 cm3,探头长度0.35 cm,包壳外径0.34 cm,内径0.24 cm,厚度0.05 cm,中心电极长度0.17 cm,直径0.03 cm。A16 微型电离室可以测量的最小射野面积可达0.34 cm×0.34 cm,非常适合超小靶体积SRT计划的点剂量测量。图2(d)为立体定向剂量验证模体:由3块水等效蓝水模体构成,密度1.09 g/cm3,总重4.40 kg,整体尺寸20 cm×20 cm×10 cm。中间的电离室板钻有一个空腔,把与微型电离室或标准电离室适配的插件插入空腔,可以将电离室探头准确置于模体的正中心。该模体精巧轻便,便于搬运、摆位和精确测量。

图2 点剂量测量设备:(a)静电计;(b)A19指形电离室;(c)A16微型电离室;(d)立体定向剂量验证模体Fig.2 Point dose measuring equipment:(a)superMAX electrometer;(b)A19 farmer chamber;(c)A16 micro chamber;(d)stereotactic dose verification phantom
1.3 验证准备
预先对插有A16 微型电离室及套管(图1(b))的立体定向模体(图1(d))实施CT模拟扫描。扫描时“铅点”贴在模体左、右及上表面的白色十字线交叉点上,用于确定CT影像上的参考等中心。模体CT影像按0.1 cm层厚重建后导入计划系统,在计划系统中勾画出模体外轮廓Body和电离室的灵敏体积Chamber,同时在CT 影像上确定参考等中心点ISO。验证计划创建时仅需在TPS中将原计划CT替换成模体CT影像并完成剂量计算,然后记录计划系统计算出的Chamber的平均剂量DTPS。
1.4 交叉校准
在交叉校准测量方法用于实际临床测量前,要确保标准电离室跟微型电离室在它们公共有效测量射野范围内有良好的线性。将微型电离室和标准电离室插入图1(d)蓝水模体中分别进行射野线性和剂量线性测量。射野线性在源皮距(SSD)为100 cm,射野大小分别为1 cm×1 cm、2 cm×2 cm、…、10 cm×10 cm 条件下出束100 MU 进行测量。剂量线性在SSD为100 cm,射野大小10 cm×10 cm 条件下,分别出束100 MU、300 MU、500 MU、700 MU、900 MU和1 100 MU进行测量。
所有测量均在静电计开机预热15 min后进行,交叉校准条件为SSD 为100 cm,射野大小10 cm×10 cm,出束100 MU。本底收集并归零后先出束100 MU,但不记录数据。然后用标准电离室和微型电离室分别进行3次测量,记录数据并用3次结果的平均值来计算交叉校准因子(Crosscalibration factor,Fcc)。Fcc的计算公式如式(1)。

式中:MˉStd是标准电离室读数的平均值;Mˉmicro是微型电离室读数的平均值。
1.5 绝对点剂量测定及误差计算
本研究中所有超小肿瘤临床SRT 计划的点剂量都用微型电离室来测量。测量完成后记录静电计的读数Mmicro,然后通过实时交叉校准因子Fcc将微型电离室的读数Mmicro换算成标准电离室的读数MStd。最后再通过标准电离室的绝对剂量校准因子NC计算出模体内选定点的绝对吸收剂量DStd,并计算计划系统给出的理论值DTPS与实际测量值Dstd之间的剂量偏差ED。具体计算公式定义如(2)~(4)式。
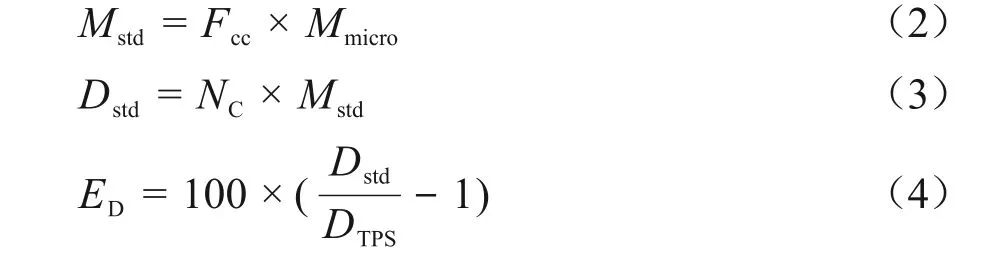
最后,用所有10 周Fcc的平均值(),对各周的绝对点剂量(D'std)及其对应的剂量误差(E'D)进行重新计算,并与之前的实时测量结果进行比较分析,具体公式如(5)~(7)式。
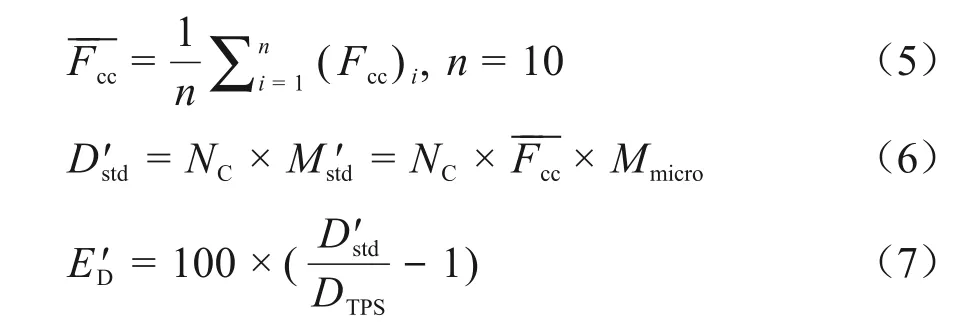
2 结果
同一较短测量时段内,标准电离室和微型电离室的剂量线性如图3(a)所示。标准电离室测量值的线性拟合优度R2=1,而微型电离室测量值的线性拟合优度R2=0.998,二者均具有很好的剂量响应线性。图3(b)显示的是SSD 为100 cm、机器跳数为100 MU条件下,标准电离室和微型电离室的读数与方形照射野边长之间的关系(数据已用各自10 cm×10 cm射野读数归一化)。可以看到,射野面积减小时标准电离室和微型电离室的读数均会随之下降,当方形射野的边长小于3 cm 时,二者读数会显著下降。当射野边长等于2 cm和1 cm 时,标准电离室(A19)的读数分别下降到其10 cm×10 cm 射野条件下读数的66.37%和31.31%,而微型电离室(A16)的读数分别下降到其10 cm×10 cm 射野读数的34.92%和2.95%。图3(c)显示的是Fcc与方形照射野边长之间的关系。方形射野的边长在3~10 cm时,Fcc稳定在0.082 4±0.000 3,而当射野边长小于3 cm 时,Fcc急剧增加。
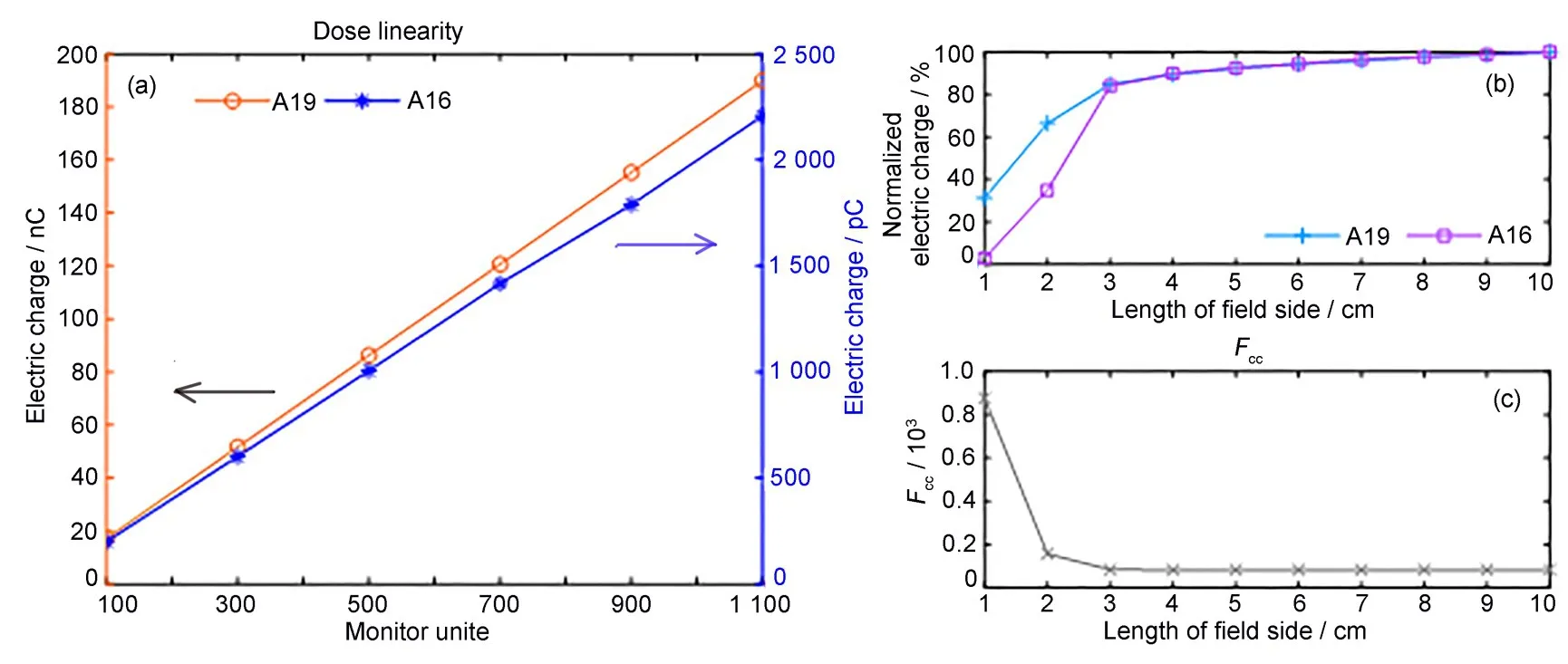
图3 标准电离室和微型电离室的(a)剂量线性、(b)射野线性以及(c)标准电离室和微型电离室之间的Fcc线性Fig.3 (a)Dose linearity and(b)field output linearity of the farmer chamber and the micro chamber,and(c)linearity of Fcc between the farmer chamber and the micro chamber
在延续10 周的较长时段内,标准电离室和微型电离室在SSD 为100 cm、射野大小10 cm×10 cm、加速器跳数为100 MU条件下,3次测量读数平均值的时间稳定性如图4(a)所示,图中数据已用平均值进行归一化处理。可以看到随着时间的推移,标准电离室读数始终在其平均值±1%以内;而微型电离室的读数有4/10超出其平均值±3%,5/10 超出其平均值±2%。10 周时间内按均值归一化的Fcc如图4(b)所示,可以看到Fcc有4/10超出其平均值±3%,其偏差主要受微型电离室读数波动性的影响。以实时Fcc和计算出的绝对剂量误差分布如图4(c)所示,用实时Fcc计算出的绝对点剂量偏差ED均在±3%以内,且有8/10不超出±2%。而用计算出的结果E'D则有2/10 超出±3%,仅5/10在±2%内。

图4 (a)标准电离室和微型电离室的时间稳定性;(b)Fcc随时间的波动性;(c)实时Fcc和Fcc计算出的点剂量误差分布Fig.4 (a)Temporal stability of the farmer chamber and the micro chamber;(b)Fluctuation of Fccover time;(c)point dose error distribution calculated using real-time Fccand mean Fcc
3 讨论
对于体积较大的肿瘤,为了保护正常组织,一般采用单次剂量1.8~2.2 Gy 的常规剂量照射[16]。对于体积较小的肿瘤,采用低分次大剂量照射(单次剂量5 Gy 以上),可以在提高肿瘤控制率的同时,增强对肿瘤周围正常组织的保护。需要注意的是,针对超小体积的肿瘤,由于受到小野测量的限制[17-19],大多数放疗中心的计划系统针对小野的剂量计算模型都不够准确。因而,如果开展超小体积肿瘤放疗,则放疗前的临床计划验证对放疗安全和剂量评估都必不可少。
为了获得更好的生物效应,SRT的单次剂量都在6 Gy 以上。更高的单次剂量伴随着更高的潜在安全风险,所以从这个角度来讲,SRT计划在用于临床治疗之前也必须要完成严格的剂量学验证。剂量学验证旨在确保实际投照到患者体内的真实空间剂量与计划系统理论计算的空间剂量之间的偏差在规定的容差范围之内。在临床实践中,用单一设备测量绝对空间剂量难以实现,通常会用一维绝对点剂量配合二维相对面剂量或三维相对体剂量来间接测量。对于SRT 计划,绝对剂量验证和相对剂量验证均应进行,即使有研究报道指出胶片剂量计可以测量二维绝对面剂量[16,20],但因其结果会受到很多因素的影响,仍不宜完全取代绝对点剂量测量。
标准指形电离室是测量绝对点剂量的标准设备,不仅信噪比高、性能稳定,而且可以定期送往国家标准剂量实验室进行校准。由图3(b)可知,当方野边长大于3 cm 时,标准指形电离室都可以准确测出模体内的剂量。因而,对于等效球体直径大于3 cm 的肿瘤,仍推荐采用标准指形电离室进行绝对剂量测量,因为直接用标准电离室测量操作更加方便。对于等效球体直径小于3 cm的肿瘤的点剂量测量,标准指形电离室已不再适用,采用微型电离室更为恰当。然而,在放疗中这类肿瘤病例并不常见,因此,本研究经过长期累积仅得到10 例肿瘤等效球体直径小于3 cm 的样本。
为解决微型电离室信噪比低、波动性大的问题,本研究提出了实时交叉校准的绝对剂量测量方法,以期通过实时Fcc将波动性较大的微型电离室读数“锚定”到稳定的标准电离室读数,从而提高测量结果的准确性。该方法的优点是可以消除微型电离室不稳定对测量结果的影响,从而提高剂量测量精确性和稳定性,而缺点则是每次测量都需要实时校准,相对来讲,操作更加繁琐,剂量测定所需的时间相对更长。
测量时模体摆位误差可能会对测量结果带来一定影响,而该影响可通过CBCT图像引导摆位来消除。本研究中10 个病例在不同时间实施测量,但鉴于所用模体本身及其摆位参考线的精度很高,并且每次测量前均对加速器机房的激光灯进行校准,所以摆位对测量结果的影响可以忽略。故此,本研究并没有每次都进行CBCT摆位校正,这种做法也与大多数放疗中心的常规操作一致。
由于电离室灵敏体积的关系,尤其是在测量小靶区的点剂量时,电离室所在截面的靶区面积大小对测量结果会有一定的影响。标准电离室灵敏体积的长度为2.62 cm,当方野边长小于3 cm时,其测量结果已经不能反映模体中的真实剂量。实际测量时,电离室所在层面的肿瘤靶区横截面至少需要完全覆盖电离室探头的灵敏体积,而肿瘤靶区横截面的最大值可以用靶区的等效球体直径来间接表征,本研究建议等效球体直径小于3 cm 的所有病例都采用微型电离室实施测量。故此,如图1所示,本研究中所有病例也都是参照靶区的等效球体直径而非体积来选取的。用微型电离室测量时,对最终结果影响最大的就是电离室本身的稳定性。而通过实时交叉校准消除该因素的影响正是本研究的初衷。
放疗计划执行所采用的技术(如IMRT、3DCRT、VMAT)以及测量点相对于射野中心的偏移量会对测量结果产生一定的影响。但本研究主要聚焦于超小靶区点剂量测量设备的适用性和测量方法合理性,所以放疗计划执行技术对测量结果的影响不在本研究的范围之内。另外,该影响并非仅仅作用于微型电离室,常规靶区点剂量测量所采用的标准指形电离室也同样会面对该影响,即不同计划执行技术下,测量的结果可能存在差异,但只要测量设备合适且测量规程恰当,其结果都是对放疗剂量的正确评估,差异来源于放疗执行技术而非剂量测量设备跟测量方法。由于微型电离室的灵敏体积非常小,靶区剂量的非均匀性以及体积平均效应对测量结果的影响很小,所以,验证计划设计时通常将测量点就设置在射野中心的位置。即使二者不重合,由于本方法所针对的靶区的等效球直径均小于3 cm,靶区内的测量点也不会明显偏离射野中心太远,所以测量点相对于射野中心的偏移量对结果的影响也可忽略。
如图3 所示,对于同一个较短的测量时段来看,标准电离室和微型电离室都具有很好的剂量线性,而且在边长为3~10 cm的方形射野下,二者读数的比值稳定为一个常数。当射野边长小于3 cm 时,由于体积平均效应、源阻塞效应以及失去侧向电子平衡等因素,会导致射野中心轴上的信号减少、射野输出因子明显下降。微型电离室测量的是射野中轴上的很小一点,而标准电离室测量的是该点及其外部的较大区域,所以标准电离室测量数据明显偏大,从而导致Fcc在射野边长由3 cm降到1 cm时急剧增加。射野边长小于3 cm时,标准电离室不再适用,所以交叉校准要在边长大于3 cm 的射野下进行,建议射野边长10 cm。另外,建议校准测量点位于等效水模体表面一下5 cm 处,使之与加速器初始绝对剂量标定以及月度质控时绝对剂量测定点的深度保持一致。电离室的剂量线性和射野线性仅需初次使用交叉校准方法前进行验证,若无异常,后续使用中无需重复执行。
从图4(a)可以看到,标准电离室的长期稳定性很好,读数波动在±1%以内,而微型电离室的波动可高达5%。微型电离室的波动主要源自漏电流和噪声,其中的噪声影响更难以消除,而通过实时Fcc方法可以同时消除二者的影响[21-22]。基于实时Fcc的测量方法更准确,更利于患者治疗顺利进行。通过图4(c)也可以看到,用实时Fcc计算出的点剂量误差普遍更小、更准确。用——Fcc计算的点剂量误差有可能会超出3%容差范围,且该结果并不能有效反映真实情况。因此不建议使用某几次Fcc的平均值甚至是某一次的Fcc值作为常量应用到交叉校准测量方法中,以避免测量结果超出阈值而导致重新计划设计等一系列非必要的重复工作。
