CCR3单克隆抗体在变应性鼻炎小鼠中的作用及机制研究*
2021-12-31朱新华吴兆坤袁家胜余娟戴美娜鲍有为朱玉
朱新华 吴兆坤 袁家胜 余娟 戴美娜 鲍有为 朱玉
变应性鼻炎(allergic rhinitis,AR)是特应性个体暴露于相应变应原的环境中,IgE介导的炎性细胞向炎症部位迁移,由免疫活性细胞及其分泌的细胞因子、炎性介质等共同参与的鼻部Ⅰ型变态反应性疾病,属慢性非感染性疾病,亦是全球性健康问题[1]。有研究表明AR与抑郁情绪相关,青春期AR对精神抑郁的发展起了重要的作用,这种影响一直到青春期后期和成年[2,3],AR的发病机制与炎症细胞及其分泌的细胞因子有关,肥大细胞和嗜酸性粒细胞是其主要的作用细胞。CC趋化因子受体3(CCR3)在AR的病理生理过程中起主要作用。AR的炎症浸润主要由嗜酸性粒细胞、Th2细胞和肥大细胞组成,这些细胞表面均表达CCR3。实验研究已发现CCR3通路在体内嗜酸性粒细胞活性中起着重要作用,同时也证明了CCR3在变应性气道疾病中明显增加[4]。本研究团队运用RNAi沉默CCR3,发现可抑制小鼠嗜酸性粒细胞增殖并促进其凋亡[5]。亦有研究发现:敲除CCR3基因可通过下调EPO、ECP、MBP、IL-4和IgE的表达,减少AR小鼠侵袭性EOS的数量和炎症反应[6]。变应性哮喘的发病机制与变应性鼻炎相似,炎症细胞产生及释放的炎症介质和细胞因子均与CCR3密切相关,CCR3单克隆抗体(CCR3 mAb)是由单一B细胞克隆产生的高度均一、仅针对CCR3抗原表位的抗体。通常采用杂交瘤技术制备产生,它能够特异性作用于CCR3表面抗原,抑制其对下游细胞的作用。有研究证实:经腹腔注射CCR3单克隆抗体对变应性哮喘小鼠的症状及与炎症相关的指标均有明显改善作用[7-9]。基于“统一气道疾病”的理论,同样使用CCR3单克隆抗体对变应性鼻炎也可能产生同样效果。但目前CCR3单克隆应用于变应性鼻炎,特别是经鼻腔滴入是否对变应性鼻炎产生作用且其机制如何?文献报道尚不多见。
本实验在成功构建小鼠变应性鼻炎模型的基础上,通过经鼻腔滴入及腹腔注射两种途径给予CCR3 mAb,观察鼻腔黏膜的组织形态学变化、炎症浸润情况,并用ELISA检测相关炎症介质及细胞因子的变化,初步探讨CCR3 mAb抑制CCR3对变应性鼻炎小鼠鼻黏膜产生的相关作用及其机制。
资料及方法
1 实验材料
实验动物为6~8周Balb/c雄性健康小鼠,体重为25~35g,购自于江西省南昌市南昌大学医学院动科部,所有动物饲养于南昌大学实验室标准动物房,饲养于20℃恒温环境,以标准小鼠饲料及高温灭菌饮用水饲养。卵清蛋白(OVA)(美国sigma公司),ELISA试剂盒等。
2 实验方法
2.1 实验分组
将Balb/c小鼠分为4组:①正常小鼠组(Normal),②变应性鼻炎组(AR),③CCR3单克隆抗体滴鼻组(ND),④CCR3单克隆抗体腹腔注射组(IP),每组白鼠5只,共20只。
2.2 变应性鼻炎动物模型的建立
以6~8周雄性BALB/c小鼠于第1、8、15d经腹腔注射致敏液200 ul(100ugOVA和4 mgAL(0H)3),每天1次,行基础致敏,第20~26d以激发液20 ul(600ugOVA),10ul/侧滴鼻激发,每天2次,构建变应性鼻炎小鼠模型。
2.3 CCR3 mAb干扰
于第24~26d以CCR3mAb干扰,具体干扰方法如下:(1)经鼻腔滴入:第③组小鼠给予25 mg/kg鼠抗鼠CCR3 mAb溶于PBS溶液行滴鼻干扰,每天2次,间隔不少于8h。(2)腹腔注射:第④组小鼠给予12.5 mg/kg鼠抗鼠CCR3单抗溶于PBS溶液腹腔注射,每天2次(左右分次注射),干扰在激发前30min进行。(3)正常对照组:均用相同剂量的PBS处理。
2.4 收集小鼠鼻黏膜做好标记后置于-80℃冰箱保存备用,取小鼠鼻黏膜、组织进行HE染色及免疫组化检查。
2.5 ELISA检测鼻黏膜组织中组胺和相关炎症及细胞因子的浓度(IL-2、TNF-α、IL-4、IL-10)
3 统计分析
采用SPSS 23及GraphPad Prism 6.01软件进行数据处理,实验数据中计量资料采用(Mean±SEM)表示,各组数据首先进行正态检验及方差齐性分析,若符合正态分布和方差齐性,则进行独立样本t检验,若数据不符合正态分布,则进行非参数多重秩和检验。
结果
1 各组小鼠行为学的统计分析
最后一次小鼠鼻腔OVA激发后,计数10 min内打喷嚏及抓鼻次数(表1)。通过行为学观察发现,变应性鼻炎组(AR组)出现了明显的抓鼻及打喷嚏的症状,平均每17.8s就有一次抓鼻动作;每8.7s就有一次喷嚏。而CCR3mAb腹腔注射组(IP组)和CCR3mAb鼻腔滴入组(ND组)也有明显的抓鼻及喷嚏,但是相比于AR组明显减轻,且差异具有统计学意义(分别为抓鼻:P=0.0009、P=0.0004;喷嚏:P=0.027、P=0.014),但是均较正对照组为高,尤其是变应性鼻炎组(所有P<0.05)。而CCR3mAb腹腔注射组和CCR3mAb鼻腔滴入组之间小鼠的喷嚏及抓鼻计数无显著性差异(图1,图2)。小鼠行为学观察与分析表明运用CCR3mAb后能够有效控制变应性鼻炎的症状。

表1 鼻腔激发后喷嚏及抓鼻计数(n=5) bP<0.05 vs Normal mice;eP<0.05 vs ARmice
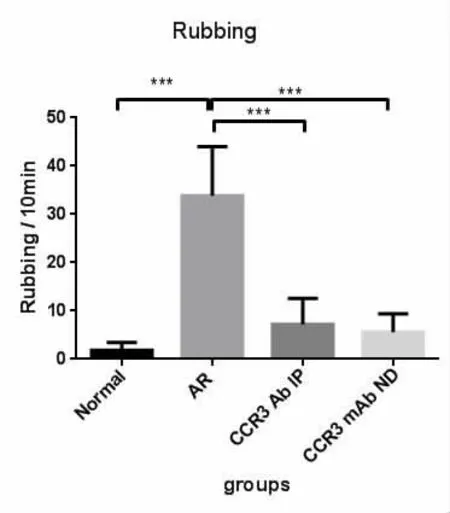
图1 鼻腔激发后小鼠抓鼻计数
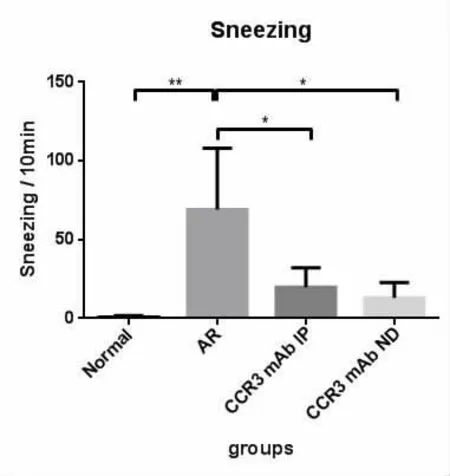
图2 鼻腔激发后小鼠喷嚏计数
2 小鼠鼻黏膜HE染色检测
成功构建变应性小鼠模型后,HE染色观察比较各组小鼠鼻黏膜组织的病理形态学变化及炎性细胞浸润情况。小鼠鼻黏膜组织形态与炎性细胞浸润均置于高倍镜下(400×)的视野中观察。结果显示:正常对照组:鼻黏膜组织结构清晰、完整、表面光滑、黏膜及黏膜下组织未见明显肿胀,组织中极少量炎性细胞浸润,鼻黏膜固有层中腺体未见明显扩张,黏膜表面纤毛清晰可见,排列整齐(图3A);变应性鼻炎组:鼻黏膜结构不清,大量炎性细胞浸润,黏膜及黏膜下层肿胀明显,分界不清,表面纤毛破坏、排列紊乱、脱落,部分上皮破损,脱离(图3B),与正常对照组相比显示出明显的炎症性表现;CCR3mAb腹腔注射组和CCR3mAb鼻腔滴入组:鼻黏膜的整体结构尚清晰,黏膜及黏膜下层分界尚可分辨,黏膜及黏膜下组织中浸润的炎症细胞较变应性鼻炎组明显减轻,但是CCR3mAb腹腔注射组与CCR3mAb鼻腔滴入组进行对比,黏膜排列稍整齐,炎症浸润无明显差异(图3C、图3D)。变应性鼻炎小鼠运用CCR3mAb,无论是腹腔注射,还是经鼻腔滴入对变应性鼻炎小鼠的鼻黏膜炎症均有抑制作用,不仅可以减轻炎症细胞的浸润;还可以使肿胀的黏膜及其表面紊乱的纤毛得到一定程度的恢复。
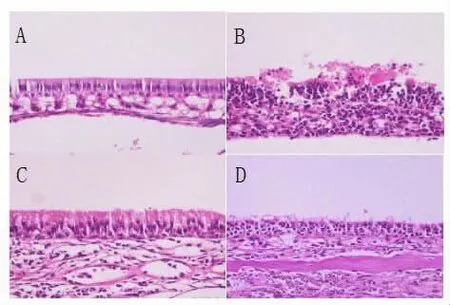
图3 小鼠鼻黏膜的HE染色结果
3 小鼠鼻黏膜免疫组化检测炎性细胞浸润情况
免疫组化观察比较各组小鼠鼻黏膜组织中肥大细胞、嗜酸性粒细胞浸润情况。本实验运用的抗体是Siglec-F单克隆抗体,Siglec-F表达于小鼠嗜酸性粒细胞及肥大细胞表面[10,11]。鼻黏膜组织中肥大细胞、嗜酸性粒细胞浸润情况置于高倍镜下(400×)观察。鼻黏膜的免疫组化显示:变应性鼻炎组炎性细胞浸润及黏膜破坏情况最为明显(图4 B),CCR3mAb腹腔注射组和CCR3mAb鼻腔滴入组小鼠,这两组的黏膜破坏及炎性细胞浸润情况均较变应性鼻炎为轻(图4C、图4D);正常对照组显示的是正常鼻黏膜组织(图4A),表明CCR3mAb应用可减少肥大细胞及嗜酸性粒细胞向变应性鼻炎小鼠鼻黏膜的迁移浸润。
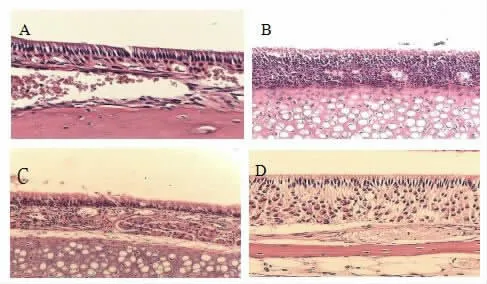
图4 小鼠肺鼻黏膜的免疫组化结果
4 ELISA检测血清、鼻黏膜中组胺和相关炎症介质及细胞因子的表达水平[12]
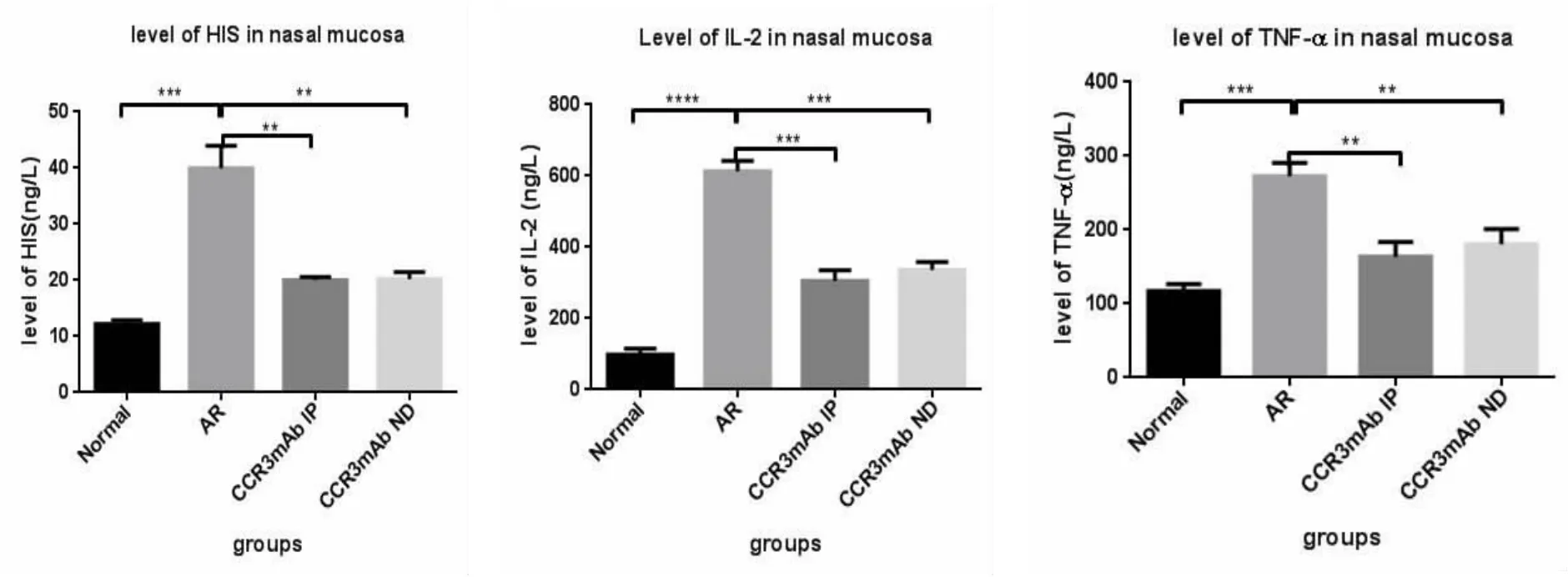
运用ELISA检测变应性鼻炎小鼠给予CCR3 mAb干扰后对鼻黏膜中各种炎症介质及细胞因子的表达水平(HIS、IL-2、TNF-α、IgE、IL-10)。结果显示:变应性鼻炎组相关炎症介质及细胞因子表达量均明显高于空白对照组、CCR3mAb腹腔注射组及CCR3mAb鼻腔滴入组,差异均具有统计学意义(图5,表2)。表明CCR3mAb运用于变应性鼻炎,可抑制相关炎症介质及细胞因子的促炎作用。
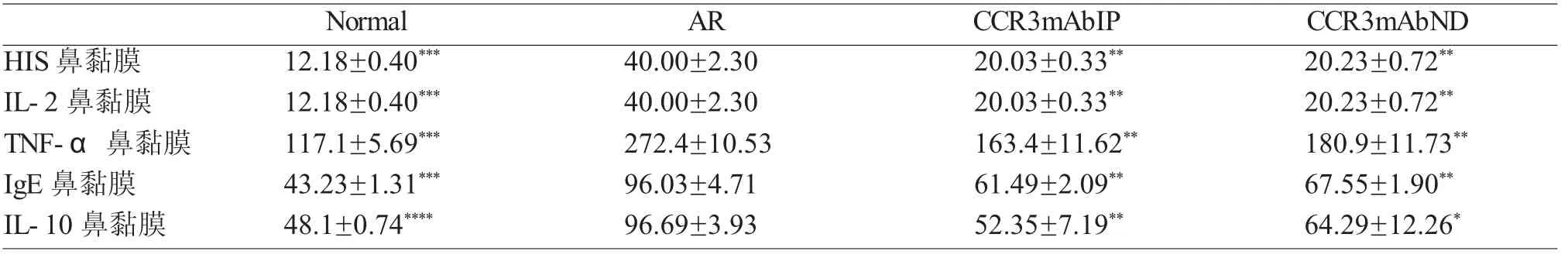
表2 鼻黏膜中组胺和IL-2、TNF-α、IgE、IL-10的ELISA检测结果
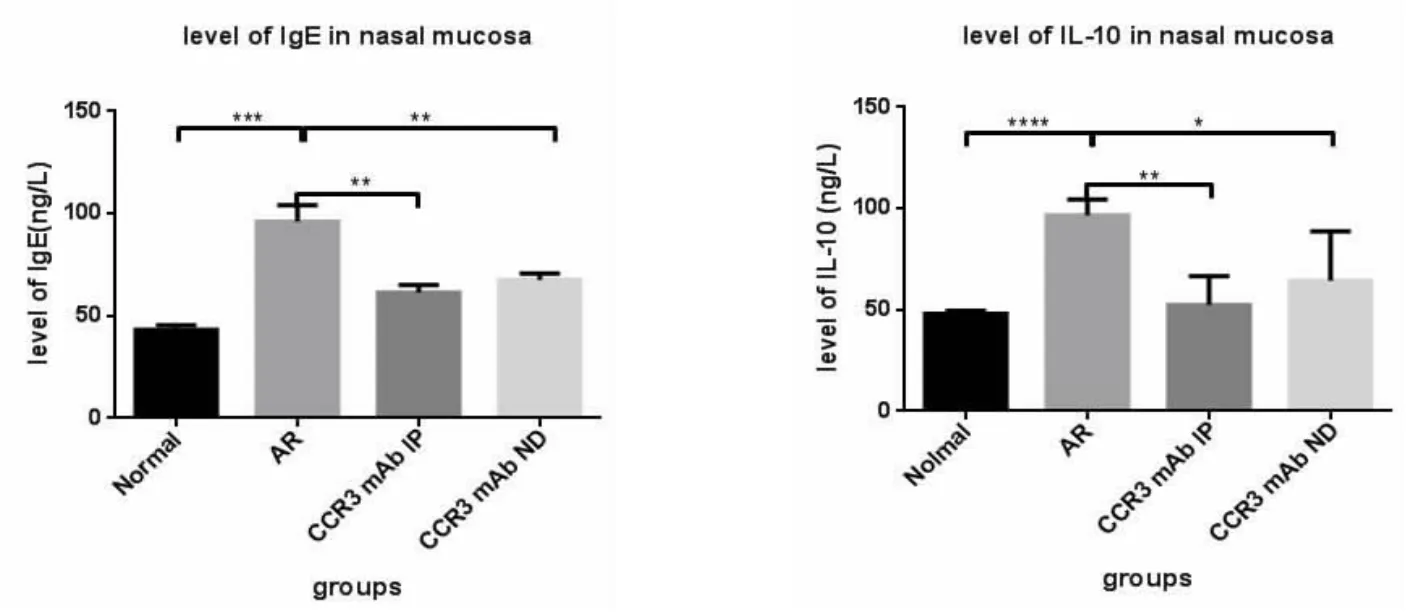
图5 小鼠外周血、鼻黏膜及肺肺组织中IL-10水平的ELISA检测结果
讨论
变应性鼻炎(Allergic rhinitis,AR)影响全球发病率约20%,是一种慢性非感染性疾病,有证据表明,全球过敏性疾病正在逐年增加[13]。而AR的发病涉及多种炎性细胞活化及炎症介质的合成及分泌,机制复杂,且各种信号级联之间相互作用及影响。而EOS趋化因子-趋化因子受体3轴(Eotaxin-CCR3)是其中的一个重要通路,在炎症状态下,EOS通过Eotaxin-CCR3由造血干细胞分化、成熟并募集到炎症部位。EOS、Th2细胞和肥大细胞等表面均表达CCR3,在变应性鼻炎的发生与发展起关键性作用。有研究运用RNA干扰(RNAi)沉默CCR3发现:①CCR3 RNAi在体内外均能有效抑制CCR3 mRNA和蛋白的表达,从而促进EOS的凋亡,抑制其生长、迁移和侵袭,②可减轻AR动物模型中鼻黏膜变态反应过程并减少实验动物骨髓、外周血及鼻腔灌洗液中EOS数量。③可抑制变应性鼻炎动物模型中EOS的发育、迁移及浸润过程,减少EOS脱颗粒作用而减轻变应性鼻炎的炎症反应[5,6,14]。由此可见,尽管目前AR发病机制研究尚未完全透彻,但Eotaxin-CCR3通路的激活以及CCR3基因的表达是AR发生与发展的重要因素。因此,CCR3可能是研究呼吸道过敏性疾病治疗靶基因。单克隆抗体(mAb)是继疫苗及重组蛋白后的一类最重要生物制剂,已成功应用于一些自身免疫性疾病、肿瘤及过敏性疾病等的治疗中[15]。运用CCR3 mAb可阻断CCR3-Eotaxin轴,达到缓解过敏相关疾病目的,且CCR3是Eotaxin在EOS表面的唯一受体,所以Eotaxin突变体拮抗CCR3的作用是很强的,而且特异性也很高[16]。有研究表明,CCR3缺陷小鼠,其EOS在内皮下被滞留,也就失去了迁移至炎症区域的能力[17]。变应性哮喘(Allergic asthma)也是呼吸道过敏性疾病中的一种,哮喘的发生与发展与变应性鼻炎相似,也是与肥大细胞、EOS等炎症细胞及其表面的CCR3密切相关。有很多研究表明,在哮喘动物模型(主要是小鼠)中,以CCR3 mAb经腹腔注射进行干预,在临床表现及炎症细胞、炎症因子及炎症介质等方面均有明显改善,能够明显缓解动物模型打喷嚏、点头呼吸、呼吸急促、哮鸣音、腹肌收缩及烦躁等典型发作症状;且能明显抑制气道肥大细胞、EOS等的募集、黏液分泌过多,以及各种炎症介质及细胞因子的产生和释放[18-21]。因此,CCR3 mAb的运用(经腹腔注射)可明显改善变应性哮喘小鼠临床症状、降低变应性哮喘各项生化指标,基于“统一气道疾病”的理论,使用CCR3 mAb对AR是否有同样影响,相关研究目前尚不多见,本实验运用CCR3 mAb治疗小鼠AR,以观察其产生的作用及其探讨相关作用机制。
本实验在建立变应性鼻炎小鼠模型的基础上,通过使用CCR3 mAb经腹腔注射(IP)及鼻腔滴入(ND)两种途径运用于动物模型,观察小鼠动物模型的临床表现(抓鼻、打喷嚏、点头呼吸、呼吸急促、哮鸣音、腹肌收缩、烦躁等),IP及ND组都较实验组(AR)明显减轻,HE染色显示鼻黏膜组织的炎症浸润情况较AR组也明显好转,鼻黏膜的组织形态学明显改善。而ELIAS检测IP及ND组鼻黏膜组织中的各项细胞因子和炎症介质(组胺、IL-2、NF-α、IL-4、IL-10及IgE)的浓度均较AR组为低,差异具有统计学意义(P<0.05);从行为学、临床表现及炎症水平的严重程度分析结果的总体趋势为:AR组>ND组≥IP组>Normal组。可见CCR3 mAb经腹腔注射较鼻腔滴入有更明显的效果,可能由于经鼻腔滴入后,由于有纤毛清除系统的存在,将一部分的抗体经纤毛排除,对CCR3mAb的吸收不充分;另一方面经腹腔注射后最终还是由腹腔血管吸收进入血液,发挥拮抗CCR3的作用,因此经腹腔注射后吸收更加充分。本实验运用CCR3 mAb作用于变应性鼻炎中,初步研究结果发现:CCR3 mAb可控制变应性鼻炎的临床症状,并可通过抑制炎性因子的作用而影响AR的发病机制。本研究仅在动物实验方面做了初步有意义的探讨,CCR3 mAb在变应性鼻炎中的作用及机制尚需进一步的深入研究。
