1例存在再喂养综合征风险的胃癌复发患者 营养治疗的药学监护与分析
2021-12-30阳巧凤赵晶晶徐贞沈娟广东省妇幼保健院药学部广州5400安徽医科大学第三附属医院药学部合肥2006无锡市中医院药学部江苏无锡2407
阳巧凤,赵晶晶,徐贞,沈娟(.广东省妇幼保健院药学部,广州 5400;2.安徽医科大学第三附属医院药学部,合肥 2006;.无锡市中医院药学部,江苏 无锡 2407)
1 病例资料
患者,男,75岁,身高165 cm,体质量36.5 kg,BMI值13.41 kg·m-2。因“胃癌术后5年,恶心、呕吐半年加重1月”,于2020年8月9日就诊于本院肿瘤科门诊,门诊拟以“胃癌术后复查”收住入院。本次发病以来,患者无发热,无咳嗽、咳痰,无活动后胸闷、气短,无胸痛、咯血,无尿频、尿急、尿痛,饮食差,睡眠一般,大便两三天一次,量少;小便次数正常,约800 mL。3个月体质量下降约10 kg,KSP 70分。体格检查:T 36℃,P 72次·min-1,R 18次·min-1,BP 88/58 mmHg(1 mmHg=0.133 kPa)。腹部凹陷,上腹部压痛(+),无明显反跳痛,余腹无压痛、反跳痛,余无阳性体征。2020年8月9日急诊生化检验报告:总蛋白56.10 g·L-1↓,白蛋白28.71 g·L-1↓,钠130.50 mmol·L-1↓,氯90.40 mmol·L-1↓。临床诊断:胃癌术后复发,癌性疼痛、重度营养不良、低蛋白血症。
2 主要治疗经过及营养方案的调整
患者于2020年8月9日入院,8月10日临床药师对该患者进行NRS 2002营养风险筛查:患者患有恶性肿瘤,疾病状态评分为1分;患者BMI值为13.41 kg·m-2,近3个月体质量减轻10 kg(>15%),极度消瘦,一般状态差,营养状态评分为3分;患者年龄75岁,年龄评分1分,NRS2002总评分为5分,存在营养不良风险,需要进行营养支持。考虑到患者纳差,临床药师建议在饮食基础上,增加适用于营养不良的肿瘤患者肠内营养液(TPF-T),每日总用量为200 mL(260 kcal),分多次口服。8月12日,患者纳差未见好转,进食进水后均会出现恶心呕吐。考虑到患者胃癌术后消化道重构的特殊解剖结构,存在管饲肠内营养禁忌。临床药师再次评估患者营养状况,结合患者的电解质指标(磷0.8 mmol·L-1↓,钙2.0 mmol·L-1),发现该名患者存在RFS风险,建议先行纠正患者低磷、低钙血症,常规补充维生素B1,48 h后再行补充性肠外营养(SPN)治疗。8月24日,患者可部分经口进食,营养状况明显改善,予以出院,择期放射治疗。患者住院期间营养支持方案见表1,测定指标结果见表2~3。

表1 营养支持治疗方案
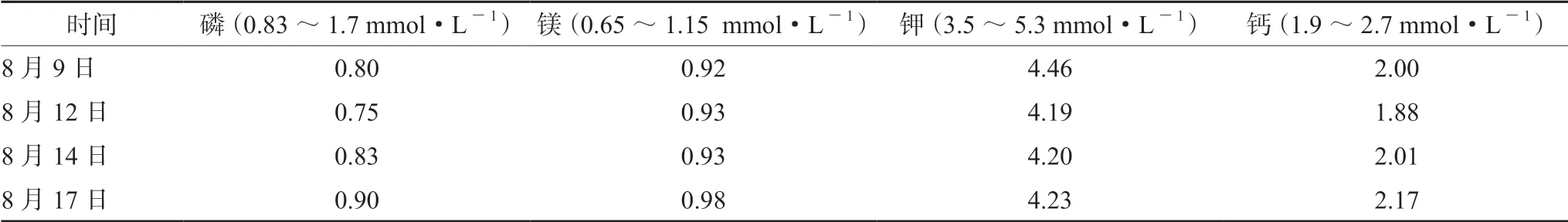
表2 患者血清磷、镁、钾、钙在住院期间变化(mmol·L-1)
3 分析与讨论
3.1 再喂养综合征高危人群的甄别
RFS的发病机制包括胰岛素分泌、电解质转移和合成代谢增强[1]。机体长期营养摄入不足,分解代谢多于合成代谢,胰岛素分泌便会随之下降,有时还会伴有胰岛素抵抗。此时,机体磷、钾、镁和维生素等微量元素的吸收减少但消耗不变,血清磷、钾、镁浓度在机体的代偿作用下并未出现明显降低。重新开始营养治疗,尤其补充大量碳水化合物之后,会刺激机体分泌胰岛素,导致钾、磷、镁转移入细胞内,形成低磷血症、低钾血症、低镁血症[2]。糖代谢和蛋白质合成的增强还会消耗维生素B1使体内维生素减少。电解质紊乱和维生素的减少,会导致机体出现呼吸系统、神经系统、心血管系统、血液系统等一系列症状。RFS的这种代谢特征,通常在营养治疗后3~4 d内发生[3]。
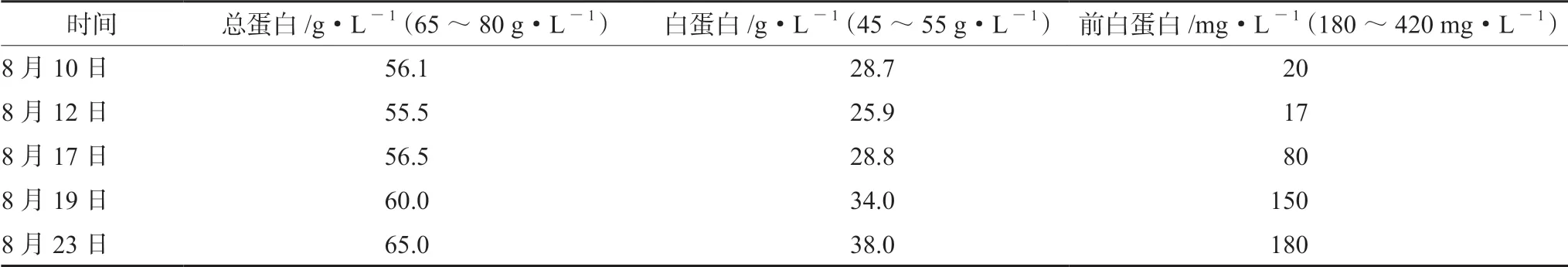
表3 患者总蛋白、白蛋白、前白蛋白在住院期间变化
根据美国肠外肠内营养学会ASPEN筛选RFS高危人群的参考标准[4](≥1项为高危人群):① BMI<16 kg·m-2;② 无意减肥,3个月内体质量下降>7.5%或6个月内体质量下降>10%;③ 几乎没有进食或完全禁食超过7 d;④ 在恢复营养之前患者的血清钾或镁水平低于正常值)。该患者近3个月体质量减轻10 kg(>15%),按照ASPEN甄别标准,该患者属于RFS高危人群。
3.2 存在再喂养综合征风险的肿瘤患者营养支持方案的制订
3.2.1 肠外营养开始的时机 本病例是胃恶性肿瘤术后复发患者,入院时存在纳差、恶心呕吐的情况,经口饮食差,NRS2002评分5分,存在重度营养风险,需要进行营养支持。如果患者胃肠道功能正常,应首选肠内营养(EN)[5]。当EN无法启动或单一肠内营养远不能满足代谢的需要时,肠外营养(PN)则成为营养支持的必要方式[6]。《2017中国成人补充性肠外营养中国专家共识》认为[7],对于NRS2002≥5分或NUTRIC≥6分的高风险患者,如果EN在48~72 h内无法达到目标能量及蛋白质需要量的60%时,早期给予SPN支持治疗,与单纯给予EN相比,感染发生率较低,住院时间较短。该患者入院时NRS2002评分5分,存在高营养风险,且短期内EN支持无法达到目标能量的60%,给予SPN支持治疗,时机选择合理。SPN治疗一段时间之后,患者的营养状况得到了明显的改善,治疗效果良好。
3.2.2 电解质的补充 低磷血症是RFS最明显的特征之一[8]。按照不同的血磷水平,可将低磷血症分为轻度(0.6~0.85 mmol·L-1)、中度(0.3~0.6 mmol·L-1)和 重 度(<0.3 mmol·L-1)[9]。本病例入院时严重营养不良,血磷水平(0.80 mmol·L-1)低于正常值,经2 d 口服营养补充后,血磷水平(0.75 mmol·L-1)进一步降低,同时伴有低血钙,所以在启动SPN支持治疗前,参考Mehanna等[10]研究结果,临床药师建议每日采用口服补磷15 mmol,静脉补钙1 g,纠正电解质紊乱。
3.2.3 维生素的补充 对于高RFS风险的营养不良患者,补充维生素B1,可预防韦尼克脑病的发生[11]。建议每日为患者补充 200~300 mg维生素 B1[9],同时监测患者维生素B6、维生素B12和叶酸水平。本例患者未进行维生素B1的监测,叶酸水平正常,维生素B12水平低于正常值。参考Singla等研究结果[11],临床药师建议医师对患者进行了维生素B1(维生素B1注射液100 mg bid im)和维生素B12(甲钴胺片500 μg tid po)的补充,以预防神经系统相关症状。
3.2.4 能量的补充 ASPEN指南[4]推荐应根据患者的耐受程度进行个体化方案设计。通常从低能量、慢速度开始。对于存在高RFS风险的患者,能量补充应从10 kcal·kg-1开始缓慢增加,一周内逐渐增加到全部需求量,过程中始终注意监测生物化学指标和液体平衡。如果患者未达到高风险,推荐的能量供应不超过理论需求量的50%或24 h内最大供给热量不超过20 kcal·kg-1[12-13]。若监测患者临床和生化状况后,情况良好,可调整输注速度。
在给患者进行肠外营养补充时,临床药师建议在营养支持的前3 d,按照80 mL·h-1的速度,输注肠外营养液(TNA)12 h,剩余输液不再输注。按照所输注液体量计算,相当于提供18 kcal/(kg·d)能量输注期间,监测电解质均正常,限制性的能量供应72 h后,第4日开始按照110 mL·h-1的速度输注TNA并全部输完。患者耐受性良好,营养状况得到极大的改善。
4 总结
本病例为存在RFS风险的胃癌复发的高龄患者,临床药师根据患者疾病具体情况,协助医师制订个体化的营养治疗方案。在发现患者是发生RFS风险的高危人群后,及时给予了治疗建议,促进了患者病情的转归,避免RFS的发生。出院后,患者前往本院另一院区做放射性治疗。临床药师回访中了解到该患者体质量有所增加,营养状况得到了改善。临床药师作为营养支持团队的重要成员参与临床营养支持治疗,通过与医师的沟通协作,为患者提供了全程的营养支持服务,保障了肠外营养治疗的安全及有效。
