聚乙二醇脂质体多柔比星超说明书用药分析与合理性评价
2021-12-30李雨王丽丽孙博黎苏隋月刘广宣中国医科大学肿瘤医院辽宁省肿瘤医院药学部沈阳110042
李雨,王丽丽,孙博,黎苏,隋月,刘广宣(中国医科大学肿瘤医院 辽宁省肿瘤医院药学部,沈阳 110042)
传统蒽环类药物是由微生物产生的具有抗肿瘤活性的化学物质,为细胞周期非特异性药物,主要的作用机制为进入细胞核嵌入DNA 碱基对中,干扰DNA 转录和mRNA合成,抑制拓扑异构酶Ⅱ,导致染色体结构异常,具有广谱的抗肿瘤作用[1]。临床应用中常见的不良反应包括脱发、胃肠道反应、骨髓抑制及心脏毒性等。其中心脏毒性为限制剂量性毒性,常表现为进展性和不可逆转性,引起心肌损伤、充血性心力衰竭,极大地限制了蒽环类药物的应用[2]。新型蒽环类药物聚乙二醇脂质体多柔比星(pegylated liposomal doxorubicin,PLD)系将盐酸多柔比星包封于PEG化脂质体中制成的脂质体制剂,具有靶向性、缓释作用、良好的组织相容性等优点,可保留或提高药物疗效,有效降低药物不良反应[1,3]。 1995年PLD在美国上市,美国食品药品管理局(Food and Drug Administration,FDA)批准的适应证为人类免疫缺陷病毒(human immunodeficiency virus,HIV)相关的卡波氏肉瘤;1999年FDA增加其复发性卵巢癌的适应证;2000年欧洲批准其用于乳腺癌的治疗;2007年FDA批准其用于多发性骨髓瘤的治疗。2005年PLD在中国上市,批准适应证为艾滋病相关的卡波氏肉瘤[4]。本研究旨在回顾性分析PLD临床应用现状与说明书及指南推荐适应证之间的差异,并对其应用的合理性、安全性进行评价,为临床合理、规范用药提供参考。
1 材料与方法
收集本院2020年1—12月出院患者应用PLD的病例,并排除其中诊断不明确的病例。在病历中获取患者基本信息如年龄、性别、入院诊断及出院诊断等。按照患者的出院诊断进行统计,判断使用PLD是否符合说明书,或指南推荐治疗的适应证。应用Micromedex 数据库的Thomson 分级系统对超说明书用药进行有效性等级、推荐级别及证据等级评价[5]。检索Micromedex 数据库,对超说明书应用PLD的适应证进行Thomson分级评价,数据库未收录的根据收集到的用药证据进行Thomson分级评价,对PLD用药的合理性及安全性进行评价。
2 结果
2.1 临床资料
本研究共纳入1328例患者,其中女性1238例,男性90例,年龄为8~86岁,平均年龄52.37 岁。纳入研究患者的临床诊断见表1。

表1 纳入研究患者的临床诊断 Tab 1 Clinical data of patients
2.2 适应证分析
PLD的说明书内适应证为治疗低于CD4(<200 个·mm-3)及有广泛皮肤黏膜内脏疾病的与艾滋病相关的卡波氏肉瘤患者(AIDSKS)。本研究中共有10种适应证(见表1),均为超说明书应用,主要依据见表2。通过查询Micromedex数据库进行Thomson分级的有2项,为乳腺癌及卵巢癌,有效性等级Ⅱa、推荐等级Ⅱb、证据等级B级[6]。通过收集的循证医学证据进行Thomson分级的有8项。具体见表2。
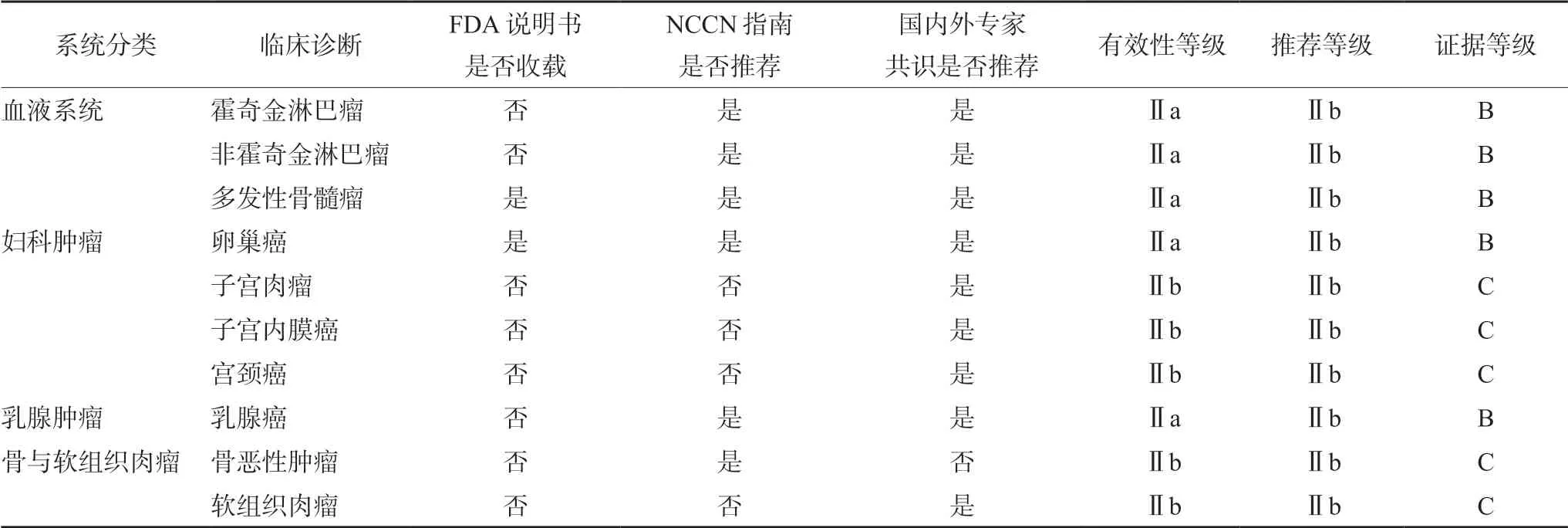
表2 超说明书用药的主要证据类型及Thomson分级 Tab 2 Evidence type and Thomson grading of off-label use of PLD
2.3 不良反应分析
在1328例应用PLD的患者中,最常见的不良反应为骨髓抑制(552例,占41.57%),多为轻至中度可逆不良反应,主要表现为白细胞减少、贫血、中性粒细胞较少。80例(6.02%)患者出现消化道不良反应,多为轻度反应,主要表现为恶心、呕吐。67例(5.05%)患者出现手足综合征,可通过局部冰敷等方法缓解或消失。53例(3.99%)患者出现口腔黏膜炎,可通过口腔护理,保持口腔洁净或药物控制。51例(3.84%)患者出现输液反应,多为初次应用时出现的急性输液相关反应,通过暂停给药,静脉滴注PLD前给予适宜的抗过敏治疗及更慢的滴注速度可缓解。28例(2.11%)患者出现脱发反应,多为轻度反应。无心脏毒性病例出现,无不耐受及严重不良反应发生。
3 讨论
3.1 PLD超说明书用药分析
3.1.1 PLD治疗乳腺癌 本研究中共有986例(74.25%)乳腺癌患者应用PLD。目前含蒽环类药物的化疗方案是早期乳腺癌辅助治疗及晚期乳腺癌解救治疗的标准方案。2000年欧洲批准PLD用于转移性乳腺癌的治疗;美国国家综合癌症网络(NCCN)指南(2019.V1)推荐PLD单药(50 mg·m-2,每4周1次)化疗方案用于治疗晚期乳腺癌;中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2019年版)及《中国蒽环类药物治疗乳腺癌专家共识》中明确指出PLD可作为复发或转移性乳腺癌一线治疗的首选单药[4,7],降低不良反应,同时增强药物疗效,属于合理用药,推荐使用。
3.1.2 PLD治疗血液系统恶性肿瘤 本研究中共有117例恶性淋巴瘤患者使用PLD,其中19例霍奇金淋巴瘤(Hodgkin’s lymphoma,HL),98例非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL),分别占总应用的1.43%和7.38%。恶性淋巴瘤是一组起源于造血淋巴组织的恶性肿瘤,通常包括HL及NHL两大类,以NHL常见[8]。蒽环类药物作为一线化疗和姑息治疗药物在淋巴瘤治疗中被推广使用[9]。PLD对淋巴瘤患者的治疗,主要是早期进行挽救化疗,特别是针对T 淋巴细胞瘤和HL[10]。中国抗癌协会血液肿瘤专业委员会在2019年版《脂质体阿霉素治疗恶性淋巴瘤和多发性骨髓瘤的中国专家共识》中指出NCCN指南及国内、外多家临床指南均积极推荐PLD可代替普通蒽环类药物,并与一线化疗药物(R-CDOP:利妥昔单抗+环磷酰胺+PLD+长春新碱+泼尼松)对弥漫性大B 细胞淋巴瘤伴左心功能不全的患者进行治疗[8,11],并推荐PLD可采用单独用药或者联合用药方案对蕈样霉菌病/Sezary(MF/SS)进行一线治疗[8,11]。PLD用于治疗HL及NHL的循证医学证据充足(有效性等级Ⅱa,推荐等级Ⅱb,证据等级B),属于合理用药,推荐使用。
本研究中共有2例(0.15%)多发性骨髓瘤患者使用PLD。多发性骨髓瘤(MM)是发病率仅次于白血病及淋巴瘤的血液系统恶性肿瘤[8],蒽环类药物、蛋白酶体抑制剂及免疫调节剂协同发挥作用为其一线治疗手段[8]。2007年FDA批准PLD用于MM的治疗。2019年版《脂质体阿霉素治疗恶性淋巴瘤和多发性骨髓瘤的中国专家共识》推荐DVD(PLD+长春新碱+地塞米松)方案作为MM的初始治疗方案[8]。PD(硼替佐米+PLD)方案作为难治或复发MM的一线治疗方案[8]。PLD用于治疗MM循证医学证据充足(有效性等级Ⅱa,推荐等级Ⅱb,证据等级B),属于合理用药,推荐使用。
3.1.3 PLD治疗妇科恶性肿瘤 本研究中共有161例(12.12%)妇科恶性肿瘤患者使用PLD,其中卵巢癌124例,子宫内膜癌23例,子宫肉瘤3例,宫颈癌11例。多项研究表明PLD是卵巢癌治疗的有效药物[1]。1999年FDA批准PLD用于复发性卵巢癌的治疗。CP方案(卡铂+紫杉醇)是卵巢癌初始化疗的标准方案。有研究表明,PLD可作为紫杉醇的替代药物对卵巢癌进行初始化疗[12]。一项Ⅲ期MITO-2临床研究中,CD方案(卡铂+PLD)与CP 方案中位无进展生存(PFS)时间(19.0个月vs16.8个月)、中位总生存(OS)时间(61.6个月vs53.2个月)相似。该研究表明,CD 方案与CP 标准化疗方案的疗效并无差异,可作为CP方案的替代方案[12]。NCCN 临床实践指南卵巢癌(2019.V1)中推荐PLD用于复发卵巢癌的一线化疗。中华医学会妇科肿瘤学分会在《妇科恶性肿瘤聚乙二醇化脂质体多柔比星临床应用专家共识》(2018年)中推荐CD 方案用于卵巢癌的初始治疗(2A类),特别是对紫杉类药物过敏、顾虑脱发及存在周围神经病变的患者[1]。对于铂敏感复发的卵巢癌患者,指南推荐PLD 联合铂类化疗加或不加贝伐珠单抗(BEV)为其首选的治疗方案(1 类)。对于铂耐药复发卵巢癌的患者指南推荐PLD 联合或不联合BEV 作为首选化疗方案(2A类)[1]。PLD用于治疗复发性卵巢癌的循证医学证据充足(有效性等级Ⅱa,推荐等级Ⅱb,证据等级B),属于合理用药,推荐使用。
子宫体恶性肿瘤主要包括子宫内膜癌和子宫肉瘤两类,对于晚期转移性、复发性癌、特殊组织类型和部分早期高危子宫内膜癌患者的治疗以化疗为主[1]。GOG 129H研究是一项针对既往接受过治疗的复发/持续性子宫内膜癌患者的Ⅱ期临床研究[13],MITO-END1研究是一项评估未经化疗的晚期/复发子宫内膜癌患者的Ⅱ期临床研究[14],两项研究的结果均显示PLD用于治疗晚期及复发子宫内膜癌疗效确切,且无严重不良反应发生。子宫肉瘤以手术治疗为主,化疗效果并不明确。GOG 87J 研究是一项评估PLD 治疗未经化疗的晚期/转移子宫平滑肌肉瘤的安全性和有效性的Ⅱ期临床研究[15],结果表明与既往接受多柔比星治疗的子宫平滑肌肉瘤患者相比,客观缓解率(ORR)未见明显提高。PLD用于子宫内膜癌、子宫肉瘤的治疗尚无有力的循证医学证据(有效性等级Ⅱb,推荐等级Ⅱb,证据等级C)。还需要进一步的前瞻性、随机对照和多中心临床研究证实。
对于晚期转移、复发性子宫颈癌患者的治疗以化疗为主。GOG 127R研究是一项针对复发/持续性子宫颈癌二线化疗的Ⅱ期临床研究[16],结果显示,接受PLD 治疗的患者ORR 为11.1%(均为部分缓解),不良反应较轻。PLD用于子宫颈癌的治疗尚无有力的循证医学证据(有效性等级Ⅱb,推荐等级Ⅱb,证据等级C),还需要进一步大规模多中心临床研究证实。
3.1.4 PLD治疗骨与软组织肉瘤 本研究中共有14例(1.05%)骨恶性肿瘤患者使用PLD。骨肉瘤是最常见的原发骨恶性肿瘤,多发于青少年,恶性程度高[17]。多药方案的新辅助化疗和其他辅助治疗改善了骨肉瘤患者的预后[18]。2018年版NCCN指南推荐的骨肉瘤一线化疗方案有AP方案[阿霉素(ADM)+顺铂]、MAP方案(大剂量甲氨蝶呤+ADM+顺铂)等[19]。ADM对骨恶性肿瘤有明显疗效,是骨恶性肿瘤化疗药物的基石之一[20]。《四肢骨肉瘤保肢治疗指南》(2019年版)中指出新辅助化疗的药物可选择蒽环类包括ADM、PLD、吡柔比星、表柔比星,铂类包括顺铂、洛铂,甲氨蝶呤及异环磷酰胺[21]。蒽环类药物的心脏毒性是临床应用的主要障碍。杨勇昆等[19]采用单中心回顾性研究方法对比PLD联合化疗与ADM联合化疗治疗经典型骨肉瘤患者的疗效及安全性,两药在骨肉瘤中的化疗效果相似,但PLD化疗不良反应发生率相对较低,尤其是以粒细胞减少为代表的血液学毒性明显减轻,具有良好的应用前景。目前PLD在诸多恶性肿瘤的治疗领域中已替代多柔比星,并广泛应用,但PLD是否可代替多柔比星成为骨肉瘤治疗的主要药物尚无定论[18]。PLD用于骨恶性肿瘤的治疗无有力的循证医学证据(有效性等级Ⅱb,推荐等级Ⅱb,证据等级C),还需要进一步的前瞻性、随机对照和多中心临床研究证实。
本研究中共有48例(3.61%)软组织肉瘤(STS)患者使用PLD。STS发病率低,手术为其主要的治疗手段[22]。《软组织肉瘤诊治中国专家共识》(2015年版)中指出,STS一线化疗方案推荐使用ADM 单药75 mg·m-2,每3周为1周期,并且不推荐增加ADM的剂量或联合除异环磷酰胺以外的其他药物。PLD的不良反应如血液毒性和心脏毒性均小于ADM,但与ADM相比,PLD治疗STS的疗效并无优势。对部分患有心脏基础疾病而无法使用ADM或者使用ADM已达到最大累积剂量的晚期STS患者,一线使用PLD 的证据不足,但也有对于ADM化疗失败的患者使用PLD获益的报告[23]。《肢体软组织肉瘤临床诊疗专家共识》(2014年版)中指出对于化疗敏感的STS,患者进行术前化疗是否有效,文献证据不一,仅有一部分患者可以从术前的化疗中获益,而部分的患者在术前化疗时就已经出现了疾病进展。术前化疗可选药物包括吉西他滨、氮烯咪胺、PLD、长春瑞滨等;建议有术后化疗适应证的患者根据肿瘤病理类型选择药物,术后化疗可选药物包括吉西他滨、氮烯咪胺、PLD、替莫唑胺及长春瑞滨[24]。PLD用于STS的治疗,循证医学证据不够充足(有效性等级Ⅱb,推荐等级Ⅱb,证据等级C),还需要进一步大规模多中心临床研究证实。
3.2 不良反应分析
与传统蒽环类药物相比,PLD可显著降低心脏毒性、骨髓抑制、脱发等不良事件的发生率。有研究显示在抗肿瘤治疗中,PLD相比多柔比星疗效提高50%以上,而其不良反应不到后者的10%[25]。张松[26]通过对比PLD及传统蒽环类药物在治疗乳腺癌不良反应发生率时发现,PLD在心脏功能损伤及骨髓抑制方面具有优势,在口腔黏膜炎、恶心呕吐及肝功能损失方面效果相当,在手足综合征方面较普通蒽环类药物发生率高。梁锦湄等[27]研究发现与传统蒽环类制剂相比,在治疗肝癌、多发性骨髓瘤、晚期胃癌和非霍奇金淋巴瘤时,使用PLD治疗的患者白细胞减少、恶心呕吐、脱发、感染等不良反应的发生显著减少。本研究中PLD最常见的不良反应为骨髓抑制、消化道反应,脱发、口腔黏膜炎、手足综合征等多为轻至中度可逆不良反应,无心脏毒性不良反应及患者无法耐受或治疗相关性死亡不良反应的发生。
4 结论
PLD因其疗效确切不良反应少的优势,从1995年问世以来一直在抗肿瘤治疗中发挥着强大的作用。本研究中有10种适应证应用PLD,均为超说明书用药。其中HL、NHL、MM、卵巢癌、乳腺癌等超说明书用药有循证医学证据支持,属于超说明书用药中的合理用药;而子宫肉瘤、子
宫内膜癌、子宫颈癌、骨恶性肿瘤及软组织肉瘤的超说明书用药无有力循证医学证据支持,不推荐使用,只能够在患者知情同意并且能够明确患者获益大于风险的情况下谨慎使用,在保障患者的安全合理用药的同时避免医疗纠纷的发生。
