灰毡毛忍冬苯丙氨酸解氨酶(LmPAL2)基因的 克隆与表达分析
2021-12-30王珊陈勋龙雨青童巧珍刘湘丹周日宝湖南中医药大学第二附属医院长沙410005湖南中医药大学药学院长沙410208南华大学附属南华医院湖南衡阳421002湖南省中药饮片标准化及功能工程技术研究中心长沙410208湖南省普通高等学校中药现代化研究重点实验室长沙410208
王珊,陈勋,龙雨青,童巧珍,刘湘丹*,周日宝*(1.湖南中医药大学第二附属医院,长沙 410005;2.湖南中医药大学药学院,长沙 410208;.南华大学附属南华医院,湖南 衡阳 421002;4.湖南省中药饮片标准化及功能工程技术研究中心,长沙 410208;5.湖南省普通高等学校中药现代化研究重点实验室,长沙 410208)
灰毡毛忍冬Lonicera macranthoidesHand.-Mazz.来源于忍冬科,收载于《中国药典》2020年版山银花项下,具有清热解毒、疏散风热的功效,是临床常用中药之一。自《中国药典》2005年版将金银花与山银花分列后,学者们对两者开展了多项对比研究[1-2],其中主要活性成分绿原酸的含量测定结果显示,灰毡毛忍冬显著高于忍冬。大量研究表明,绿原酸具有抗菌、抗病毒、抗肿瘤、抗氧化和抗炎等作用[3],灰毡毛忍冬作为提取绿原酸的主要原料之一,具有较高的经济价值和良好的市场应用前景。以往提高绿原酸含量的研究多集中在提取工艺和加工炮制等方面[4-5]。近些年,随着分子生物学的快速发展,对灰毡毛忍冬绿原酸生物合成途径的相关基因研究逐渐成为热点。有学者研究发现,绿原酸的生物合成可能与苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)、羟基肉桂转移/羟基肉桂酰辅酶A奎尼酸转移酶(HCT/HQT)和香豆酸羟化酶(C3H)等重要酶有关[6]。目前已有关于灰毡毛忍冬HQT基因[4,7]、LmCCoAOMT基因[8]、4CL基因[9],以及本项目组的PAL1基因[10]和C3H1基因[11]等陆续被克隆,这些基因皆被认为是参与调控绿原酸生物合成途径的关键基因。绿原酸为苯丙素类物质,其合成与苯丙烷代谢密切相关[12]。PAL 作为苯丙烷类代谢途径的关键酶和限速酶,对绿原酸的合成有着促进作用[13]。
本研究以灰毡毛忍冬的花、茎和叶为材料,根据项目组前期获得的灰毡毛忍冬转录组数据库的相关序列设计引物,利用逆转录聚合酶链反应(RT-PCR)和扩增技术(RACE),克隆灰毡毛忍冬PAL2(LmPAL2)基因,对其进行生物信息学分析。再采用qRT-PCR 技术测定其在不同花期和不同部位的表达量,并进行分析,为进一步探究LmPAL2基因在参与灰毡毛忍冬绿原酸生物合成中的调控作用提供参考依据。
1 材料
1.1 药材
灰毡毛忍冬材料均采摘于湖南中医药大学药植园,取开花进程中的7个花期的花[10]以及茎、叶,经湖南中医药大学周日宝教授鉴定为灰毡毛忍冬的花、茎及叶,于-80℃ 冰箱保存。
1.2 试药
Biospin 多糖多酚植物总RNA提取试剂盒(杭州博日科技有限公司),RevertAid First Strand cDNA synthesis Kit(Thermo公司),Gel Extraction Kit、2×Taq MasterMix(Dye)和2×Pfu MasterMix(Dye)(康为世纪生物科技有限公司),pEASY-T1 Cloning Vector、pEASY-Blunt Cloning Vector和TranStart Green qPCR SuperMix UDG(北京全式金生物科技有限公司),SMARTer RACE 5’/3’ Kit(Clontech 公司)。引物由上海生工生物工程股份有限公司合成(序列见表1),浓度均为10 μmol·L-1。

表1 引物序列 Tab 1 Primer sequence
2 方法
2.1 LmPAL2 基因克隆
2.1.1 总RNA提取和cDNA第一链的合成 取灰毡毛忍冬白色花蕾期的花适量,参照多糖多酚植物总RNA提取试剂盒的步骤提取总RNA[14],分别于琼脂糖凝胶(1.5%)电泳和微量分光光度计检测RNA的完整性及纯度。根据Thermo反转录试剂盒说明书,将提取的RNA反转录合成cDNA第一链。
2.1.2LmPAL2基因核心片段扩增 从本课题组前期获得的灰毡毛忍冬转录组测序结果中,筛选出标注为PAL的序列,应用Primer Premier 软件设计特异性引物PAL2-F和PAL2-R(见表1),以cDNA第一链为模板进行PCR扩增。PCR反应体系与扩增程序参考文献[10],其中引物为PAL2-F和PAL2-R。对PCR扩增产物进行电泳检测,利用胶回收试剂盒回收目的条带,按照pEASY-T1 Cloning Vector 说明书的步骤进行连接、转化、筛选,将挑选出的白斑进行菌液PCR,并委托上海生工生物工程有限公司测序。
2.1.3LmPAL2基因5’-和3’-RACE扩增 根据“2.1.2”项下测得的LmPAL2基因核心片段设计5’-和3’-RACE 引物PAL2-5’和PAL2-3’(见表1)。按照RACE 试剂盒说明书分别合成LmPAL2基因的5’-和3’-RACE-Ready cDNA,再分别进行5’-及3’-RACE扩增。PCR反应体系与扩增程序参考文献[10],其中引物为PAL2-5’和PAL2-3’。回收RACE 扩增产物和T载体克隆等同“2.1.2”项下,所用载体为Blunt。
2.1.4LmPAL2基因cDNA全长的获得及验证 采 用Conting Express软 件 对5’-和3’-端 序列进行拼接,得到LmPAL2基因的cDNA序列全长。根据序列全长设计验证引物V-PAL2-F和V-PAL2-R(见 表1),以“2.1.1”项 下 得 到的cDNA第一链为模板进行全长验证。PCR反应体系与扩增程序参考文献[10],其中引物为V-PAL2-F 和V-PAL2-R。回收目的条带、克隆等同“2.1.2”下,所用载体为Blunt。
2.2 LmPAL2 基因生物信息学分析
应用NCBI 在线软件查找LmPAL2基因的ORF,通过ProtParam 软件在线预测其编码蛋白的分子量、分子式、不稳定系数及等电点等;利用ProtScale 软件测定其蛋白亲/疏水性;采用WOLF PSORT 在线预测蛋白质亚细胞定位情况;TMHMM 分析蛋白质的跨膜结构;SignalP 4.1 Server 预测信号肽;InterProScan分析蛋白质结构域;SOPMA和SWISS-MODEL分别预测蛋白质的二级和三级结构;通过NCBI的蛋白质序列数据库进行BLAST 比对,筛选出同源性较高的物种,再利用DNAMAN 软件进行氨基酸多重序列比对,并用MEGA软件构建系统进化树。
2.3 LmPAL2 基因在不同花期和不同器官的表达
根据LmPAL2基因cDNA全长序列,设计荧光定量PCR的特异性引物Q-PAL2-R 和Q-PAL2-F(见表1)。采用“2.1.1”项下灰毡毛忍冬7个花期的花及茎、叶的RNA,定量至100 ng·μL-1后反转录合成各自的cDNA第一链,以18 S rRNA为内参基因,在荧光定量PCR 仪上进行qRT-PCR。反应体系与扩增程序参考文献[10],其中引物为Q-PAL2-R和Q-PAL2-F。每个样品重复3次,采用2-ΔΔCt法计算基因的相对表达量。
3 结果与分析
3.1 LmPAL2基因克隆
3.1.1 总RNA的提取 灰毡毛忍冬花总RNA电泳结果见图1,28 S和18 S条带清晰可见,其中28 S条带亮度约为18 S的2倍,提示提取的总RNA完整性良好,A260/A280值在1.8~2.0,A260/A230值>2.0,说明总RNA质量较好,能够满足后续实验要求。

图1 总RNA电泳图Fig 1 Electrophoresis of total RNA
3.1.2LmPAL2基因核心片段扩增 通过RT-PCR扩增得到约700 bp的单一条带(见图2),经过回收、T载体克隆与测序,确定该核心片段序列长为693 bp。采用DNAMAN比对,与转录组测序所得序列基本一致。

图2 LmPAL2基因核心片段扩增产物Fig 2 PCR product core fragment of LmPAL2 gene
3.1.3LmPAL2基 因5’-和3’-RACE扩 增 及cDNA全长验证5’-和3’-RACE扩增结果均提示在1300 bp附近有一亮带(见图3A及3B)。将5’-和3’-端测序结果与核心片段序列拼接后,得到LmPAL2基因cDNA全长序列2425 bp。对其进行全长验证,在2400 bp左右发现一明显亮带(见图3C),将亮带回收、克隆并测序,结果与拼接全长序列一致。

图3 LmPAL2 基因克隆凝胶电泳Fig 3 Clone gel electrophoresis map of LmPAL2 gene
3.2 LmPAL2 基因生物信息学分析
3.2.1 蛋白理化特性 灰毡毛忍冬PAL2基因全长2425 bp,包含一个2124 bp的ORF,序列编码707个氨基酸(见图4),命名为LmPAL2,其GenBank登录号为:MH779889。推测其分子式为C3402H5441N949O1038S25,相对分子质量为77.05 kD,等电点为6.23,不稳定系数为32.51,属于稳定蛋白,亲水性平均系数为-0.207,预测其为亲水性蛋白。亚细胞定位推测LmPAL2蛋白可能定位于叶绿体中。蛋白跨膜结构预测该基因编码的氨基酸均在膜外,不具有跨膜区域。信号肽预测分析,LmPAL2蛋白中无信号肽序列,推测其为非分泌蛋白。

图4 LmPAL2全长序列及推测的氨基酸序列Fig 4 Full-length cDNA sequence of LmPAL2 gene and predicted amino acid sequence
3.2.2 蛋白结构域和二、三级结构 蛋白结构域预测LmPAL2蛋白属于PAL家族,包含PAL 保守结构域,并且含有PAL/HAL 活性中心序列GTITASGDLVPLSYIAG。LmPAL2 蛋白的二级结构预测,其组成以α-螺旋和随机卷曲为主,分别占55.59%和29.56%。LmPAL2 蛋白的三级结构预测结果见图5。

图5 LmPAL2 蛋白三级结构预测图Fig 5 Prediction of tertiary structure of LmPAL2 protein
3.2.3 氨基酸序列同源性比对和系统进化树分析LmPAL2氨基酸序列同源性比对结果显示,其 与 忍 冬Lonicera japonica(AGE10590.1)、葡萄Vitis vinifera(ANB59163.1)、猕 猴 桃Actinidia deliciosa(QED11030.1)、山 茶 花Camellia japonica(AFJ80777.1)、唐 松 草Thalictrum thalictroides(KAF5182779.1)、梨Pyrus bretschneideri(ASV49150.1)及 罂 粟Papaver somniferum(XP_026403210.1)的同源性在84.27%~99.15%。氨基酸多重序列比对结果见图6,分析发现这些物种均含有GTITASGDLVPLSYIAG 酶活性中心序列。

图6 LmPAL2 与其他植物PAL 蛋白的多序列比对分析Fig 6 Multiple sequence alignment of LmPAL2 and other plant PAL proteins
从NCBI 中下载与LmPAL2同源性较高的部分植物PAL基因家族氨基酸序列,应用MEGA软件构建NJ 系统进化树(见图7)。系统进化树主要聚为三支,灰毡毛忍冬Lonicera macranthoides与忍冬Lonicera japonica、向日葵Helianthus annuus、罂粟Papaver somniferum、猕猴桃Actinidia deliciosa、柑橘Citrus clementina以及梨Pyrus bretschneideri聚为一支,其中与同科同属的忍冬亲缘关系最近。
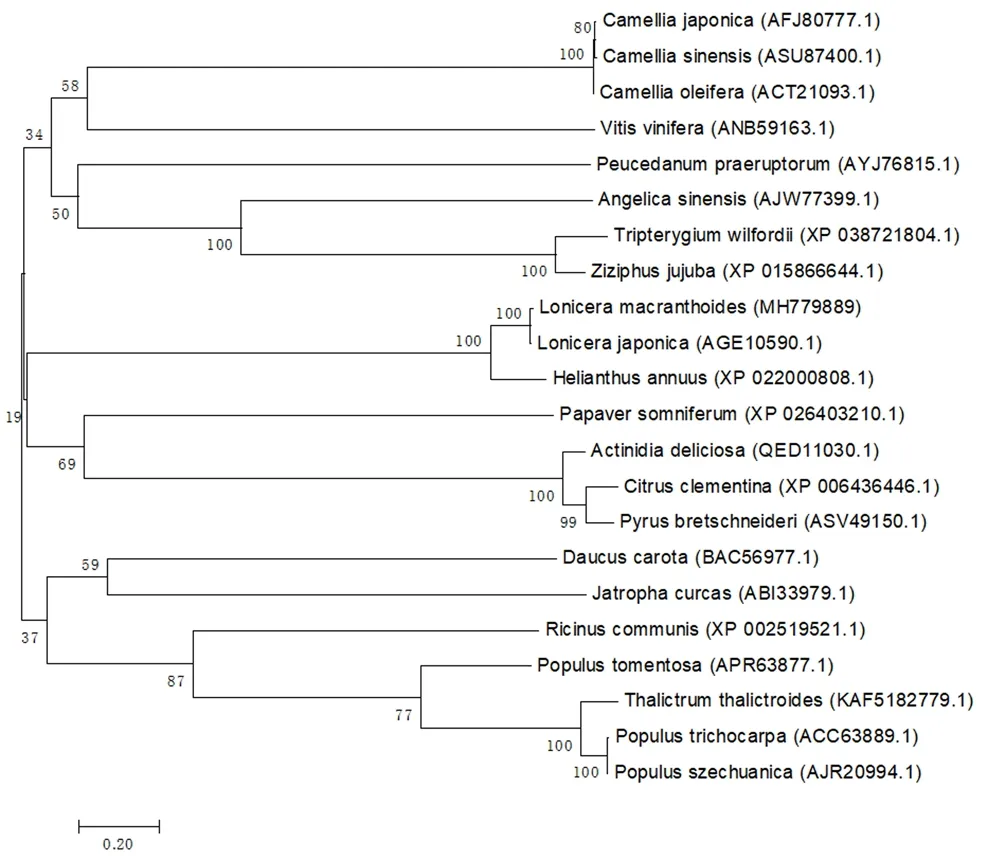
图7 LmPAL2 蛋白的NJ 系统进化树Fig 7 Neighbor-joining phylogenetic tree of LmPAL2 proteins
3.3 LmPAL2 基因不同花期和不同器官的表达分析
LmPAL2基因在不同花期的相对表达量结果表明,其在绿白色花蕾期表达强烈,花蕾初期、青绿色花蕾期和金黄色花期次之,枯萎期表达量最低(见图8)。而LmPAL2基因在不同器官中的相对表达量结果显示,叶中的表达量最高,其次是白色花蕾期,茎中最低(见图9)。

图8 LmPAL2基因在不同花期中的相对表达量Fig 8 Relative expression of LmPAL2 gene in different flowering stages

图9 LmPAL2基因在不同器官中的相对表达量Fig 9 Relative expression of LmPAL2 gene in different organs
4 讨论
本研究克隆得到PAL2基因cDNA序列全长,其中ORF为2124 bp,编码707个氨基酸。与本项目组前期获得的PAL1基因ORF为2145 bp,编码714个氨基酸相比[10],存在稍许差异,这也验证了同一植物多基因家族中的各个基因编码长度不尽相同[15]。同源性比对结果显示,LmPAL2与LmPAL1的相似度为82.77%。两者均含有PAL典型结构域和活性中心,只是氨基酸的位点有所不同。
PAL是催化苯丙烷类代谢第一步反应的限速酶,在植物次生代谢、生长发育和防御中发挥着重要的作用[16]。因此,PAL基因在许多植物中得到广泛的研究。蓖麻RcPAL基因表达上调时木质素含量显著增加,下调时则相反,表明RcPAL基因是蓖麻木质素生物合成的关键基因[17]。膜荚黄芪中的AmPAL2基因的表达可能与毛蕊异黄酮葡萄糖苷的积累密切相关[18]。茉莉花JsPAL2基因可能与茉莉花香气物质的合成有关[19]。水稻OsPALS基因通过调节水杨酸和木质素的生物合成和积累,提高水稻对褐飞虱的抗性[20]。关于PAL参与绿原酸生物合成的功能研究也早已开展。大豆PAL2基因转化烟草后,转基因植株叶中的PAL转录水平提高5倍,且叶中绿原酸含量显著增加[21]。拟南芥AtPAL2基因在转基因烟草中的过表达使绿原酸的含量增加了1倍[22]。忍冬LjbZIP8在转基因烟草中过表达通过抑制NtPAL1、NtPAL2和NtPAL4的表达,降低了新绿原酸、绿原酸和隐绿原酸的含量,也间接说明PAL是绿原酸生物合成途径中的关键基因[23]。
在大多数植物中,PAL基因属于一个基因家族,PAL家族的每个成员表现出明显的表达模式和活性差异[24]。如忍冬LJPAL1和LJPAL3基因的表达量花蕾>叶,而LJPAL2则为花蕾略低于叶[25]。红腺忍冬LHPAL1基因的表达量花蕾>叶,LHPAL2和LHPAL3基因的表达量则为叶>花蕾[25]。华南忍冬PAL1基因的表达量为叶>花蕾,PAL2基因花蕾略低于叶,PAL3基因则花蕾明显高于叶[26]。灰毡毛忍冬LmPAL1基因的表达量为白色花蕾期花>茎>叶[10],而LmPAL2则为叶>白色花蕾期花>茎。这也提示PAL基因家族成员在苯丙氨酸代谢途径的功能调控中存在差异。
本研究中LmPAL2基因在绿白色花蕾期强烈表达,结合课题组前期研究,灰毡毛忍冬不同花期的绿原酸含量测定结果显示,从绿白色花蕾期开始,绿原酸的含量逐渐上升,至金黄色开花期达到峰值[11],初步推测LmPAL2表达丰度的升高,促进了后期绿原酸的合成。后续可通过构建植物表达载体,转入转基因植株以开展LmPAL2基因参与绿原酸合成的功能验证研究。
本研究完成了灰毡毛忍冬LmPAL2基因的克隆,并比较了其在不同花期和不同器官的表达差异,为进一步研究灰毡毛忍冬次生代谢产物绿原酸积累的分子调控机制提供依据,为通过基因工程技术培育出绿原酸含量更高的优良品种奠定基础。
