牛膝和白芍配伍对帕金森病肝阳上亢证小鼠的 协同神经保护作用及机制研究
2021-12-30张静艳郭科东金明荣华张晓杰黑龙江中医药大学基础医学院哈尔滨150000齐齐哈尔医学院病理学院黑龙江齐齐哈尔161000黑龙江护理高等专科学校哈尔滨150000
张静艳,郭科东,金明,荣华,张晓杰(1.黑龙江中医药大学基础医学院,哈尔滨 150000;.齐齐哈尔医学院病理学院,黑龙江 齐齐哈尔 161000;3.黑龙江护理高等专科学校,哈尔滨 150000)
关健词:帕金森病;肝阳上亢证;牛膝;白芍;氧化应激;核因子NF-E2相关因子2;血红素氧合酶1
帕金森病(Parkinson disease,PD)是中老年人群常见的椎体外系神经退行性疾病,以静止性震颤、姿势异常、行动障碍为主要临床表现,严重者会造成情绪、记忆及认知功能障碍。中脑黑质致密部大量多巴胺(dopamine,DA)能神经元进行性丢失及路易小体异常聚集为其典型的病理表现[1]。PD患者脑组织抗氧化酶活性显著减少,脂质过氧化水平异常增加[2],而活性氧形成过量和DA能神经元功能障碍及死亡密切相关[3]。目前,寻找具有抗氧化能力及神经保护作用的药物已经成为PD治疗的重要方向[4]。
镇肝熄风汤为《医学衷中参西录》的经典方剂,具有良好的抗氧化作用,在肝阳上亢型PD的治疗实践中已经取得显著疗效[5-6]。然而大复方由于成分众多,药味间作用关系复杂,药物配伍在复方中的真实作用难以准确反映。牛膝与白芍是镇肝熄风汤的核心药对,是治疗PD方剂中出现频率较高的药对,课题组前期体外实验已经证实,牛膝与白芍有效组分配伍对DA能神经元具有协同增效的神经保护作用[7],但其配伍的体内实验及抗PD的具体机制鲜有研究。本研究采用中医特色明显的病证结合动物模型,通过行为学实验、生化检测及分子生物学等方面探讨牛膝和白芍配伍对PD肝阳上亢证小鼠氧化应激反应的调节机制,为临床中药复方的二次开发及应用提供实验基础。
1 材料
1.1 动物
SPF级8周龄健康C57BL/6雄性小鼠90只,体质量(20±2)g [辽宁长生生物技术股份有限公司,动物许可证号:SCXK(辽)2020-0001]。饲养条件:室温25℃,湿度40%~50%。
1.2 试药与仪器
附子(湖北金贵中药产业有限公司,批号:D4120201);牛膝、白芍(北京同仁堂有限公司,批号:801000130、801001062),分别取附子、牛膝、白芍及牛膝白芍配伍组4组饮片按传统煎药法制成含附子、牛膝、白芍及牛膝白芍配伍组(生药量分别为0.2、0.33、0.17、0.5 g·mL-1)水煎液。镇肝熄风汤(齐齐哈尔医药商厦,相当于生药量为1.67 g·mL-1,经齐齐哈尔医学院药物研究所鉴定专家进行鉴定);1-甲基-4苯基-1,2,3,6-四氢吡啶(MPTP,美国Sigma公司,批号:M0896);兔抗鼠酪氨酸羟化酶(TH,批号:58844S)、Lamin B抗体(批号:13435S)(CST公司);兔抗鼠核因子NF-E2相关因子2(Nrf2)、血红素氧合酶1(HO-1)抗体(Abcam公司,批号:ab137550、ab189491);谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号分别为:A003-4-1、A001-3-2、A006-1-1)。全自动凝胶成像仪(美国Bio-Rad公司);SA102转棒式动物疲劳测试仪(江苏赛昂科技有限公司)。
2 方法
2.1 模型建立与给药
小鼠随机分为对照组、模型组、镇肝熄风汤组、牛膝组、白芍组及牛膝白芍配伍组,每组15只。除对照组外,各组给予附子汤(3 g·kg-1)灌胃4周制备肝阳上亢证动物模型[5]。附子灌胃结束后,牛膝、白芍及牛膝白芍配伍组分别按4.5、2.3、6.8 g·kg-1灌胃给予相应药物水煎液,镇肝熄风汤组给予镇肝熄风汤(25 g·kg-1),1次·d-1,连续灌胃给药14 d。于给药第10日开始,灌胃给药前1 h,模型组及各给药组小鼠连续5 d腹腔注射MPTP(30 mg·kg-1)制备PD肝阳上亢病症结合小鼠模型[8]。造模结束后以小鼠出现易激惹、竖毛、弓背、震颤、抽搐等症状即视为模型建立成功[9]。本次模型制备全部成功。
2.2 小鼠易激惹程度的评定
易激惹程度分为3级:Ⅰ级为小鼠头颈部被捉持时立即表现出尖叫、惊跳等症状;Ⅱ级为小鼠头颈部被捉持时表现出攻击行为;Ⅲ级为小鼠尾部被提起时即表现出尖叫、惊跳或攻击行为。Ⅰ~Ⅲ级均不出现者为0级,实验结束前测量1次[10]。
2.3 行为学检测
2.3.1 旷场实验 实验前适应环境1 h。实验时将小鼠放于旷场箱(50 cm×50 cm)中央,采用旷场实验分析系统记录小鼠运动总路程,测试时间为5 min[11]。
2.3.2 转棒实验 实验前对小鼠进行预先训练,转速30 r·min-1,训练时间为3 min,连续训练2 d。实验时以0.12 r·min-1的加速度从4 r·min-1开始恒定加速,最大转速为40 r·min-1,记录小鼠在5 min内,在转棒上停留的时间,即转棒掉落潜伏期[12]。
2.4 免疫组化法分析TH阳性神经元平均光密度
黑质区取材进行石蜡包埋切片,脱蜡,抗原修复,3%H2O2封闭。PBS漂洗后滴加兔抗TH多克隆抗体(1∶200),室温孵育。PBS漂洗后滴加羊抗兔二抗孵育1 h。DAB工作液显色,苏木素复染,PBS充分冲洗返蓝并封片。在显微镜下观察黑质中TH表达阳性的神经元并拍片,根据Image-Pro Plus 6.0软件计算各组平均光密度。
2.5 氧化应激指标测定
于冰上取适量小鼠脑黑质,加入9倍预冷的生理盐水制备10%组织匀浆,离心(2500 r·min-1,15 min)后取上清液,按照试剂盒说明采用生物化学法测定GSH与MDA的表达水平及SOD的活性。
2.6 Western blot检测相关蛋白表达
冰上取脑组织剪碎,加入蛋白酶抑制剂及裂解液震荡混匀,以12 000 r·min-1离心10 min,取上清液即为所提蛋白溶液。另取脑黑质按照核蛋白抽提试剂盒说明书抽提核蛋白,均采用BCA法进行蛋白定量。SDS凝胶电泳分离蛋白,转膜、封闭。分别加入一抗Nrf2(1∶1000)、HO-1(1∶1000)、β-actin(1∶500)及Lamin B(1∶1000),于4℃孵育过夜,二抗(1∶6000)孵育,TBST缓冲液洗膜。ECL化学发光法显影后,采用AlphaEase FC图像分析软件对免疫印迹条带进行分析。
2.7 统计学方法
采用SPSS 20.0统计学软件对数据进行分析,计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD方法,等级资料采用Ridit分析,P<0.05表示差异有统计学意义。
3 结果
3.1 牛膝白芍配伍对小鼠易激惹程度的影响
与对照组相比,模型组小鼠易激惹程度明显增加;与模型组相比,镇肝熄风汤组、牛膝组、白芍组及配伍组均可不同程度改善小鼠的易激惹程度(见表1)。
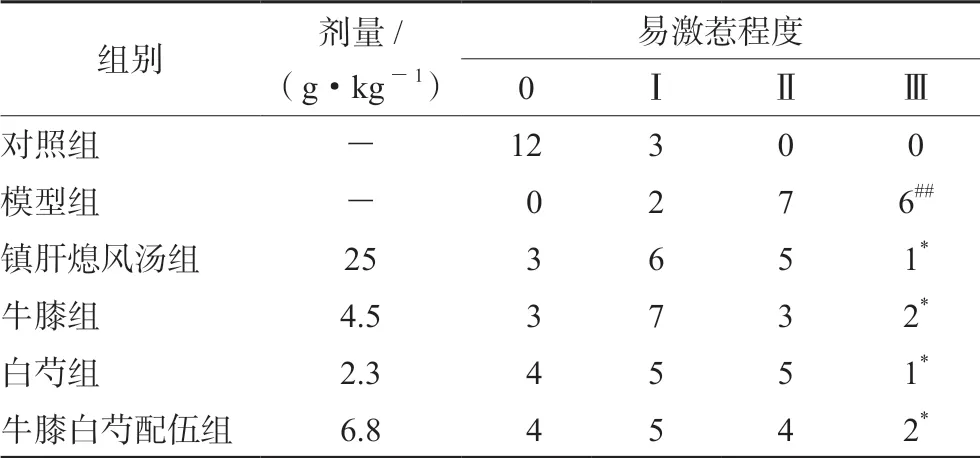
表1 各组小鼠易激惹程度的比较(n=15) Tab 1 Irritation degree of the mice in each group (n=15)
3.2 牛膝白芍配伍对小鼠行为学的影响
与对照组相比,模型组小鼠旷场运动总距离明显减少、转棒掉落潜伏期明显缩短;与模型组相比,各给药组均可不同程度增加小鼠旷场运动总距离、延长转棒掉落潜伏期;配伍组作用明显优于牛膝和白芍单独用药组;配伍组与镇肝熄风汤组相比,差异无统计学意义(见图1及图2)。

图1 各组小鼠旷场实验运动轨迹Fig 1 Movement trajectory of the mice in each group in the open field experiment
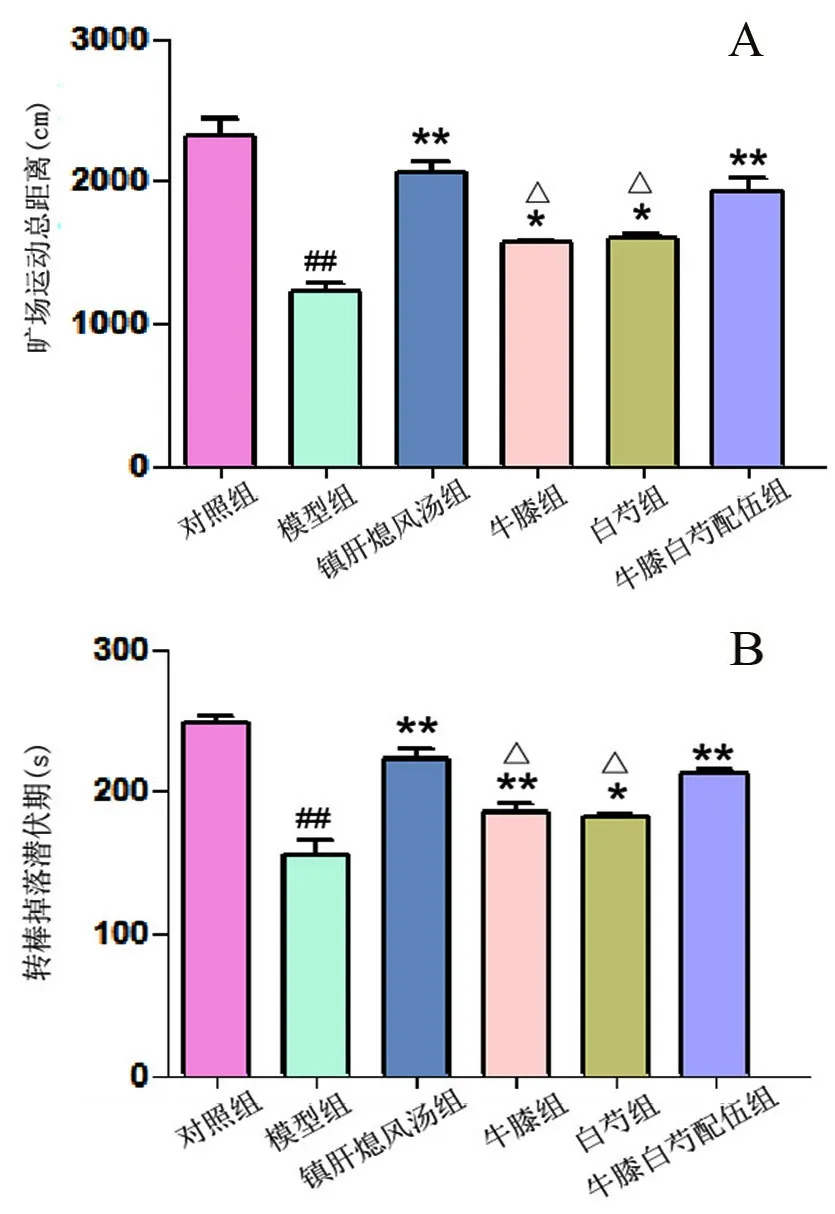
图2 各组小鼠行为学比较(±s,n=15)Fig 2 Behavioral comparison of mice in each group(±s,n=15)
3.3 牛膝白芍配伍对小鼠神经细胞TH阳性表达比较
与对照组相比,模型组黑质TH阳性表达明显减少;与模型组相比,各给药组可不同程度增加TH阳性表达水平;与牛膝、白芍单独用药组相比,配伍组TH阳性表达增加更为明显;配伍组与镇肝熄风汤组相比,差异无统计学意义(见图3)。
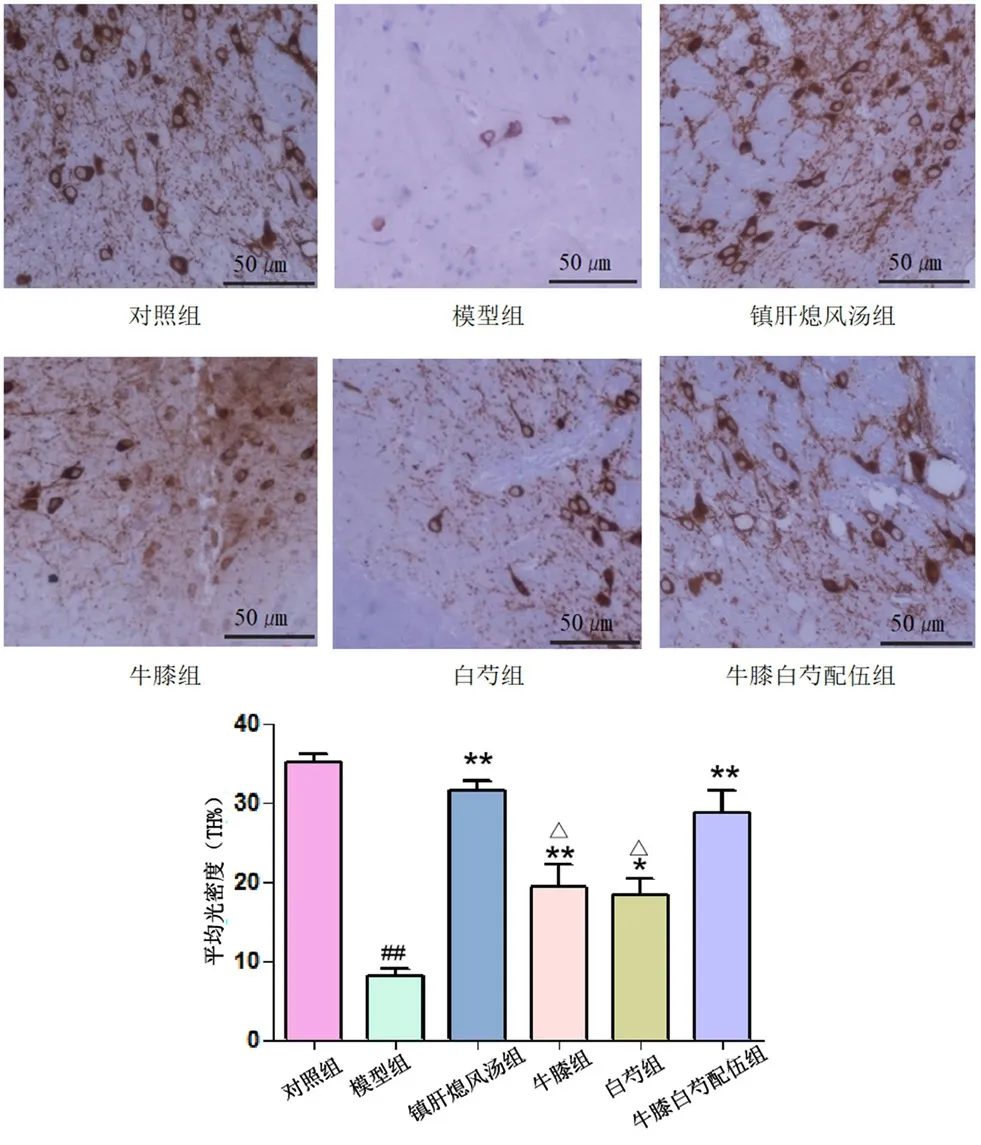
图3 各组小鼠黑质神经细胞TH阳性表达的比较(±s,n=5)Fig 3 Positive expression of TH in the substantia nigra of the mice in each group(±s,n=5)
3.4 牛膝白芍配伍对小鼠脑组织氧化应激指标的影响
与对照组相比,模型组小鼠脑黑质抗氧化物质SOD活性、GSH水平明显降低,氧化物质MDA水平明显增高;与模型组相比,镇肝熄风汤组、牛膝组及配伍组可不同程度逆转SOD活性、GSH及MDA的水平,而白芍组对改善氧化应激作用不明显;配伍组改善氧化应激效应明显优于牛膝、白芍单独用药组;配伍组与镇肝熄风汤组相比,差异无统计学意义(见图4)。
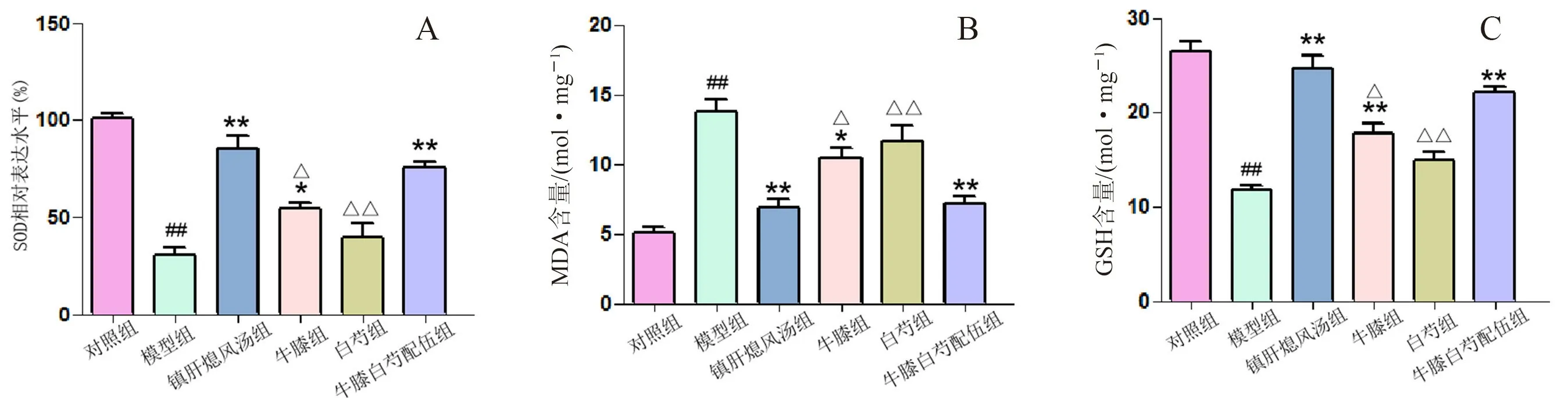
图4 各组小鼠脑组织氧化应激指标的比较(±s,n=6)Fig 4 Oxidative stress index of the mice in each group(±s,n=6)
3.5 牛膝白芍配伍对小鼠脑组织Nrf2、HO-1蛋白表达的影响
与对照组相比,模型组黑质核Nrf2蛋白、浆HO-1蛋白表达水平未见明显差异;与模型组相比,镇肝熄风汤组、牛膝组及配伍组核Nrf2、浆HO-1蛋白表达量均明显增加,而白芍组蛋白表达虽有增加趋势,但差异无统计学意义;配伍组蛋白表达明显优于牛膝、白芍单独用药组;配伍组与镇肝熄风汤组相比,差异无统计学意义(见图5)。
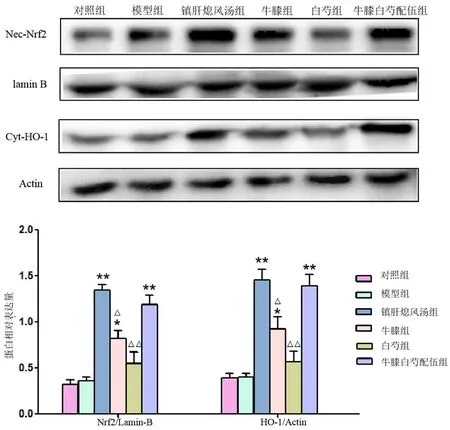
图5 小鼠脑组织Nrf2、HO-1蛋白表达比较(±s,n=5)Fig 5 Nrf2 and HO-1 protein expression in the brain tissue of mice(±s,n=5)
4 讨论
随着社会人口老龄化趋势的逐年加重,PD的发病率日益增加,如何对该疾病进行有效治疗已成为医药界研究的重点课题[13]。西医治疗PD不良反应明显,长期持续治疗药效减退,且不能阻止病情的进展[14]。肝肾阴虚、肝阳上亢是PD的核心中医病机,临床研究报道了镇肝熄风汤对PD肝阳上亢证的防治,疗效确切[15]。然而中药大复方药味繁多,药对的具体作用难以在方剂中研究与确定。牛膝白芍是镇肝熄风汤的核心配伍药对,牛膝补益肝肾、引火下行,具有明显的抗氧化、调节免疫作用[16-17];白芍养血濡筋、缓急止痉,具有神经保护、镇痛抗炎作用[18]。前期体外实验表明,牛膝和白芍的主要有效成分能抑制鱼腾酮诱导的PC12细胞凋亡,有效成分配伍后作用增强[7]。基于“组分配伍研制现代中药”的理念,本课题组提取镇肝熄风汤的君药牛膝和臣药白芍为核心配伍药对,探讨两者配伍对DA能神经元是否具有协同神经保护作用及具体作用机制。
附子辛燥大热,久服耗伤阴血,附子灌胃可制备肝阳上亢证动物模型,使动物出现烦躁、易怒(易激惹)症状[5,10];MPTP是啮齿及灵长类PD研究中使用最多的外源性神经毒素,可选择性损伤DA能神经元并诱导PD的发生发展[19]。研究表明,由MPTP复制的PD模型小鼠的运动功能明显异常且DA能神经元数量显著减少[20]。TH是催化DA、肾上腺素等神经递质合成的限速酶[21],常用于验证PD模型是否构建成功,细胞表达TH是判断DA能神经元数目的黄金标准[22]。本实验结果表明,以附子灌胃联合腹腔注射MPTP制备的PD肝阳上亢证小鼠模型,其激惹程度明显增加,旷场运动总距离明显减少,转棒掉落潜伏期明显缩短,TH阳性表达减少,人类肝阳上亢型PD的行为特征及病理特点在本实验小鼠模型中得到了较好的模拟。本研究发现,各给药组可不同程度降低小鼠激惹程度,增加旷场运动总距离,延长转棒掉落潜伏期,减少TH阳性神经元的丢失,说明牛膝、白芍及两者配伍均可有效改善小鼠肝阳上亢症状及运动功能障碍,减少DA能神经元损伤,并且配伍组比单独用药组的治疗效果更为显著。
PD的发生与氧化应激密切相关[22],研究表明神经毒素MPTP会使神经元产生大量氧自由基而诱发氧化应激[23]。氧自由基使神经元膜结构被氧化,产生大量MDA,使得DA能神经元变性及缺失[24],因此MDA可间接反映组织氧化损伤的水平[25]。为应对过度氧化,机体在氧化应激刺激下产生抗氧化物SOD及GSH。SOD可抑制氧自由基生成[23],GSH对氧化应激产物进行还原[27],SOD及GSH水平体现机体对抗氧化损伤的能力[28]。为检测小鼠脑内氧化应激的损伤程度,本课题组检测了氧化与抗氧化反应的标志物。结果发现,模型组小鼠黑质MDA含量明显增高,SOD及GSH水平明显降低,说明模型组小鼠脑内氧化应激损伤明显。而经药物治疗后,牛膝组及配伍组小鼠脑内氧化应激反应出现不同程度的改善,且配伍组改善氧化应激的效果较优。
Nrf2是诱导机体产生抗氧化酶以对抗氧化应激的重要因子[29]。在细胞发生氧化应激或受内源性、外源性反应性物质如H2O2、超氧化物攻击时,生理条件下位于细胞质中非活性状态的Nrf2蛋白被激活,与其结合蛋白发生解离,转位至细胞核,诱导SOD、GSH的表达,减少脂质过氧化物MDA生成,并启动下游抗氧化酶HO-1的转录[30-31]。研究发现,HO-1能保护器官免受氧化应激[32],其表达减少与PD等年龄依赖性疾病的发病机制有关[33]。本研究表明,牛膝组及配伍组均可促进神经细胞Nrf2的核内表达并诱导其下游产物HO-1转录增加,改善脑内的氧化应激状态,其中配伍组效应最强,其作用与镇肝熄风汤相当,而白芍组对PD肝阳上亢证小鼠虽有抗氧化趋势,但作用不明显。本实验结果说明,牛膝与白芍虽对PD肝阳上亢证小鼠均具有神经保护作用,但两者在抗氧化及相关靶通路发挥的作用仍存在差异,白芍在两者配伍中发挥的作用将另文报道,牛膝白芍配伍发挥抗氧化作用的机制与牛膝的抗氧化功能相关,两药配伍后发挥协同增效的神经保护作用。
综上,牛膝白芍配伍可有效改善PD肝阳上亢证小鼠的易激惹程度及行为障碍,保护DA能神经元,两药配伍具有协同作用,其机制可能是通过牛膝激活Nrf2/HO-1信号转导通路发挥抗氧化作用。本实验证明牛膝白芍两药配伍在治疗PD肝阳上亢证方面存在相使作用,虽然其治疗机制有待进一步研究,但是本实验为中药配伍“相使增效”的科学理论及中药大复方的二次优化升级提供了更多实验依据。
