VEGF-C在慢性疼痛所致认知功能障碍中的作用
2021-12-30鲁燕陈永权
鲁燕,陈永权
(皖南医学院第一附属医院麻醉科,安徽 芜湖 241000)
慢性疼痛定义为“一种不愉快的感觉和情绪上的感受,伴有或潜在的组织损伤”,疼痛如果持续3~6个月以上则称为慢性疼痛,慢性疼痛常伴有心理或精神改变甚至功能障碍,但其具体机制不明。研究发现[1],神经病理性疼痛导致海马突触结构和功能受损是认知障碍的重要病理基础。而血管内皮生长因子C(vascular endothelial growth factor-C,VEGF-C)在调控神经干细胞分化、轴突发育等方面发挥着重要功能。VEGF-C的主要分布在星形胶质细胞上,在神经损伤大鼠模型中其在大鼠海马组织中常呈低表达[2]。
本研究通过大鼠在体实验,构建慢性疼痛认知功能障碍模型,检测慢性疼痛所致认知功能障碍时大鼠VEGF-C分泌情况,同时检测GFAP、Nestin、NeuN的表达情况。体外干预星形胶质细胞中VEGF-C的分泌水平,检测其对共培养神经干细胞的分化以及轴突发育的影响,同时检测共培养体系GFAP、Nestin、NeuN的表达水平,旨在通过体外体内实验深入阐述VEGF-C在介导慢性疼痛认知功能障碍发生发展过程中的作用,为慢性疼痛认知功能障碍的临床诊断和治疗应用提供理论依据。
1 材料与方法
1.1 试剂与仪器
BCA试剂盒(北京中杉金桥生物技术有限公司),兔抗GFAP、兔抗Nestin、兔抗NeuN 一抗(均为美国LSBio),通用型二抗试剂盒(上海博蕴生物科技有限公司),离心机( JW3021HR,安徽嘉文仪器装备有限公司),酶标仪(美谷分子仪器有限公司),倒置显微镜(德国徕卡公司),电子显微镜(日本Hitachi公司),SM2010R型切片机(德国徕卡公司),FACSVantage SE分选型流式细胞仪(美国BD公司),引物由上海桑贡合成生物工程技术服务有限公司(中国上海)制作及合成,重组载体和病毒包装质粒购自爱康得生物科技有限公司(中国苏州)。
1.2 实验动物
60只8周龄雄性SD大鼠,体质量为180~220 g,购自上海实验动物中心(SLAC),所有实验大鼠置于通风的动物室内,保持22 ℃,正常饮水,维持正常的昼夜节律。该实验已获得动物伦理审批,审批编号为20191287。
1.3 大鼠慢性疼痛认知功能障碍模型制造
60只大鼠随机分为两组(n=30):对照组与实验组。按照Decosterd等[3]的方法,实验通过手术暴露大鼠的坐骨神经,同时结扎胫神经和腓总神经,对坐骨神经分别进行机械性疼痛刺激、针刺刺激、冷痛觉刺激及热痛觉刺激,术后24 h内即可出现痛觉超敏反应。
1.4 Morris水迷宫测试认知功能
采用Morris水迷宫实验测定大鼠的空间记忆和学习记忆能力,进而分析大鼠的认知功能。定向航行实验测量大鼠获取学习记忆的能力。根据目前国内主流的设计方法[4],设计特制的水迷宫。大鼠完成定向航行训练后,对实验组大鼠进行相应处理干预。空间搜索实验用于测量学会寻找平台后,保持对平台空间位置记忆的能力。选取大鼠在定位航行术后1、3、5 d的逃避潜伏期作为学习能力监测指标,并在空间搜索中的术后第6天穿环次数作为空间记忆能力监测指标。
1.5 ELISA法检测血清VEGF-C浓度
处死大鼠前用非抗凝真空管取尾静脉血2 mL。获取血样后,采用ELISA法检测血清VEGF-C浓度。
1.6 蛋白印迹法检测Nestin、GFAP、NeuN蛋白表达情况
处死大鼠并取大鼠脑组织,提取组织蛋白,用BCA试剂盒进行蛋白浓度定量。将蛋白质提取物在样品中煮沸缓冲液10 min,在10%聚丙烯酰胺上分离凝胶,并转移到 PVDF 膜。膜用5%牛血清白蛋白,并与稀释后的Nestin(1∶1000)、GFAP(1∶10 000)、NeuN(1∶1500)一抗孵育。然后膜在 TBST 中洗涤并与相应的温育二抗。GAPDH被用作内部参考。使用WB曝光仪检测膜。评估图像使用Image J 软件。
1.7 大鼠原代星形胶质细胞及神经干细胞的分离和培养
取对照组大鼠,在无菌条件下断头取出脑组织,剪去脑干仅留大脑半球,充分剪碎脑组织,再移入50 mL含胰酶的PBS离心管中,用吸管反复吹打消化至肉眼观察无明显的脑组织团块;加入DMEM/F12完全培养基终止消化,再次反复吹打制成单细胞悬液,加定量完全培养液制成细胞悬液,并置于5% CO2恒温细胞培养箱培养,并在镜下观察细胞的生长和存活情况。通过免疫荧光染色法鉴定星形胶质细胞及神经干细胞。
1.8 慢病毒转染干预VEGF-C分泌水平
本实验选择慢病毒过表达载体pLV-puro以及shRNA干扰载体pEco-Lenti-U6-shRNA-(Puro),根据starbase数据库中提供的VEGF-C的核酸序列,利用Primerpremier 5.0设计引物进行PCR得到VEGF-C的DNA序列,引物序列为左:5′-TCAAGGACAGAAGAGACTATAAAATTTGC-3′,右:5′-ACTCCAAACTCC-CCCCACAT-3′,双酶切构建过表达VEGF-C的过表达载体,构建其shRNA的重组载体,用重组载体转染细胞。根据是否转染的重组载体,将细胞分为过表达组、敲减组和空载组。
1.9 细胞增殖成球实验检测神经干细胞分化
用细胞球形成效率(sphere formation efficiency,SFE)表示神经干细胞在合适的条件培养基中自我更新的能力。将共培养的细胞接种于6孔板培养,DMEM培养基,37 ℃孵育2 w后,用0.1%晶体紫的固定染色细胞,计算细胞团的个数。
1.10 镜检轴突发育
全脑组织或者体外培养细胞,用盐水洗净并固定用2.5%戊二醛溶液。海马在倒置显微镜下切下组织。海马 CA1区1 mm 3组织切片用 2.5%戊二醛溶液固定,洗涤用磷酸缓冲盐水(PBS),脱水,嵌入,切片并用柠檬酸铅和乙酸染色。用电子显微镜观察海马 CA1 区突触体周围的超微结构,突触体的数量由物理检查员进行计数和分析。
1.11 流式细胞仪检测神经干细胞周期
取培养细胞,用胰蛋白酶消化制备成细胞悬液,1000 r离心10 min,弃上清液。加入70%乙醇固定液重悬细胞,固定30 min。再次离心、洗涤后,用RNA酶消化细胞,用碘化丙锭作为染料,处理细胞20 min。在流式细胞仪488 nm激发波长下测定。观察并记录处于分裂期(含S期及G2/M期)的细胞百分数。
1.12 蛋白印迹法检测Nestin、GFAP、NeuN蛋白表达情况
裂解并研磨细胞,提取细胞中蛋白,余处理同组织WB检测。
1.13 统计学方法

2 结 果
2.1 两组Morris水迷宫测试结果
Morris水迷宫实验显示,逃避潜伏期随着训练时间增加而缩短,但对照组和实验组两组间逃避潜伏期差异无统计学意义。对实验组进行处理后,实验组逃避潜伏期高于对照组,差异有统计学意义(P<0.05),见图1。

*与对照组比较:*P<0.05
2.2 血清VEGF-C浓度比较
对照组血清VEGF-C值为(48.66±6.54)pg/mL,实验组为(27.08±2.60) pg/mL,两者组间差异有统计学意义(F=10.25,P=0.016,0.05)。
2.3 两组脑组织GFAP、Nestin、NeuN蛋白表达情况
实验组GFAP蛋白表达显著高于对照组,而Nestin、NeuN表达量显著低于对照组,差异有统计学意义(P<0.05),见表1、图2。

图2 对照组与实验组GFAP、Nestin、NeuN的WB表达情况

表1 对照组与实验组GFAP、Nestin、NeuN表达量
2.4 细胞增殖成球实验及轴突发育计数结果
3组间SFE及及轴突发育计数两两比较,敲减组的SFE及轴突发育计数均低于空载组级过表达组,过表达组SFE及轴突发育计数稍高于空载组,过表达组处于分裂期细胞显著多于其余两组,差异有统计学意义、见表2。
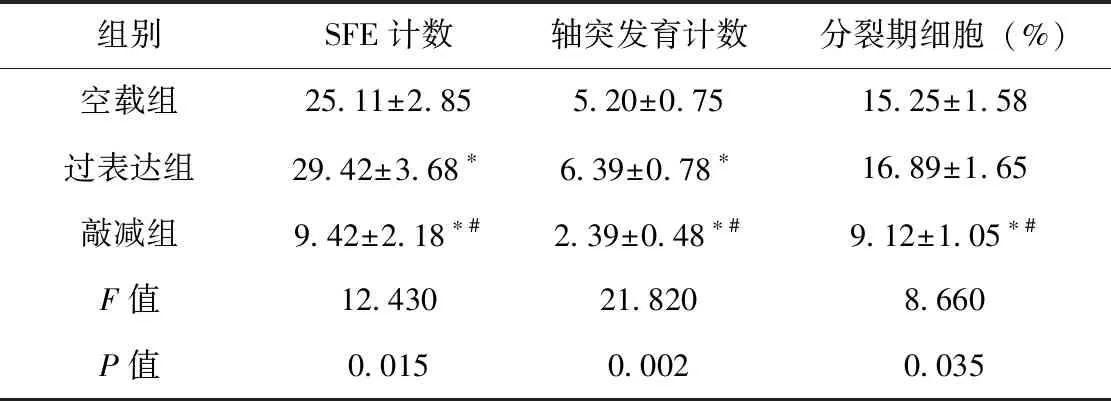
表2 3组间SFE及轴突发育计数
2.5 3组细胞GFAP、Nestin、NeuN蛋白表达情况
3组间GFAP、Nestin、NeuN表达量两两比较,过表达组Nestin、NeuN表达量显著高于空载组,GFAP低于空载组,敲减组Nestin、NeuN表达量显著低于空载组,GFAP高于空载组,差异有统计学意义,见图3、表3。

图3 3组间GFAP、Nestin、NeuN的WB表达情况

表3 3组间GFAP、Nestin、NeuN表达量
3 讨 论
一般疼痛持续3~6个月或更长时间被定义为慢性疼痛,慢性疼痛时,通常伴有持续性的有害刺激或伤害[5],慢性疼痛常发生于创伤性神经、脊髓或脑损伤后,也可伴发于糖尿病、带状疱疹后遗神经病、多发性硬化症、癌症等疾病[6]。慢性疼痛常会对患者造成巨大影响,如免疫力下降、异常的应激反应、食欲减退、引发失眠、焦虑、抑郁等神经精神症状,严重时可致自杀等。同时,越来越多的临床证据也表明,慢性疼痛可能会导致患者的认知功能受到损伤[7]。Moriarty[8]等认为,对于慢性疼痛患者,其认知会受到疼痛的负面影响,包括注意力、学习和记忆、信息处理的速度和精神运动能力、执行功能等均会下降,这种影响将成为日常活动和康复的主要障碍。但目前,对于慢性疼痛导致患者认知功能受损的发病机制尚不明了,临床也缺乏治疗手段,因此,积极探索研究其发病机制,寻找新的治疗靶点以及阐述其可能介导的分子机制具有重要的临床意义。
目前的研究认为,慢性疼痛导致认知功能障碍的发生,主要因为大脑中某些区域受到损伤[9]。同时,慢性疼痛还会加速脑部老化[10],其中大脑左右的海马体常有受累。海马体在人的记忆和认知等方面起到关键作用,受损后往往很难逆转[11]。一系列研究表明,慢性疼痛引发的认知功能障碍和患者海马组织的损伤是密切相关的,包括学习障碍和记忆障碍[12],多项临床研究数据显示慢性疼痛患者的海马结构和功能发生了变化[13]。神经损伤大鼠模型的海马体神经元减突触可塑性降低,而后者是海马体发挥学习和记忆功能的基础[14-15],海马区星型胶质细胞的数量减少可能会影响神经元的功能,进而导致认知功能障碍。
血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)是血管内皮生长因子家族中的一员,在血管生成、淋巴管生成、内皮细胞生长和存活等方面具有活性,并能影响血管通透性[16-17]。此外,VEGF-C在调控神经干细胞分化、轴突发育等方面也发挥着重要功能。Heinolainen等[18]发现VEGF-C结合受体VEGFR3后可以激活静止NSCs进入细胞周期,并产 生祖细胞,并介导细胞内AKT和ERK通路的激活,调控神经干细胞增殖。Cho等[19]发现VEGF-C的缺失对非洲爪蟾和小鼠胚胎大脑中的神经发育起损害作用,并且NSCs内VEGF-3的条件缺失将影响成年小鼠脑室下区(subventricular zone,SVZ)中的神经发生。在这一基础上,本实验进一步研究了VEGF-C对于神经干细胞的分化以及轴突发育的影响,以及慢性疼痛引发的认知功能障碍过程中,大鼠体内VEGF-C的分泌水平。并且通过Western Blot定性与定量检测星形胶质细胞特异性标志蛋白GFAP以及神经干细胞特异性标志蛋白Nestin、NeuN的表达水平,旨在揭示VEGF-C的水平与神经干细胞、星形胶质细胞活性水平的关系。
本研究的结果显示,在动物模型上,Morris水迷宫测试显示慢性疼痛模型的大鼠出现认知功能障碍,说明模型构筑成功,同时,慢性疼痛实验组的血清VEGF-C表达较对照组降低,这可能是海马体星形胶质细胞受损导致VEGF-C胞外分泌减少,脑组织蛋白定量也显示,慢性疼痛实验组的GFAP蛋白表达升高、Nestin、NeuN的蛋白表达较实验组降低,说明慢性疼痛不仅影响星形胶质细胞,对神经干细胞也有损伤作用。本实验在离体细胞模型上进一步验证VEGF-C的作用机制。分别设计VEGF-C的 shRNA以及过表达载体,通过慢病毒转染原代星形胶质细胞,敲减和过表达VEGF-C,并与原代神经干细胞进行共培养,分别从上调和下调两方面,对VEGF-C的细胞内外水平变化以及下游调控通路进行检测。结果发现,VEGF-C敲减后,神经干细胞的分化和轴突发育均受到影响,GFAP、Nestin、NeuN等特异性标志蛋白的表达大大下降,说明VEGF-C的下调对星形胶质细胞与神经干细胞皆有负面作用,这可能是慢性疼痛引发的认知功能障碍的基础。但本研究仍无法证实是星形胶质细胞活化引起VEGF-C的下调还是VEGF-C下调使得星形胶质细胞活化,同时,是否有其他类型VEGF分子机制参与这一过程,可能需要生物信息学分析以及进一步的实验进行证实。
