基于纳米压痕技术研究药物对胃肠道间质瘤细胞机械特性的影响
2021-12-30王文思员瑜王佳敏施佳林蹇林格赵滢张天彪
王文思,员瑜,王佳敏,施佳林,蹇林格,赵滢,张天彪
(1.中国医科大学生命科学学院生物化学与分子生物学教研室,沈阳 110122;2.中国科学院沈阳自动化研究所机器人研究室,沈阳 110016;3.四川大学华西临床医学院,成都 610041;4.中国医科大学附属盛京医院胃肠营养外科,沈阳 110004)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性恶性肿瘤[1]。1983年,美国病理学家MAZUR和CLARK首先提出了GIST的概念[2]。GIST每年发病率约为10/100万~20/100万[3],常发生在50岁以上人群。在约80%的GIST中发现致癌的c-kit突变,其11号外显子突变是GIST中最常见的致癌突变(67%)[4],这些突变包括点突变、框内缺失或插入,其余的突变为9号外显子编码突变(10%),13和17号外显子中有较小程度的激活突变(<2%)。约15%的GIST由血小板源性生长因子受体α(platelet-derived growth factor receptor α,PDGFRα)多肽激活驱动,12、14和18号外显子显示致癌突变。野生型GIST占GIST的5%~10%,不含c-kit或PDGFRα突变。由于受体酪氨酸激酶信号依赖,GIST可以用酪氨酸激酶抑制剂有效治疗,如伊马替尼、舒尼替尼和索拉非尼。尽管大多数患者的初始反应良好,但随着时间的推移,异质性耐药机制的发展,大多数患者的病情都有所进展。目前进行的研究旨在评估具有其他作用机制的药物,单独或与伊马替尼或其他酪氨酸激酶抑制剂联合使用,以避免高耐药率。有研究[5]显示,靶向蛋白激酶B抑制剂MK-2206似乎不足以抑制GIST细胞的生长和存活,然而将MK-2206与伊马替尼联合使用可显著提高疗效。目前的数据表明,在GIST中靶向多个分子靶点比单一治疗更有效,未来可尝试在临床中实践应用。
原子力显微镜利用探针接触分子水平和细胞水平的样品,可对生物体在近生理环境下进行纳米级成像及力学特性研究[6]。原子力显微镜由微悬臂、检测系统、施加力和距离的反馈控制系统、压电陶瓷控制的移动系统、获取数据与分析系统组成。许多疾病的起源可以从细胞的力学性质来考虑,如细胞黏弹性的改变和杨氏模量的改变与癌症转移和恶性转化有关。原子力显微镜的力学测量提供了一种潜在的、基于单细胞尺度进行疾病诊断的新方法,探究其检测过程中力学性质的转变与人类疾病进展的关联性,进而挖掘出力学检测方法在药效评估中的潜在价值[7]。
从患者体内分离的原代细胞比已经建立的来源相似的细胞系更适合于实验研究,可能更准确地模拟患者情况,为体外药物敏感性试验和设计个体化治疗方案提供更好的工具。本研究成功建立原代GIST细胞,将伊马替尼与舒尼替尼联合用药作为GIST新的治疗方案,分析二者联合有无协同增效作用,并利用原子力显微镜对原代培养的GIST细胞进行药物作用后机械特性测量,初步探讨二者联合作用的价值。
1 材料与方法
1.1 材料
甲磺酸伊马替尼片购自瑞士Novartis Pharma Schweiz AG公司,苹果酸舒尼替尼胶囊购自意大利Pfizer公司,胎牛血清购自中国Gibco公司,RPMI-1640、胰酶、双抗购自以色列BI公司,CCK-8试剂盒购自美国Invigentech公司,胶原酶购自美国Sigma公司,PCR引物的合成和序列测定由上海生工生物公司完成,QIAamp RNA Mini Kit、QIAGEN OneStep RTPCR Kit购自德国QIAGEN公司。伊马替尼和舒尼替尼分别配制成2 000 μmol/L的母液,-80 ℃保存,使用时倍比稀释至3.91、7.81、15.63、31.25、62.50、125.00 μmol/L浓度的工作液。
1.2 原代细胞培养
仔细剔除GIST组织外周可能污染和坏死的组织,标本用D-Hanks液洗2次,再用含双抗的无血清RPMI-1640冲洗5~6次。在培养皿中用无菌眼科剪将GIST组织中心剪成数个小组织块(尽量避开血管),尽量剪碎。将剪碎的组织块移到离心管中再次洗涤3次。加入2倍体积的1 mg/mL胰酶和1 mg/mL胶原酶,37 ℃培养箱内消化60 min。收集单个和小块组织的瘤细胞,1 000 r/min离心5 min,洗涤3次,接种于细胞培养瓶中,培养条件为含15%胎牛血清的RPMI-1640,置入37 ℃、5%CO2培养箱内。第2天轻轻吸弃上清液,换新鲜培养液,此后每隔5 d换液或传代1次。
1.3 PCR实验
采用QIAGEN RNeasy Mini Kit进行GIST细胞总RNA进行提取。基因引物序列:c-kit8号外显子,上游引物5’-CAGCAGTCTGACCTATGGC-3’,下游引物5’-GCTCAGCTCCTGGACAGAAA-3’;c-kit9号 外显子,上游引物5’-GATTGATTGATTGATTTTCCTAG-3’,下游引物5’-GCAGGCAGAGCCTAAACATC-3’;c-kit11号外显子,上游引物5’-CCAGAGTGCTCTAAT GACTGAGA-3’,下游引物5’-AAACAAAGGAAGCC ACTGGA-3’;c-kit13号外显子,上游引物5’-TACTG CATGCGCTTGACATC-3’,下游引物5’-TAATCTAG CATTGCCAAAATCA-3’;c-kit17号外显子,上游引物5’-CATCATTCAAGGCGTACTTTTG-3’,下游引物5’-TGCAGGACTGTCAAGCAGAG-3’;PDGFRα12号外显子,上游引物5’-TCCAGTCACTGTGCTGCTTC-3’,下游引物5’-AAGACTCCCTTTTCCCTTGC-3’;PDGFRα14号外显子,上游引物5’-ACTGGTTTTGGTTCCCAC AG-3’,下游引物5’-CAATGATTCGCAGCAACG-3’;PDGFRα18号外显子,上游引物5’-ACCATGGATCA GCCAGTCTT-3’,下游引物5’-GGTCAGGCTCATCC TCCTTCA-3’。按照QIAGEN OneStep RT-PCR Kit说明书进行PCR扩增体系配制及PCR扩增。
1.4 CCK-8法测定GIST细胞体外药物敏感性
将生长处于对数期的贴壁GIST细胞消化后转移至离心管,1 000 r/min低速离心离心5 min,进行细胞计数。实验分为空白对照组、伊马替尼组、舒尼替尼组和联合用药组,每组设置5个复孔,每孔加入稀释好的细胞悬液。接种48 h,细胞贴壁生长良好后吸出各孔培养基。分别加入31.25 μmol/L伊马替尼、15.63 μmol/L舒尼替尼以及31.25 μmol/L伊马替尼和15.63 μmol/L舒尼替尼联合处理的细胞生长液,放入孵箱分别培养24、48和72 h。药物处理相应时间后,加入10% CCK-8溶液,放入孵箱继续培养3 h,待培养基液体变为橙色即可放入酶标仪检测。酶标仪波长设定为450 nm,测定吸光度值,分析数据。
1.5 原子力显微镜检测GIST细胞杨氏模量
应用Icon 原子力显微镜(美国Veeco)和MLCT探针(弹性系数为0.01 N/m),以2 μm/s的速率在近生理条件下,测定药物作用前后原代培养的GIST细胞的杨氏模量,即细胞机械弹性。逼近曲线记录了探针在逼近接触细胞并在细胞表面产生压痕的过程,回退曲线记录了探针从细胞表面回退到原始位置的过程。分析逼近曲线,计算不同药物处理后GIST细胞的杨氏模量值。每个实验组测量5个GIST细胞,每个细胞压10条以上力曲线。
根据计算公式(1)和(2)可知需要测量得到悬臂梁的偏转量x和压痕深度δ,其余的参量为已知的或是通过实验测量得到的[8]。应用Nanoscope ⅣAFM系统和商用Nanoscope软件进行数据分析。
1.6 统计学分析
2 结果
2.1 GIST细胞原代培养
取瘤组织消化后进行培养,于倒置显微镜下观察,原代培养的GIST细胞呈梭型、多角形、核大,互不重叠,呈单层生长。见图1。
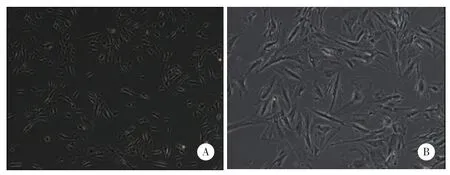
图1 GIST细胞倒置显微镜下图像Fig.1 Inverted microscopic image of gastrointestinal stromal tumor cells
2.2 外显子测序分析
对原代培养的GIST细胞进行总RNA的提取,并对c-kit和PDGFRα基因的8个外显子进行核酸扩增和正向、反向测序比对,见图2。得到的序列与NCBI中Blast库的序列进行比对,发现c-kit基因11号外显子发生点突变,胸腺嘧啶突变为腺嘌呤,为杂合性突变。此点突变致使GIST细胞11号外显子的第559位氨基酸由由缬氨酸(GTT)突变为天冬氨酸(GAT),导致了GIST的发生,见图3。其余外显子无突变。本研究中,原代培养的GIST细胞已经传30余代,在传至30代时进行以上测序,未发现二次突变。
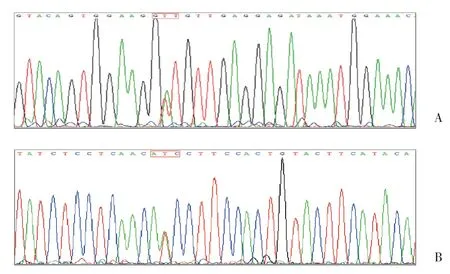
图2 c-kit基因11号外显子发生点突变Fig.2 Point mutation in exon 11 of the c-kit gene
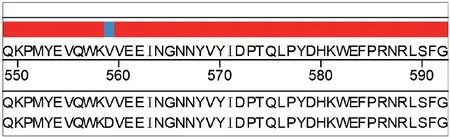
图3 第559位点缬氨酸突变为天冬氨酸Fig.3 Mutation of valine to aspartic acid at site 559
2.3 药物敏感性结果
CCK-8实验结果显示,伊马替尼单独作用于GIST细胞24 h时,7.81 μmol/L浓度组与对照组比较,细胞抑制率的差异有统计学意义(P< 0.05,图4A)。舒尼替尼单独作用于GIST细胞24 h时,15.63 μmol/L浓度组与对照组比较,细胞抑制率的差异有统计学意义(P< 0.05,图4B)。2种药物对GIST细胞的作用均呈时间与浓度依赖性。联合用药组为等浓度联合作用,抑制效果更显著(图4C)。
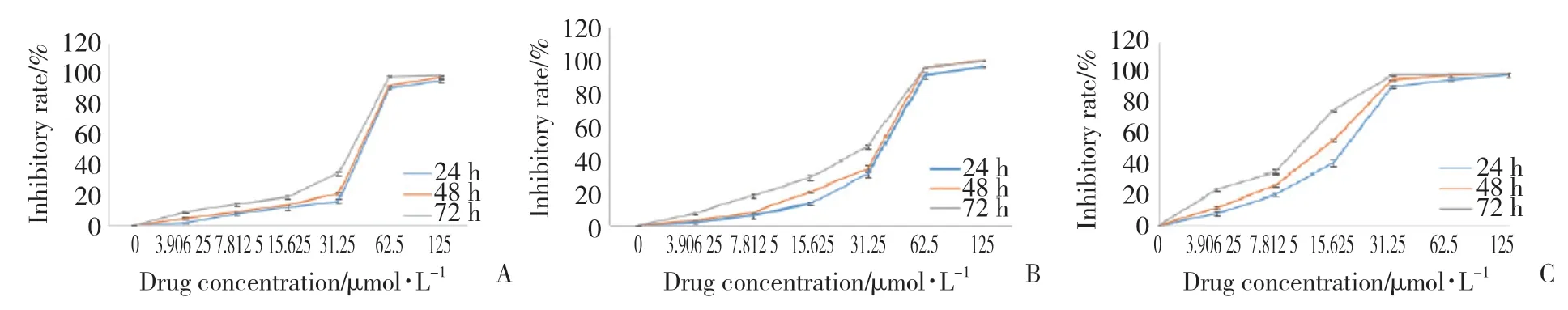
图4 伊马替尼和舒尼替尼单独和联合作用于GIST细胞时细胞增殖率的变化Fig.4 Changes in proliferation rate of GIST cells treated with imatinib and sunitinib alone or in combination
药物作用48 h时,伊马替尼组的IC50值为34.23±0.37,舒尼替尼组为28.85±0.52,同浓度联合用药组为11.97±0.18。CompuSyn是一款根据Chou-Talalay数学模型建立的应用软件,通过计算联合指数(combination index,CI)分析两药联合作用效果:CI<1时,两药为协同作用效果;CI=1时,两药为叠加作用效果;CI>1时,两药为拮抗作用效果。本研究结果显示,当生长抑制率Fa<1时,大部分CI<1,且Fa值越小CI值越小。当Fa值介于0.1~0.7之间时,CI值介于0.90~0.98之间,说明两药联合作用效果较好。因此,本研究后续实验单独用药组选择31.25 μmol/L伊马替尼和15.63 μmol/L舒尼替尼(此时两药抑制率均在80%左右),联合用药组选用同浓度药物处理细胞,此浓度下联合作用为协同作用。
2.4 杨氏模量测量结果
采用Icon 原子力显微镜和MLCT探针对GIST细胞测量杨氏模量(图5),药物作用48 h后,空白对照组杨氏模量为(8.26±1.06)kPa,伊马替尼组为(4.90±0.54)kPa,舒尼替尼组为(5.51±0.79)kPa,联合用药组为(2.66±1.08)kPa。高斯拟合结果(图6)显示,伊马替尼和舒尼替尼均可引起细胞杨氏模量减小,联合用药效果更显著(P< 0.01)。

图5 MLCT针尖图像和探针测量细胞杨氏模量Fig.5 Image of MLCT tip and measurement of Young's modulus by probe
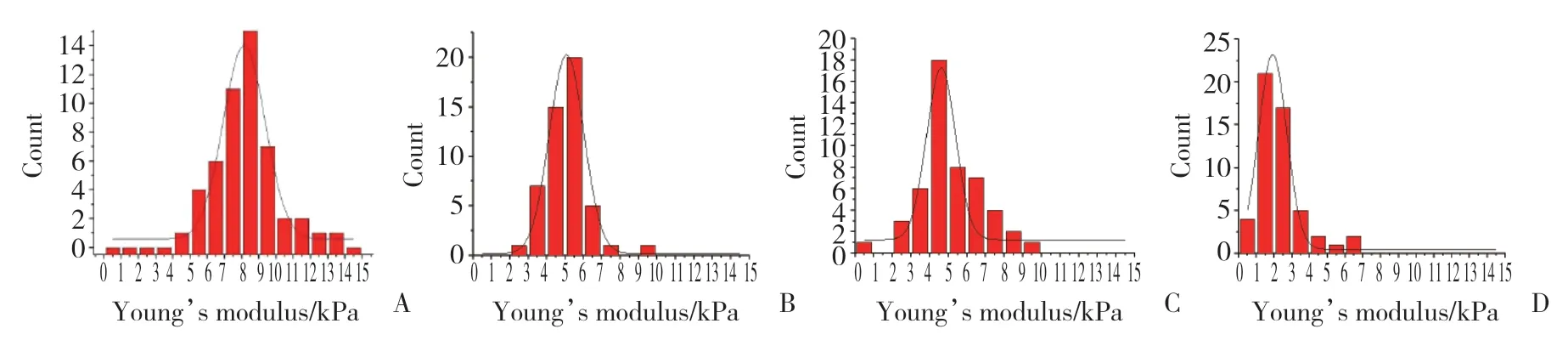
图6 GIST细胞杨氏模量高斯拟合函数分布Fig.6 Gaussian fitting function distribution of Young’s modulus of gastrointestinal stromal tumor cells
3 讨论
GIST的发生、发展由多种肿瘤相关分子突变所致,目前认为c-kit或PDGFRα受体酪氨酸激酶的组成型激活突变是致癌的起始事件。突变的受体蛋白在不依赖配体的情况下持续自我激活,引起下游信号通路蛋白增多,导致细胞增殖和分化、肿瘤形成。
伊马替尼作为酪氨酸激酶抑制剂,最初被美国食品药品监督管理局批准用于治疗慢性粒细胞白血病,之后被批准作为转移性和复发性GIST的一线药物。然而,大多数患者会在2年内出现继发性耐药[9]。研究[10]显示,在具有GIST 11号外显子密码子557~558突变的患者中,伊马替尼治疗后患者也存在生存时间减少的趋势。因此,迫切需要能够与伊马替尼联合应用的凋亡诱导剂。而舒尼替尼既可抑制血管内皮生长因子受体和转染过程中的重排,又可以阻断肿瘤生长所需的血液和营养物质供给,有可能解决GIST患者的伊马替尼耐药性问题。
本研究成功培养c-kit基因11号外显子发生点突变的GIST细胞,V559D为GIST细胞突变的热点。为研究舒尼替尼对伊马替尼处理GIST细胞的增效作用,本研究采用CCK-8实验检测两药单独和联合用药对GIST细胞的增殖抑制作用。结果显示,2种药物对原代培养的V559D突变的GIST细胞均有明显的生长抑制作用,呈时间与剂量依赖性,且联合用药的抑制效果大于单独用药(P< 0.05)。
从生物学角度分析,细胞对外界刺激的机械反应和细胞内部的生物力学反应,对保持细胞的生物活性具有重要意义。细胞通过改变自身行为和重塑微环境,动态适应机械因素的刺激,这种动态适应的结果不仅对胚胎发育和成人生理具有决定性作用,还与许多疾病密切相关。如在癌症形成过程中,为了促进与肿瘤转移相关的微血管生成和建立,癌细胞杨氏模量和黏附力逐渐降低。同样,侵袭性细胞通常杨氏模量和黏附性更低,但在不同器官和来源于不同器官的癌细胞中可能有不同的结论。这种机械特性的变化可能是由肌动蛋白丝引起的,肌动蛋白骨架的溶解导致杨氏模量显著降低[11]。因此,机械特性近来被认为是一种新的生物标志物,而细胞表面机械特性研究另外一个最大的优势,在于能够在保证细胞存活的拟生理条件下,对活细胞进行检测,进而得到大量有效仿真的生物学数据。
有研究[12]指出,伊马替尼通过降低鞘氨醇-1-磷酸进而引起肺癌细胞骨架蛋白重新分布,并同时降低了细胞的杨氏模量。LEE等[12]发现,肿瘤坏死因子-α刺激内皮细胞后,机械刚度增加了50%。KUNG等[13]则指出,顺铂处理的黑色素瘤细胞可以增强细胞骨架的机械拉伸,还可促进细胞骨架的重排,导致细胞杨氏模量降低43%。CAI等[14]采用不同浓度的青蒿琥酯作用细胞24 h后,发现细胞的杨氏模量下降了近三分之一。WANG等[15]指出,与对照样品相比,经佛波酯处理的K562细胞的弹性模量增加了近3倍。因此,本研究采用纳米压痕技术,在拟生理状态下,对GIST细胞表面机械特性的变化进行检测,从而探讨药物产生的作用。通过检测伊马替尼、舒尼替尼及二者联合用药处理前后GIST细胞机械强度的变化,通过软件测量分析发现药物处理后GIST细胞杨氏模量降低,联合用药效果更明显。原子力显微镜的纳米力学检测技术可实现在近生理条件下测定癌细胞机械强度变化,为药物研发早期评估抗癌药物作用效率方面提供依据。
综上所述,伊马替尼和舒尼替尼对GIST细胞有增殖抑制作用,呈作用时间与剂量依赖性,联合用药时表现为协同作用。本研究基于纳米压痕技术发现,伊马替尼和舒尼替尼均降低了GIST细胞的杨氏模量,联合用药时机械性能改变更明显。
