不同提取方式对萱草花中酚类物质及抗氧化活性的影响
2021-12-30田怀香陈小燕于海燕袁海彬
田怀香,陈 霜,陈小燕,于海燕,黄 娟,袁海彬,陈 臣
不同提取方式对萱草花中酚类物质及抗氧化活性的影响
田怀香,陈 霜,陈小燕,于海燕,黄 娟,袁海彬,陈 臣※
(上海应用技术大学香料香精化妆品学部,上海 201418)
为了研究超声、酶解-超声以及发酵-超声3种不同提取方式对萱草花中酚类物质的含量、组成形态及抗氧化活性的影响,以明黄、桔黄、桔红、朱红、大红5种颜色的萱草花为原料,检测不同萱草花中总黄酮和总多酚含量以及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)自由基清除率;利用高效液相色谱对游离态、共轭态和结合态3种形态酚类化合物进行测定,并研究其与抗氧化活性的关系。结果表明,不同颜色的萱草花中总黄酮和总多酚含量各不相同,其含量从高到低排列为:“红鹦鹉”、“63#”、“健壮力兰”、“玫瑰犀牛”、“太阳舞”。不同品种和不同提取方式的萱草花抗氧化性均存在显著(<0.05)差异,发酵-超声提取方式下“红鹦鹉”、“63#”、“健壮力兰”、“玫瑰犀牛”、“太阳舞”对DPPH自由基清除率的维生素C当量分别为44.32、40.63、38.24、37.64、35.60 mg/g,对ABTS自由基清除率的维生素C当量分别为39.74、36.24、30.88、28.38、24.88 mg/g;“红鹦鹉”对DPPH清除率的维生素C当量由超声时的38.24 mg/g升高到酶解-超声后的41.49 mg/g和发酵-超声后的44.32 mg/g;对ABTS自由基清除率的维生素C当量由超声时的31.82 mg/g上升到发酵-超声后的39.74 mg/g和酶解-超声时的35.12 mg/g;可知发酵-超声提取下萱草花的抗氧化性优于酶解-超声和超声。在萱草花酚类物质的3种形态中,游离态含量最高,占总含量的75%以上;经酶解和发酵后显著(<0.05)提高了“红鹦鹉”中大部分游离态酚类化合物的含量,新检出了对香豆酸,发酵后游离态槲皮素含量是超声提取时的3倍;游离酚的DPPH和ABTS自由基清除率的维生素C当量分别从超声时的40.53和35.57 mg/g升高到了发酵-超声时的48.20和47.40 mg/g。游离态中的绿原酸、芦丁、咖啡酸和槲皮素与抗氧化活性相关性高,对抗氧化活性贡献大。研究为萱草花在食品和化妆品的开发利用提供了一定的理论基础。
提取;酚类物质;萱草花;抗氧化活性;游离酚
0 引 言
萱草(L.),别名黄花菜、金针花、忘忧草等,植物隶属百合科,属于多年生草本植物[1]。萱草花是萱草属植物萱草的花蕾,其营养价值较高,其根、茎、叶、花均可入药,在中国已有三千多年的食用历史[2]。有研究测定,每百克萱草花(干质量)中含有质量分数为60%的碳水化合物、14%的蛋白质、0.4%的脂肪以及丰富的铁、钙、磷等微量元素和胡萝卜素[3]。萱草花中含有丰富的生物活性物质,如多酚、类黄酮、生物碱、蒽醌等,具有抗氧化、抗抑郁、抗癌等作用[4]。其中,多酚作为一种重要的活性物质,可以阻止细胞的退化、衰老,有效清除体内的自由基[5]。研究萱草花中酚类物质提取工艺和分析检测抗氧化成分,有利于开发萱草花中生物活性物质资源,可提高萱草花利用率,促进萱草花产业的发展。
目前,已有大约8 000种酚类物质从植物中被分离鉴定出来,其中黄酮类化合物属于低分子量的酚类物质[6]。酚类物质的常用提取方法为超声波提取法。杨婉对超声辅助提取美藤果壳酚类物质的工艺条件进行了研究,酚类物质的提取率可达54.10 mg/g[7]。在本课题组前期研究中,利用超声提取萱草花中的类黄酮,提取率为36.25 mg/g[8],前期只研究了超声提取的萱草花中的类黄酮的效果,没有对比更多的提取方式对类黄酮提取率的影响。超声法简便、效率高,但存在活性物质无法全部提取出来的问题,因此利用酶解和微生物发酵技术耦合超声提取可提高生物活性成分的含量,是近年来植物提取技术中新的研究方向。酚类物质在植物中,通常以游离态、共轭态和结合态形式存在,通过酶解和发酵可以使共轭态和结合态的酚类物质向游离态进行转变[9]。刘皓涵等[9]研究了欧李多酚超声辅助酶解提取工艺,在最佳提取条件下多酚提取量为42.63 mg/g。利用微生物发酵的方法,发酵过程中产生酚酸脱羧酶、去羟酶等会削弱共轭、结合的酚类物释质与细胞壁之间的醚键,增加游离态酚类物质的含量及其的活性[10-12]。在Ricci等[13]的研究中,发现乳酸菌在樱桃汁发酵中,促进了底物中几种酚类化合物的代谢转化,游离酚含量和抗氧化性明显增强。然而,目前的文献中尚未有采用微生物发酵法辅助花类植物中多酚类物质提取的报道,因此考察发酵处理花类植物对其多酚类物质及抗氧化活性的影响有助于推动花类植物生物活性物质领域的研究。
萱草花种类繁多,笔者课题组前期对20种萱草花的类黄酮成分进行分析检测,证明了不同品种的萱草花中类黄酮含量存在显著差异[14]。然而,目前关于萱草花的研究主要集中在药理方面,对萱草花中酚类物质的提取方式,酚类物质的形态及其抗氧化活性的研究较少。基于此,本研究采用超声、酶解-超声和发酵-超声3种方式提取5种萱草花中酚类物质,通过总黄酮和总多酚含量以及DPPH(1,1-diphenyl- 2-picrylhydrazyl,1,1-二苯基-2-三硝基苯肼)、ABTS((2, 2'-azino-bis (3-ethylbenzothiazoline-6- sulfonic acid),2,2'-联氮-双- 3-乙基苯并噻唑啉-6-磺酸))自由基清除率的测定来比较不同品种的抗氧化活性;对较佳活性的萱草花品种提取3种形态的酚类物质,探究萱草花中酚类物质的组成与含量和抗氧化活性的关系。本研究旨在探究萱草花中酚类物质的不同提取方式对抗氧化活性及其成分组成的影响,同时评价不同萱草花品种抗氧化活性的大小,为萱草花在功能食品和化妆品的开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
萱草花,选用明黄、桔黄、桔红、朱红、大红5种色系的萱草花品种“太阳舞”、“玫瑰犀牛”、“健壮力兰”、“63#”、“红鹦鹉”为原料(2020年5—7月采摘于上海市新优园林植物繁育基地),为了避免其发生氧化褐变,采摘萱草花后,去除花柄、花蕊,迅速将花瓣放入真空冷冻干燥机速冻,冻干后粉碎,过100目筛,自封袋保存,置于干燥器中储存备用;植物乳杆菌ST-III(光明乳业股份有限公司)。
色谱级芦丁、儿茶素、异槲皮苷、表儿茶素、槲皮素、山奈酚、没食子酸、绿原酸、新绿原酸、咖啡酸、对香豆酸,上海源叶生物技术有限公司;纤维素酶(50 000 u/g)、果胶酶(>50 000 u/g)、葡萄糖、蛋白胨、色谱级甲酸、甲醇、乙腈和分析级芦丁、没食子酸、亚硝酸钠、九水合硝酸铝、氢氧化钠、碳酸钠、福林酚、柠檬酸、柠檬酸钠、维生素C、乙醇,上海探索平台试剂公司;分析级1,1-二苯基-2-三硝基苯肼(1,1-diphenyl- 2-picrylhydrazyl,DPPH)、2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis (3-ethylbenzothiazoline- 6-sulfonic acid),ABTS),上海国药集团试剂有限公司。
1.2 仪器与设备
Agilent 1260 Infinity和DAD检测器高效液相色谱仪,美国安捷伦科技有限公司;SB-5200DTD 超声水浴锅,宁波新芝生物科技有限公司;UV-2000紫外分光光度计,上海仪电分析仪器有限公司;FD-2C真空冷冻干燥机,上海比郎仪器制造有限公司;RE-5203旋转蒸发仪,上海亚荣生化仪器厂;粉碎机,青州市新航机械设备有限公司。
1.3 试验方法
1.3.1 超声提取萱草花中酚类物质
参考于海燕等[8]的方法略作修改。称取2.0 g萱草花粉末,按照1∶25(质量比)的料液比加入体积分数70%的乙醇,在50 ℃、300 kHz条件下超声提取两次,每次30 min,过滤,合并两次的滤液离心,取上清液备用。
1.3.2 酶解-超声提取萱草花中酚类物质
参考Bei等[15]的方法略作修改。称取2.0 g萱草花粉末,按照1∶25的料液比加入70%乙醇,加入3%的纤维素酶和2%的果胶酶,用柠檬酸-柠檬酸钠缓冲溶液调节pH值至4.8,在温度为45 ℃下酶解40 min,85 ℃水浴灭酶10 min,放置至25 ℃后,其余操作同超声处理。
1.3.3 发酵-超声提取萱草花中酚类物质
1)菌悬液制备
植物乳杆菌ST-III于-84 ℃保存在含有10%(体积分数)甘油的MRS(De Man,Rogosa and Sharpe)液体培养基中。试验时平板活化后挑取单一菌落接种于MRS液体培养基,37 ℃静置培养12~14 h,连续转接两代。而后参照GB 4789.2—2016[16]的平板计数法配制活菌数为1.5×109CFU/mL的菌悬液。
2)萱草花发酵-超声处理
参考文献[12]的方法略作修改。称取2 g萱草花粉末,按照1∶10的料液比加入20 mL去离子水制成萱草花浆,加入4%的葡萄糖和2%的蛋白胨,然后在121 ℃下灭菌15 min,按照3%比例接种植物乳杆菌ST-III,置于37 ℃培养24 h,将发酵后的萱草花按照1∶25的料液比加入70%的乙醇,其余操作同超声处理。
3)菌落计数及pH值的测定
采用平板计数法测定植物乳杆菌ST-III发酵萱草花过程中的活菌数[16],采用pH计测定萱草花发酵过程中的pH值。
1.3.4 3种酚类组分的提取
游离酚、共轭酚、结合酚的提取参考Bei等[15]的方法略作修改,3种酚类物质的提取方式及操作步骤如图1所示。
1)游离酚的提取
参考Bei等[15]的方法略作修改。准确称取2 g萱草花粉末,按照1∶25的料液比加入70%的乙醇,50 ℃、300 kHz超声30 min,提取两次,过滤离心,得到上清液,将乙醇用旋转蒸发仪蒸发掉,得到剩下的溶液,再用12 mol/L HCl调pH值至2.0,然后加入30 mL的乙酸乙酯,萃取3次,取上层清液用旋转蒸发仪在50 ℃蒸干,然后用甲醇溶解,定容至10 mL,0.22m有机滤膜过滤后,待测。
2)共轭酚的提取
参考Bei等[15]的方法略作修改。在用乙酸乙酯提取游离酚之后,共轭酚从剩下的水相中提取。将水相用40 mL 2 mol/L NaOH碱水解4 h,然后用12 mol/L HCl调pH值至2,然后加入30 mL的乙酸乙酯,萃取3次,取上层清液用旋转蒸发仪在50 ℃蒸干,然后用甲醇溶解,定容至10 mL,0.22m有机滤膜过滤后,待测。
3)结合酚的提取
参考Bei等[15]的方法略作修改。将1)中过滤得到的残渣用40 mL 2 mol/L NaOH碱水解4 h,再用12 mol/L HCl酸化调节pH值至2.0。然后加入30 mL的乙酸乙酯,萃取3次,取上层清液用旋转蒸发仪在50 ℃蒸干,然后用甲醇溶解,定容至10 mL,0.22m有机滤膜过滤后,待测。
4)总黄酮含量的测定
总黄酮含量的测定方法参考Liu等[17]方法并做适当修改。取0.3 mL样液,加入1.5 mL去离子水和90L5%的NaNO2溶液,振荡均匀后室温下反应6 min,然后加入180L10%的AlCl3·6H2O溶液,静置5 min后加入0.6 mL1mol/L的NaOH溶液,最后用去离子水补足到3 mL,用紫外分光光度计于510 nm下测得其吸光值。同时以芦丁为标准品,测得不同浓度下的吸光值,得到标准曲线,1=0.003 91+ 0.002 5 (2=0.999 4),其中1为芦丁质量浓度(g/mL),1为吸光值。总黄酮含量结果以每克发酵萱草花中所含的芦丁当量(mg/g)表示,单位为mg/g,试验重复3次。
5)总多酚含量测定
测定方法参考Dewanto等[18]并作适当修改,取125L样品溶液,加入0.5 mL去离子水和125 μL福林酚试剂,混合均匀,室温下静置6 min,然后加入1.25 mL 7%的Na2CO3溶液和1 mL的去离子水,振荡均匀后在室温下避光反应90 min,最后用紫外分光光度计在760 nm的波长下测得其吸光值。以没食子酸为标准品,测得不同浓度下的吸光值,然后制作标准曲线,2=0.005 42+0.006 7(2=0.999),其中2为没食子酸质量浓度(g/mL),2为吸光值。总酚含量结果以每克萱草花中所含的没食子酸当量表示,单位为 mg /g,试验重复3次。
1.3.5 液相色谱条件及测定方法
参考Kao等[2]方法,使用美国Agilent 1260 Infinity-高效液相色谱仪:色谱柱为反相HC-C18(4.6 mm×250 mm,5m)(美国安捷伦公司)。测定条件:柱温为30 ℃;流动相:0.1%甲酸水溶液和乙腈;流速为0.4 mL/min;进样体积为10L;波长280 nm;洗脱程序如表1所示。

表1 液相色谱洗脱程序表
1.3.6 抗氧化活性的测定
1)DPPH自由基清除率的测定
在试管中加入2.0 mL DPPH溶液(2.0×10-4mol/L),再分别加入2.0 mL不同浓度的萱草花提取液或者维生素C溶液,充分混匀[19]。室温避光放置30 min后在517 nm处测定各组吸光度1(重复3次)[19],以无水乙醇为空白对照组在517 nm处测定吸光度2,对照组用无水乙醇代替样品液,吸光度记为3。同时以维生素C为阳性对照,DPPH自由基清除率的计算公式如下
2)ABTS自由基清除率的测定
将7 mmol/L ABTS溶液和2.45 mmol/L K2S2O8溶液等体积混合均匀,混合液在室温避光下,静置12~16 h,用磷酸盐缓冲液(0.2 mol/L,pH值7.4)或95%乙醇稀释40~50倍,使其在734 nm处吸光度达到0.70±0.02,将100L样液加入200L ABTS自由基反应液中,在734 nm处测定吸光度为1’[20];同理,将200L ABTS工作液与100L乙醇混合测得吸光度为2',同时以维生素C为阳性对照,ABTS自由基清除率的计算公式如下

1.3.7 数据处理
不同样品的抗氧化活性由每克萱草花(干质量)的维生素C当量来表示,维生素C当量是由维生素C的IC50除以萱草花的IC50得出,而IC50值是通过Origin9.0软件做出线性模拟之后求得。利用SPSS 21.0统计软件,采用单因素方差分析(ANOVA)中的邓肯分析方法研究样品间的显著性差异(<0.05);酚类物质的组成和含量与抗氧化活性的相关性分析采用SPSS中的Person相关性分析。
2 结果与分析
2.1 不同提取方式对萱草花中总黄酮和总多酚含量的影响
如图2所示,不同色系的萱草花中总黄酮和总多酚含量各不相同,其中,酚类物质含量从高到低排列为:“红鹦鹉”、“63#”、“健壮力兰”、“玫瑰犀牛”、“太阳舞”。随着萱草花颜色的加深,其酚类物质含量也越来越多,这与孙泽飞[21]的研究牡丹花中深色花瓣的多酚含量高于浅色的花瓣结果类似。
“红鹦鹉”酶解后总黄酮和总多酚含量分别达到52.01 mg/g、30.20 mg/g,而发酵后总黄酮和总多酚最高含量分别达到57.71 mg/g、34.10 mg/g,较仅超声提取增加了10%~15%,表明酶解和发酵可以显著(<0.05增加酚类物质的提取含量。在相似的研究中,孟永海等[22]采用纤维素酶协同超声波技术提取刺玫果中的总黄酮,得到的总黄酮含量为126.00 mg/g,是无酶超声提取的1.30倍,酶解过程中,果胶酶可以使细胞间的果胶质降解,把细胞从组织内分离出来,纤维素酶可以将纤维素水解成水溶性糖,使细胞壁水解破裂,而超声波振荡可引起细胞振荡,细胞内物质运动、细胞浆流动,从而使细胞壁变薄[23],有利于溶剂与植物细胞内部的相互渗透,增加了有效成分在溶剂中的溶解,从而使更多的酚类物质溶出来;Lizardo等[24]采用植物乳杆菌和干酪乳杆菌共同发酵樱桃浆果,发现其发酵后总多酚含量由2.03 mg/g增加到3.78 mg/g,总黄酮含量由0.11 mg/g增加到0.66 mg/g。研究表明,植物乳杆菌产生的酚酸脱羧酶、去羟酶等会削弱共轭、结合的酚类物质释放与细胞壁之间的醚键,使酚类物质更容易提取出来。上述研究皆与本研结果类似。
2.2 不同提取方式对萱草花抗氧化活性的影响
测定5种萱草花经3种提取方式后的DPPH和ABTS自由基清除率。由表2可知3种提取方式对应的萱草花抗氧化性大小为:发酵-超声、酶解-超声、超声。DPPH自由基清除率最高的品种“红鹦鹉”的维生素C当量由超声时的38.24 mg/g升高到发酵-超声后的44.32 mg/g,上升了15.90%(<0.05);而酶解-超声后上升到41.49 mg/g,比单独超声上升了8.50%(<0.05)。“红鹦鹉”的ABTS自由基清除率的维生素C当量由超声时的31.82 mg/g上升到发酵-超声后的39.74 mg/g和酶解-超声时的35.12 mg/g,比单独超声组分别上升了24.89%和10.37%(<0.05)。结果表明,酶解和发酵都可以显著(<0.05)提高萱草花的抗氧化活性,发酵-超声提取后对DPPH和ABTS自由基清除效果更好。与Kusznierewicz等[25]研究一致,明串珠菌发酵卷心菜后,其总酚含量相比发酵前增加3倍,其DPPH自由基清除能力在发酵后也增加3倍。Chen等[26]研究了挤压和发酵后的脱脂米糠的抗氧化活性,发现发酵后米糠的氧自由基抗氧化(oxygen radical antioxidant capacity,ORAC)和细胞抗氧化(cellular antioxidant activity,CAA)的活性都有所提高,而挤压对CAA活性没有影响。
2.3 不同提取方式对“红鹦鹉”中三种酚类形态中黄酮和多酚含量的影响
在植物酚类的多种形态中,游离酚主要存在于植物细胞液泡中;结合态酚类可分为不可溶性结合酚和可溶性共价结合酚[27]即共轭酚,不可溶性结合酚主要通过酯键与细胞壁中木聚糖侧链上一些糖残基相连而结合,可溶性结合态主要与长链醇类、长链脂肪酸、甘油等可溶性物质相结合[28]。大量研究表明,在3种形态的酚类物质中,其活性按从大到小的顺序为:游离酚、共轭酚、结合酚[29-31]。
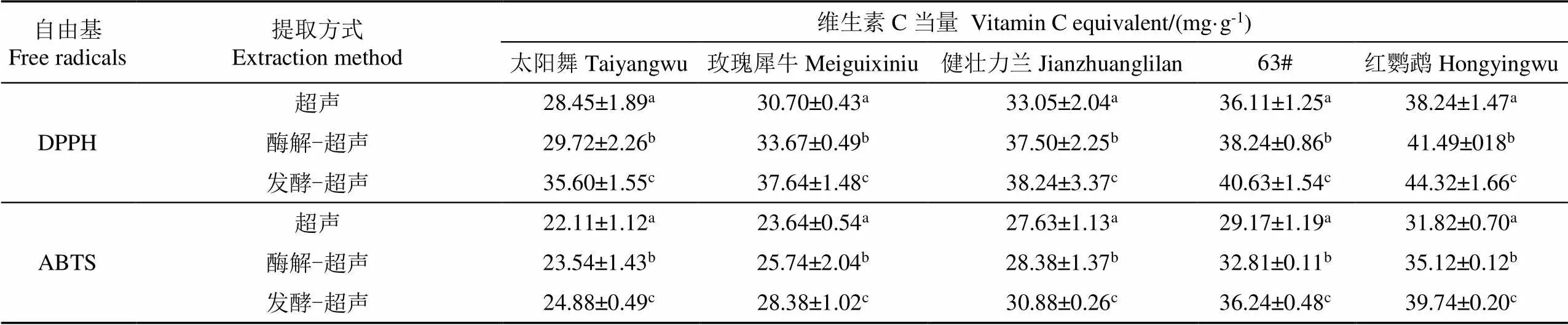
表2 五种萱草花在三种提取方式抗氧化活性
注:同列不同的上标小写字母表示存在显著差异(<0.05)。
Note: The values marked with different upper subscript lowercase letters indicate that there are significant differences in the same column (< 0.05).
萱草花“红鹦鹉”品种在超声、酶解-超声、发酵-超声3种方式下得到的游离态、共轭态以及结合态的黄酮和多酚含量如图3所示。在3种形态中,游离态的黄酮和多酚含量最高,占总含量的75%以上。在酶解时,游离态的黄酮和多酚含量由超声时的12.18、6.49 mg/g增加到酶解-超声时的13.48、7.5 mg/g,分别上升了10.67%和15.56%(<0.05),对应地,结合态的黄酮和多酚含量由超声时的3.49、0.34 mg/g降低到酶解-超声时的3.04、0.26 mg/g,分别减少了12.89%和23.50%。经酶解提取后,共轭态的黄酮含量也有所增加,但多酚含量变化不显著。相类似的是,发酵过程也有明显的多酚物质从结合态到共轭态、游离态转变的现象(图3)。
在酶解过程中,果胶酶可以将细胞间的果胶质降解,纤维素酶将纤维素水解成水溶性糖,使细胞壁水解破裂,从而释放出更多的活性物质[22]。而在发酵过程中,植物乳杆菌在发酵过程中会产生酚酸脱羧酶、去羟酶等会削弱共轭、结合的酚类物质与细胞壁之间的醚键,使得游离态黄酮和多酚含量均有所增加,结合态酚类含量下降[32]。赖婷等[33]研究发现,采用植物乳杆菌发酵后的桂圆肉游离态酚类和黄酮类含量分别增加11.90%、19.60%,结合态酚类和黄酮类含量分别下降41.40%。Wu等[34]研究发现植物乳杆菌发酵能显著增加石莲花游离酚含量,这些都与本研究结果一致。
2.4 不同提取方式对“红鹦鹉”中酚类成分组成和含量的影响
文献报道[3,35-36]萱草花中鉴定出的酚类化合物有芦丁、异槲皮苷、槲皮素、绿原酸、新绿原酸等,此外还有许多结构复杂的酚类物质尚未被鉴定。本研究采用超声、酶解-超声以及发酵-超声三种方式提取萱草花“红鹦鹉”中酚类成分,对其三种酚类形态中的单体酚进行高效液相色谱(High Performance Liquid Chromatography,HPLC)检测,通过与标准品比对可知,在游离态、共轭态和结合态中共检测到含量较高的10种酚类化合物(含量低的物质未列出),分别是没食子酸、新绿原酸、绿原酸、儿茶素、表儿茶素、咖啡酸、芦丁、异槲皮苷、对香豆酸、槲皮素,其中儿茶素、表儿茶素、芦丁、异槲皮苷、槲皮素是被检出含量高的黄酮类化合物,新绿原酸、绿原酸、芦丁是被检出含量高的酚类化合物。
如表3所示,不同提取方式下游离态、共轭态和结合态中的酚类化合物含量和分布有明显不同,其中大部分主要以游离酚形式存在。酶解和发酵提高了大部分游离态酚类化合物的含量(除新绿原酸和儿茶素)。咖啡酸在共轭态和结合态中分布较多,经酶解和发酵后,游离态分别显著增加25.40%和46.31%,共轭态和结合态显著下降(<0.05);对香豆酸在超声提取时主要以共轭态和结合态存在,经酶解和发酵后游离态中新检出对香豆酸,且其共轭态和结合态均有所下降,证明部分对香豆酸由共轭态和结合态转化为游离态;槲皮素酶解和发酵后游离态酚类均显著增加,其中发酵后增加了3倍,与本研究类似的是,王储炎等[37]采用乳酸菌发酵蓝莓多酚,发现游离态槲皮素增加异常显著,其原因可能是乳酸菌发酵过程中产生的酶将连接酚酸与糖或蛋白的酯键打开,结合态的酚酸被释放,向游离态转化。
3种方式中,发酵提取后所得酚类物质含量最高,而发酵包含了高温灭菌的步骤,然而黄酮酚类物质是热敏性成分,发酵提取后所得酚类物质含量较高可能的原因是:尽管发酵前的灭菌会导致多酚类物质有损失,但研究表明一般损失率不超过10%[38];而接种菌株后进入微生物发酵阶段,有助于萱草花中酚类化合物的释放,在Chen等[26]的研究中,灭菌后(121 ℃,15 min)再进行发酵,发现发酵的米糠样品中总酚含量比未处理的样品提高了71.6%;此外Ricci等[13],灭菌后(65 ℃,30 min)再进行乳酸菌樱桃汁发酵,在微生物转化下通过各种代谢途径合成新的黄酮和酚类化合物。
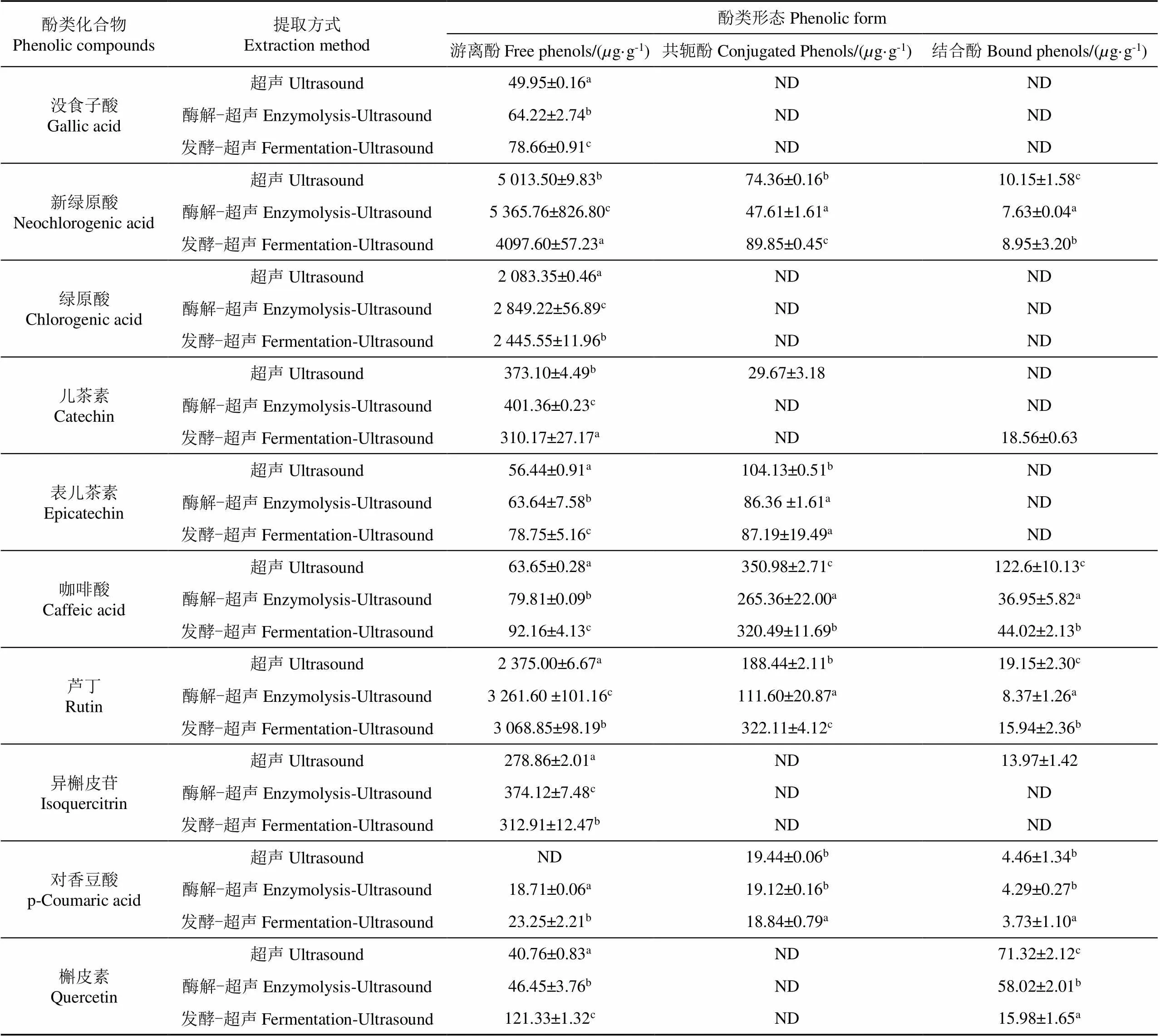
表3 不同提取方式下“红鹦鹉”中三种形态的酚类化合物的组成与含量
注:同一列的每种单体酚中上标小写字母不同表示同一酚类化合物存在明显差异(0.05);ND表示未检出。
Note: The different superscript lowercase letters in each monomer phenol in the same column indicate significant differences in same phenolic compounds (<0.05); ND indicates not detected.
2.5 不同提取方式对“红鹦鹉”中三种酚类形态抗氧化活性的影响
不同提取方式下“红鹦鹉”中三种酚类形态DPPH和ABTS自由基清除率的维生素C当量如表4所示。超声、酶解-超声和发酵-超声三种提取方式下的游离酚DPPH自由基清除率维生素C当量为40.53 mg/g、44.26 mg/g、48.20 mg/g。三种提取方式提取的游离酚ABTS自由基清除率维生素C当量分别为35.57 mg/g、39.88 mg/g、47.40 mg/g。经过对比发现,发酵-超声的游离酚清除DPPH和ABTS自由基效果是最好的,其次是酶解-超声和超声提取的游离酚。

表4 不同提取方式下三种酚类形态DPPH和ABTS自由基清除率维生素C当量
注:标有不同的上标小写字母的值表示同一列中存在显著差异(0.05)。
Note: Values marked with different superscript lowercase letters indicate significant differences in the same column (<0.05).
2.6 萱草花中酚类成分的组成与含量与抗氧化活性的相关性分析
为了研究萱草花酚类成分的组成与含量与抗氧化活性的关系,由表2和表3的数据构建了“红鹦鹉”主要酚类化合物与其在发酵-超声提取下抗氧化活性的相关性(表5)。结果表明,不同的酚类化合物对总抗氧化活性贡献不同,在游离态中,绿原酸、芦丁、咖啡酸和槲皮素的含量与DPPH和ABTS清除率相关性显著(> 0.9,0.01),游离态中的对香豆酸、异槲皮苷与DPPH和ABTS自由基清除率也具有较好的相关性(>0.85,<0.05);在共轭态中,异槲皮苷的含量与DPPH和ABTS自由基清除率有较高的相关性(> 0.85,0.05),游离态和共轭态儿茶素与DPPH和ABTS自由基清除率呈负相关;在结合态中,未表现出明显的正相关关系,仅新绿原酸、芦丁与DPPH和ABTS自由基清除率呈负相关。因此综合上述结果,萱草花酚类物质的抗氧化活性不是一种或几种单体酚的作用,而是多种酚协同作用的结果。

表5 萱草花中酚类化合物的含量与抗氧化活性的相关性分析
注:*在0.05水平(双侧)上显著相关,**在0.01水平(双侧)上显著相关。
Note: *Significantly correlated at the 0.05 level (bilateral), **Significantly correlated at the 0.01 level (bilateral).
3 结 论
通过对“红鹦鹉”、“63#”、“健壮力兰”、“玫瑰犀牛”、“太阳舞”5种萱草花采用发酵-超声、酶解-超声、超声3种不同的提取方式,比较不同品种和不同提取方式萱草花中总黄酮和总多酚含量以及DPPH和ABTS自由基清除率;测定游离态、共轭态和结合态三种形态酚类化合物,分析了不同形态的酚类物质与抗氧化活性的关系。结果表明:
1)不同颜色的萱草花中总黄酮和总多酚含量从高到低依次为:“红鹦鹉”、“63#”、“健壮力兰”、“玫瑰犀牛”、“太阳舞”。
2)经不同提取方式的萱草花抗氧化活性大小排序为:发酵-超声、酶解-超声、超声。发酵-超声后的“红鹦鹉”对DPPH和ABTS自由基清除率最高,维生素C当量分别达到了44.32 mg/g和39.74 mg/g,较仅超声提取分别上升了15.90%和24.89%(<0.05)。
3)在“红鹦鹉”的3种酚类形态中,游离态的黄酮和多酚含量最高,占总含量的75%以上;酶解和发酵显著(<0.05)提高了“红鹦鹉”中大部分游离态酚类化合物的含量,且新检出了对香豆酸,发酵后游离态槲皮素含量达到超声时的3倍;发酵后萱草花中游离酚的DPPH和ABTS自由基清除率的维生素C当量分别达到了48.20 mg/g和47.40 mg/g。在游离态中,绿原酸、芦丁、咖啡酸和槲皮素与抗氧化活性相关性高(>0.9),对抗氧化活性贡献较大。
[1] Tai C Y, Chen B H. Analysis and stability of carotenoids in the flowers of daylily () as affected by various treatments[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12): 5962-5968.
[2] Kao F J, Chiang W D, Liu H M. Inhibitory effect of daylily buds at various stages of maturity on nitric oxide production and the involved phenolic compounds[J]. LWT - Food Science and Technology, 2015, 61(1): 130-137.
[3] Tomkins J P, Wood T C, Barnes L S, et al. Evaluation of genetic variation in the daylily (spp. ) using AFLP markers[J]. Theoretical and Applied Genetics, 2001, 102(4): 489-496.
[4] Xu P, Wang K Z, Lu C, et al. Antidepressant-like effects and cognitive enhancement of the total phenols extract ofin chronic unpredictable mild stress rats and its related mechanism[J]. Journal of Ethnopharmacology, 2016, 194: 819-826.
[5] 韩爱芝,黄军海,孟庆艳,等. 大花罗布麻不同部位酚类物质含量及其抗氧化活性比较研究[J]. 食品科学,2014,35(13):127-131.
Han Aizhi, Huang Junhai, Meng Qingyan, et al. Comparison of antioxidant activity and phenolic content of different parts of poacynum hendersonii woodson[J]. Food Science, 2014, 35(13): 127-131. (in Chinese with English abstract)
[6] 冉玉兵,刘磊,张名位,等. 乳酸菌发酵对龙眼果浆中糖和酚类物质的影响[J]. 现代食品科技,2017,33(8):116-122.
Ran Yubing, Liu Lei, Zhang Mingwei, et al. Effect of lactic acid bacteria fermentation on the sugar and polyphenol contents of longan pulp[J]. Modern Food Technology, 2017, 33(8): 116-122. (in Chinese with English abstract)
[7] 杨婉. 美藤果壳中酚类物质的提取、纯化、鉴定及清除自由基能力的研究[D]. 无锡:江南大学,2018.
Yang Wan. Study on The Extraction, Purification, Identification and Free Radical Scavenging Ability of Phenolic Substances In the Husk of Meiteng[D]. Wuxi: Jiangnan University, 2018. (in Chinese with English abstract)
[8] 于海燕,解铜,钱新华,等. 萱草花类黄酮提取,分析及其抗氧化性研究[J]. 食品工业科技,2019,40(21):179-185.
Yu Haiyan, Xie Tong, Qian Xinhua, et al. Extraction, analysis and antioxidant activity of flavonoids from daylily () flower[J]. Food Industry Science and Technology, 2019, 40(21): 179-185. (in Chinese with English abstract)
[9] 刘皓涵,钟迪颖,张润光,等. 欧李多酚提取纯化及抗氧化性研究[J]. 农业工程学报,2020,36(22):324-332.
Liu Haohan, Zhong Diying, Zhang Runguang, et al. Extraction and purification of polyphenols and determination of antioxidant activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(22): 324-332. (in Chinese with English abstract)
[10] Oh B T, Jeong S Y, Velmurugan P, et al. Probiotic-mediated blueberry (L. ) fruit fermentation to yield functionalized products for augmented antibacterial and antioxidant activity[J]. Journal of Bioscience & Bioengineering, 2017, 124(5): 542-550.
[11] 杜小燕,吴晖,唐语谦,等. 麦麸发酵前后不同存在形态酚类物质中酚酸含量的变化及其抗氧化活性分析[J]. 中国粮油学报,2016,31(6):17-23.
Du Xiaoyan, Wu Hui, Tang Yuqian, et al. The change of phenolic acid content in different forms of phenolic substances before and after wheat bran fermentation and its antioxidant activity analysis[J]. Journal of Grain and Oil, 2016, 31(6): 17-23. (in Chinese with English abstract)
[12] Dueñas M, Fernández D, Hernández T, et al. Bioactive phenolic compounds of cowpeas (L.) modifications by fermentation with natural microflora and with lactobacillus plantarum ATCC 14917[J]. Journal of the Science of Food and Agriculture, 2005, 5: 297-304.
[13] Ricci A, Cirlini M, Maoloni A, et al. Use of dairy and plant-derived lactobacilli as starters for cherry juice fermentation[J]. Nutrients, 2019, 11: 1-14.
[14] 钱新华. 萱草花中类黄酮提取、纯化和成分分析[D]. 上海:上海应用技术大学,2019.
Qian Xinhua. Extraction, Purification and Component Analysis of Flavonoids inFlower[D]. Shanghai: Shanghai University of Applied Sciences, 2019. (in Chinese with English abstract)
[15] Bei Q, Liu Y, Wang L, et al. Improving free, conjugated, and bound phenolic fractions in fermented oats (. ) withand their antioxidant activity[J]. Journal of Functional Foods, 2017, 32: 185-194.
[16] 国家食品药品监督管理总局. 食品安全国家标准食品微生物学检验菌落总数测定:GB4789. 2—2016[S]. 北京:中国标准出版社,2016:2-5.
[17] Liu L, Wen W, Zhang R, et al. Complex enzyme hydrolysis releases antioxidative phenolics from rice bran[J]. Food Chemistry, 2017, 214: 1-8.
[18] Dewanto V, Wu X, Adom K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(10): 3010-3014.
[19] 汪涛,梁亮,李旭锐,等. 低共熔溶剂提取核桃青皮多酚工艺优化及其抑菌活性[J]. 农业工程学报,2021,37(5):317-323.
Wang Tao, Liang Liang, Li Xurui, et al. Optimization of eutectic solvent extraction of walnut green peel polyphenols and its antibacterial activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(5): 317-323. (in Chinese with English abstract)
[20] 巫永华,张建萍,赵节昌,等. 大孔树脂纯化黄精多酚及其抗氧化性与组成分析[J]. 农业工程学报,2020,36(1):318-326.
Wu Yonghua, Zhang Jianping, Zhao Jiechang, et al. Purification of polygonatum polyphenols by macroporous resin and analysis of their antioxidant properties and composition[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(1): 318-326. (in Chinese with English abstract)
[21] 孙泽飞. 牡丹花类黄酮成分及抗氧化能力分析[D]. 杨凌:西北农林科技大学,2015.
Sun Zefei. Analysis on Flavonoids and Antioxidant Capacity of Peony Flowers[D]. Yangling: Northwest A & F University, 2015. (in Chinese with English abstract)
[22] 孟永海,付敬菊,怀雪,等. 酶解法协同超声波法提取刺玫果中总黄酮的工艺条件优化[J]. 化学工程师,2019,33(10):70-75.
Meng Yonghai, Fu Jingju, Huai Xue, et al. Optimization of process conditions for extracting total flavonoids from Rosa rugosa by enzymatic hydrolysis and ultrasonic method[J]. Chemical Engineer, 2019, 33(10): 70-75. (in Chinese with English abstract)
[23] 王悦,徐元元,杨二林,等. 酶解结合高剪切破壁技术对蜂花粉酚类物质及抗氧化活性的影响[J]. 农业工程学报,2021,37(2):313-320.
Wang Yue, Xu Yuanyuan, Yang Erlin, et al. Effects of enzymatic hydrolysis combined with high-shear wall breaking technology on phenolic compounds and antioxidant activity of bee pollen[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(2): 313-320. (in Chinese with English abstract)
[24] Lizardo R C M, Cho H D, Won Y S, et al. Fermentation with mono- and mixed cultures ofand L.enhances the phytochemical content and biological activities of cherry silverberry (. ) fruit[J]. Journal of the Science of Food and Agriculture, 2020, 100(9): 3687-3696.
[25] Kusznierewicz B, Śmiechowska A, Bartoszek A, et al. The effect of heating and fermenting on antioxidant properties of white cabbage[J]. Food Chemistry, 2008, 108(3): 853-861.
[26] Chen Y, Ma Y, Dong L, et al. Extrusion and fungal fermentation change the profile and antioxidant activity of free and bound phenolics in rice bran together with the phenolic bioaccessibility[J]. LWT- Food Science and Technology, 2019, 115:108461.
[27] Wang B, Liu H F, Zheng J B, et al. Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1288-1292.
[28] 陈彩薇,吴晖,赖富饶,等. 米糠中不同存在形态酚类物质的抗氧化活性研究[J]. 现代食品科技,2015,31(2):42-46.
Chen Caiwei, Wu Hui, Lai Furao, et al. Antibaterial activity and antioxidant activity of different form phenolics from defatted rice bran[J]. Modern Food Science and Technology, 2015, 31(2): 42-46. (in Chinese with English abstract)
[29] 张金宏. 苹果渣中游离酚和结合酚的提取及其功能特性的研究[D]. 杨凌:西北农林科技大学,2016.
Zhang Jinhong. Extraction of Free Phenol and Bound Phenols in Apple Pomace and Functional Properties[D]. Yangling: Northwest A & F University, 2016. (in Chinese with English abstract)
[30] 黄皓,王珍妮,李莉,等. 甘油水溶液提取米糠多酚绿色工艺优化及多酚种类鉴定[J]. 农业工程学报,2019,35(4):305-312.
Huang Hao, Wang Zhenni, Li Li, et al. Optimization of green technology for extracting polyphenols from rice bran with aqueous glycerin solution and identification of polyphenols[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(4): 305-312. (in Chinese with English abstract)
[31] Li M, Chen X, Deng J, et al. Effect of thermal processing on free and bound phenolic compounds and antioxidant activities[J]. Food Chemistry, 2020, 332: 127429.
[32] Muoz R, Rivas B, Felipe F, et al. Biotransformation of Phenolics by Lactobacillus plantarum in Fermented Foods[M]. America: American Academic Press, 2017: 63-83.
[33] 赖婷,刘磊,张名位,等. 不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J]. 中国农业科学,2016,49(10):1979-1989.
Lai Ting, Liu Lei, Zhang Mingwei, et al. Effects of different lactic acid bacteria fermentations on phenolic compounds and antioxidant activities in Guiyuan meat[J]. Chinese Agricultural Sciences, 2016, 49(10): 1979 -1989. (in Chinese with English abstract)
[34] Wu S, Su Y, Cheng H. Antioxidant properties of-fermented and non-fermentedE. Walther at different stages of maturity[J]. Food Chemistry, 2011, 129(3): 804-809.
[35] Sun J, Liu W, Zhang M, et al. The analysis of phenolic compounds in daylily using UHPLC-HRMSn and evaluation of drying processing method by fingerprinting and metabolomic approaches[J]. Journal of Food Processing & Preservation, 2017, 42(1): e13325.
[36] 张宁. 萱草属植物花蕾中秋水仙碱和酚类物质的检测与分析[D]. 太谷:山西农业大学,2018.
Zhang Ning. Detection and Analysis of Colchicines and Phenols in Flower Buds of[D]. Taigu: Shanxi Agricultural University, 2018. (in Chinese with English abstract)
[37] 王储炎,张继刚,杨柳青,等. 三种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J]. 食品科学,2020,41(24):87-94.
Wang Chuyan, Zhang Jigang, Yang Liuqing, et al. Effects of three lactic acid bacteria fermentation on polyphenol, proanthocyanidin content and antioxidant activity of blueberry[J]. Food Science, 2020, 41(24): 87-94. (in Chinese with English abstract)
[38] 李宏飞. 热力杀菌对柑橘罐头品质影响的研究[D]. 南京:南京农业大学,2016.
Li Hongfei. The Effect of Heat Sterilization on the Quality of Canned Citrus[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese with English abstract)
Effects of different extraction methods on phenolic compounds and antioxidant activity inflower
Tian Huaixiang, Chen Shuang, Chen Xiaoyan, Yu Haiyan, Huang Juan, Yuan Haibin, Chen Chen※
(,,,201418,)
is one of the most popular flowers rich in bioactive substances, such as polyphenols, flavonoids, and alkaloids anthraquinones, particularly on antioxidant, antidepressant and anticancer. The extraction of phenolic compounds and antioxidant properties can also greatly contribute to the popularization offlower in the agricultural industry. However, only a few reports were focused on the extraction, forms and antioxidant activities of phenolic compounds in theflower. The present study aims to explore the effects of different extraction on the content, composition and antioxidant activity of phenolic compounds in variousflowers. Five kinds of flowers with different colors (yellow, orange, red-orange, jujube red, and bright red) were selected as raw materials. Three processing treatments (ultrasound, enzymolysis-ultrasound, and fermentation-ultrasound) were also utilized to determine the content of total flavonoids, total polyphenols, and scavenging rate of free radicals. Furthermore, high-performance liquid chromatography was adopted to identify the free, conjugated, and bound fractions of phenolic compounds, where the relationship was also established between phenolic compounds and antioxidant activity. Specifically, the types of total flavonoids and polyphenols were as follows: 'Hongyingwu', '63#', 'Jianzhuanglilan', 'Meiguixiniu', and 'Taiyangwu'. The results showed that there was a significant difference () of antioxidant activity in the different varieties of flowers, where the antioxidant activity was positively correlated with phenolic content. Furthermore, the antioxidant activities of flowers depended mainly on the varieties and extraction. More importantly, the vitamin C equivalents of DPPH (1,1-diphenyl-2-picrylhydrazyl) were 44.32, 40.63, 38.24, 37.64, and 35.60 mg/g, respectively, for the 'Hongyingwu', '63#', 'Jianzhuanglilan', 'Meiguixiniu' and 'Taiyangwu' under the fermentation-ultrasonic processing. The corresponding ABTS (2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)) vitamin C equivalents were 39.74, 36.24, 30.88, 28.38 and 24.88 mg/g, respectively. The vitamin C equivalent of DPPH of 'Hongyingwu' increased from 38.24 mg/g by ultrasonic extraction to 41.49 mg/g by enzymatic ultrasonic extraction and 44.32 mg/g by fermentation-ultrasonic extraction. The vitamin C equivalent of ABTS of 'Hongyingwu' increased from 31.82 mg/g by ultrasonic extraction to 35.12 mg/g by enzymatic ultrasonic extraction and 39.74 mg/g by fermentation-ultrasonic extraction. Among the three fractions, the content of phenolic compounds in the free fraction was the highest, accounting for more than 75% of the total contents. Enzymatic hydrolysis and fermentation significantly (<0.05) improved the contents of most phenolic compounds in the free fraction of 'Hongyingwu'. Particularly, the p-Coumaric acid was newly detected, while the free quercetin content after fermentation reached three times that of the original. The Vitamin C equivalent of DPPH and ABTS free radical scavenging rate of free phenols increased from 40.53 and 35.57 mg/g for ultrasonic processing to 48.20 and 47.40 mg/g for fermentation-ultrasonic processing, respectively. Correlation analysis demonstrated that the chlorogenic acid, caffeic acid, quercetin, and rutin in the free fraction were highly correlated with the antioxidant activity, indicating a great contribution to antioxidant activity. The finding can provide a theoretical basis for the development and utilization offlower in functional foods and cosmetics.
extraction;phenolic compounds;flower; antioxidant activity; free phenol
田怀香,陈霜,陈小燕,等. 不同提取方式对萱草花中酚类物质及抗氧化活性的影响[J]. 农业工程学报,2021,37(20):303-312.doi:10.11975/j.issn.1002-6819.2021.20.034 http://www.tcsae.org
Tian Huaixiang, Chen Shuang, Chen Xiaoyan, et al. Effects of different extraction methods on phenolic compounds and antioxidant activity inflower[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(20): 303-312. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.20.034 http://www.tcsae.org
2021-05-18
2021-08-05
上海食品风味与品质控制工程技术研究中心(20DZ2255600)
田怀香,博士,博士生导师,研究方向为食品科学与工程。Email:tianhx@sit.edu.cn
陈臣,博士,副教授,研究方向为食品科学与技术,食品生物技术。Email:chenchen@sit.edu.cn
10.11975/j.issn.1002-6819.2021.20.034
TS255.2
A
1002-6819(2021)-20-0303-10
