应用温度传感器探究物质变化过程中的热效应
2021-12-29裴传友马善恒杨芹


摘要: 对于能量变化不明显的实验,用传统仪器难以准确测量物质变化时的热效应。借助温度传感器设计实验可以呈现物质变化时的各种热效应,增强学生的定量实验意识,培养学生的深度学习能力。
关键词:温度传感器;物质变化;热效应;化学数字化教学
热效应总是与物质的变化有关,而物质的变化是由化学键的断裂和重新组合或粒子间作用力的变化引起的。当这种能量变化很明显时,人们可以通过感官感知或用传统的实验仪器——温度计来测量,如金属与酸反应、浓HSO稀释、NaOH固体溶于水。有些变化伴随的能量变化很小,以至于人类的感官无法感知,用温度计也无法准确测量,如NaCl固体溶于水、将一些溶液稀释等。此时,使用温度传感器仪器进行测量,可以更准确地测量和记录物质变化过程中的温度变化,从而感知物质变化过程中的能量变化。下面,结合案例介绍并解析如何使用温度传感器测量物质变化时的热效应。
一、中和反应的热效应
测定中和反应的反应热是高中化学中较为重要的实验。此实验中,酸和碱的强度、酸和碱的浓度及溶液的稀释等条件对中和热的测定均有一定的影响。用传统方法测量存在精准度不高的问题。利用温度传感器测量则很准确,便于探究中和热适宜的测定条件。
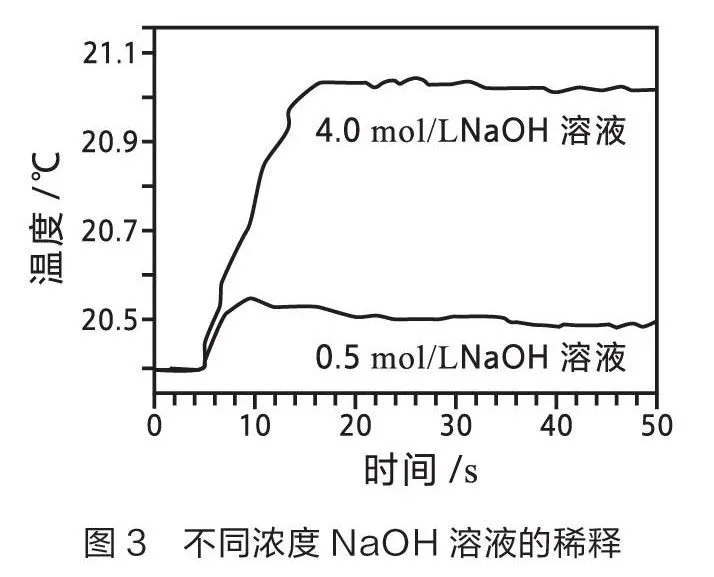
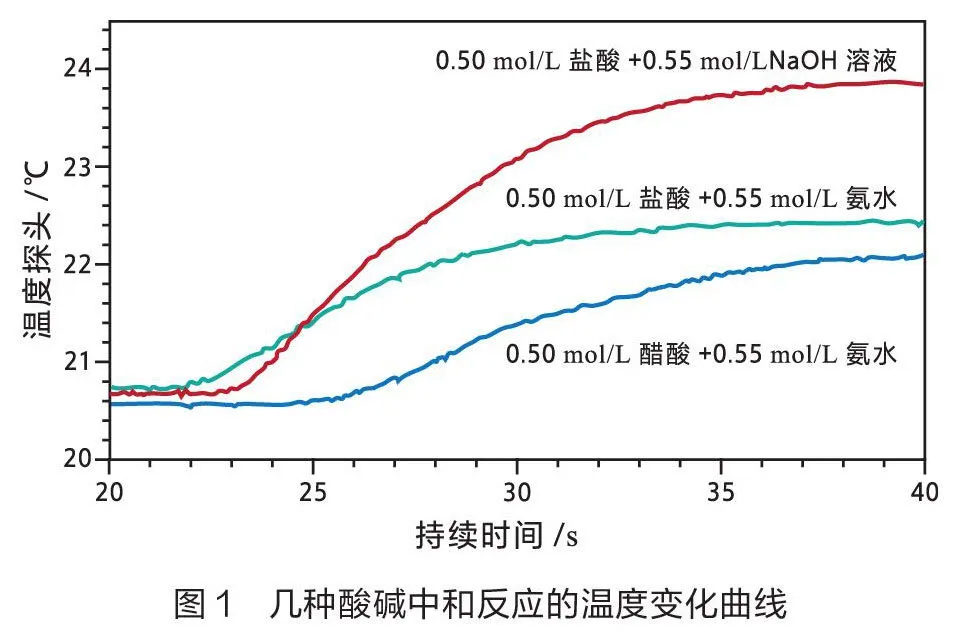
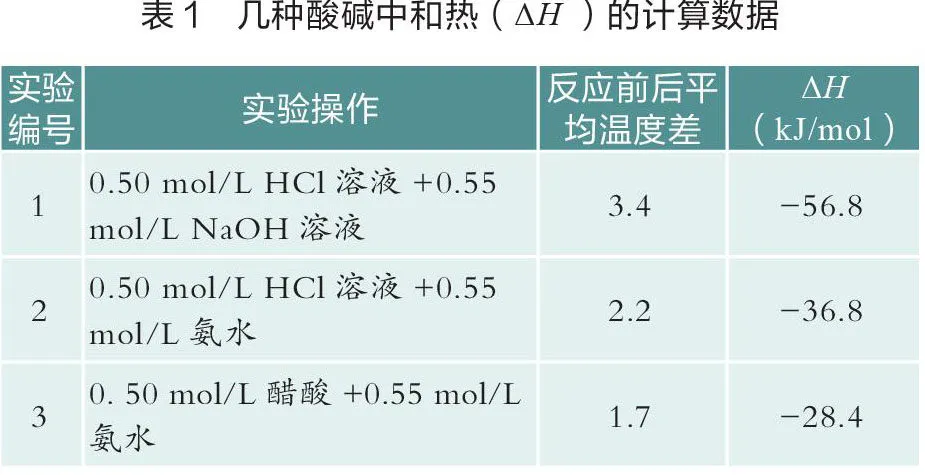
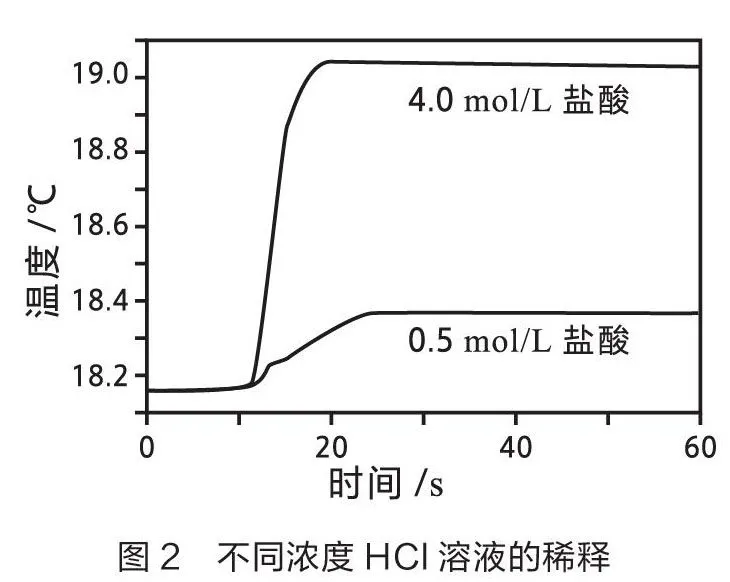
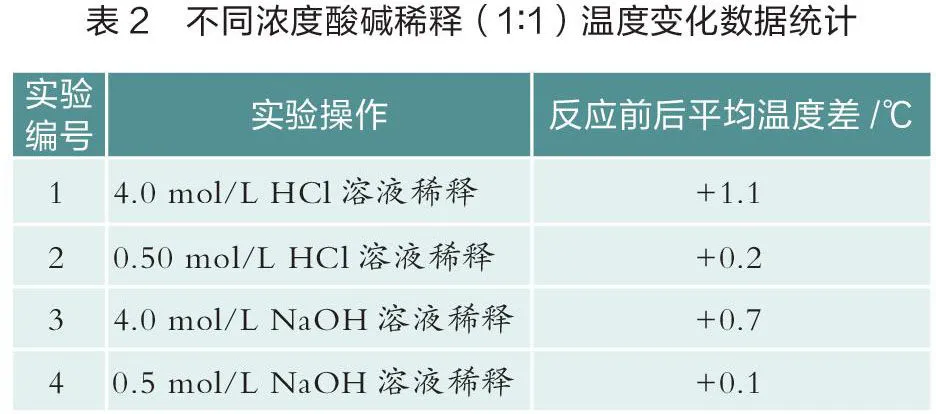
笔者开展如下两组实验。一组使用温度传感器测量体积为20 mL时不同种类酸碱溶液反应的温度变化曲线(如图1)。分析数据后,计算不同实验的中和热(见表1)。另一组使用温度传感器测量不同浓度酸碱(1:1)稀释时的温度变化曲线(如图2和图3)[1],统计分析数据见表2。
由表1数据可知,0.50 mol/L HCl溶液(强酸)与0.55 mol/L NaOH溶液(强碱)反应测得的中和热为56.8 kJ/mol,较接近理论值57.3 kJ/mol。醋酸(弱酸)与氨(弱碱)反应测得的中和热与理论值相差很大,这是因为弱酸或弱碱在水溶液中没有完全电离,需要在中和反应的同时发生电离,电离过程是吸热的,导致实测值小于理论值。因此,在测定中和热时,选择强酸和强碱比较合适。
由表2的分析可以看出,不同浓度的HCl溶液和NaOH溶液在稀释过程中产生不同程度的热效应。浓度越高,稀释过程中释放的热量越多,对中和热的影响越大。因此,在测量中和热的实验中,应选用稀溶液。利用温度传感器的灵敏性和准确性,得出“中和热应通过强酸与强碱的稀溶液反应来测量”这一结论更具信服力。
二、液态物质汽化时的热效应
液态物质的汽化需要破坏分子间力,表现为吸热过程,体系温度下降。《普通高中化学课程标准(2017年版)》要求学生了解分子间的相互作用力,知道范德华力和氢键是两种常见的分子间作用力,了解氢键的性质特征。通过温度传感器测量不同液体挥发过程中的温度变化,可以比较分子间范德华力强度,证明氢键的存在。
笔者设计了两组实验。一组使用4个温度传感器同时测量甲醇、乙醇、正丙醇、正丁醇挥发时的温度变化曲线(如图4)。另一组使用两个温度传感器同时测量正丁醇和正己烷挥发时的温度变化曲线(如图5)。
从图4的曲线可以看出,不同醇类在挥发过程中的降温幅度是不同的。单位时间内物质温度下降越快,醇越容易挥发,说明分子间作用力越小。通过比较甲醇、乙醇、正丙醇和正丁醇的分子结构,得出组成和结构相似的分子,其分子间作用力随着相对分子量的增大而增大。
由图5的曲线可以看出,正己烷和正丁醇的曲线温差很大,正丁醇、正己烷的相对分子质量分别是74和84,根据实验1的结论,正丁醇的相对分子质量小,分子间作用力小,应该蒸发更快,它应该显示温度降低更多,但实验结果恰恰相反。此时,教师引导学生比较正己烷和正丁醇的分子结构,并推断正丁醇分子结构中存在羟基,顺势提出氢键的概念[2]。
三、固态物质溶解过程中的热效应
固体物质的溶解过程总是伴随着热效应,热效应是溶质微粒在水中的扩散和水合过程中能量变化的总效应[3]。有些物质具有明显的溶解热效应,可以用传统的实验仪器温度计来测量,如NaOH固体等;有些物质的溶解热效应很弱,如NaCl、NaHCO等固体,可以借助温度传感器准确测量。
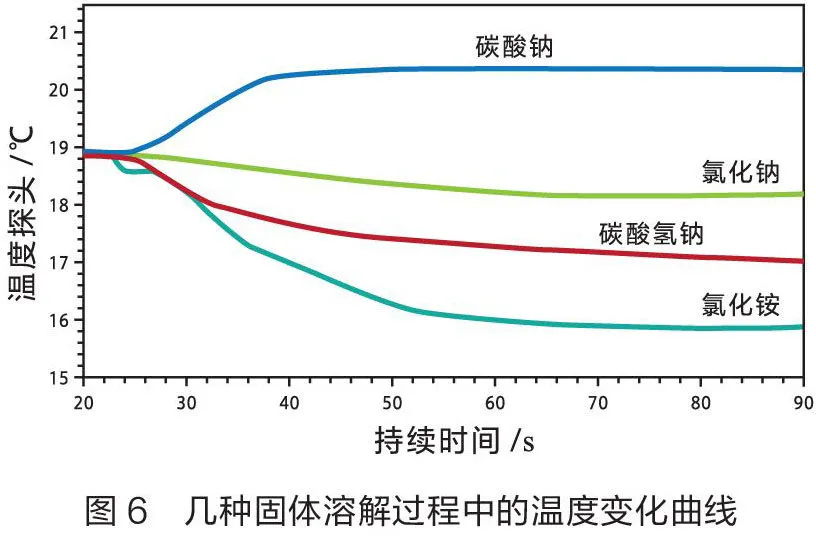
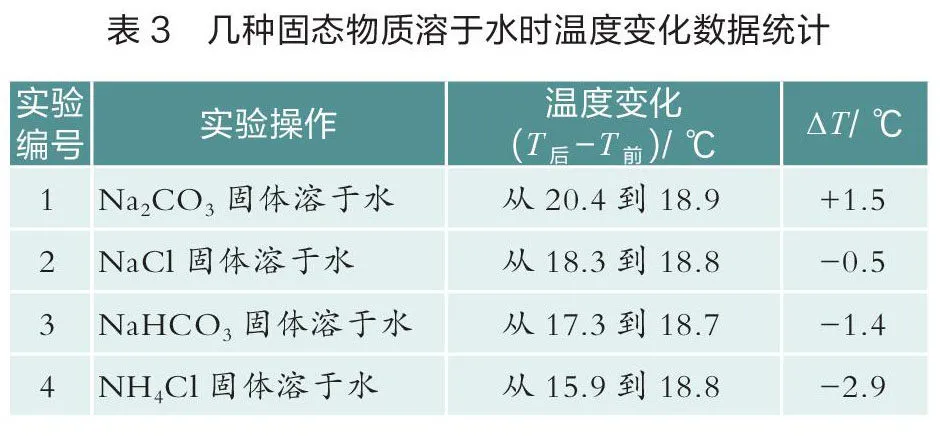
操作如下:向4只烧杯中分别加入40 mL蒸馏水,插入温度传感器,再分别加入2 g NaCO、NaHCO、NaCl和NHCl,使其溶解,得到温度变化曲线(如图6),数据见表3。
从表3可以看出,相同质量的NaCO、NaHCO、NHCl固体溶于水后温度变化较大,NaCl固体溶于水后温度变化较小。同时可以看出,NaCl固体在水中溶解是微弱的吸热过程。在传统的实验中,用温度计测量NaCl固体在水中的溶解热效应,可能得出NaCl在水中的溶解时温度不变的错误结论。
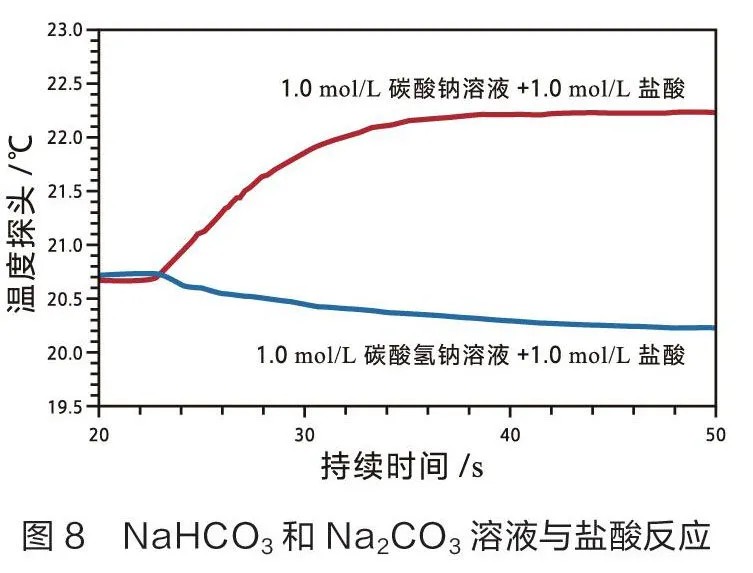
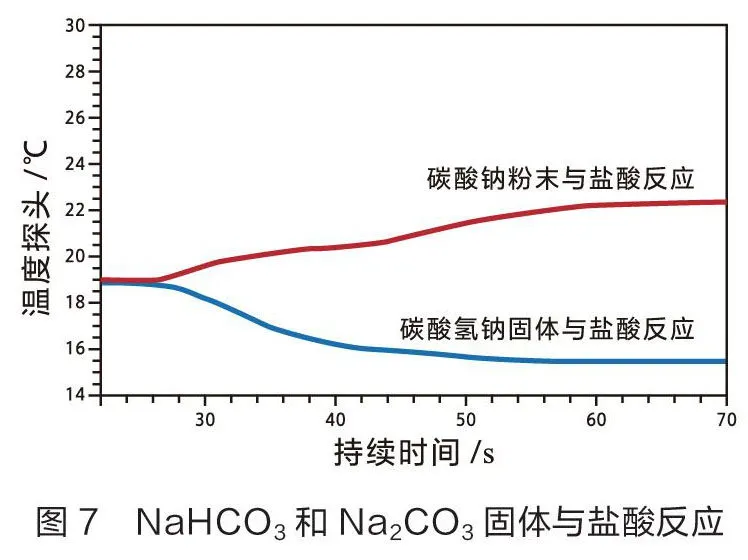
四、固体NaCO和NaHCO分别与盐酸反应的热效应
在高中化学课本中,NaCO、NaHCO与盐酸的反应实验涉及反应速率和反应温度的变化,只通过感官来判断。学生对实验中的相关问题无法深入探究。教师可以利用温度传感器来探究实验过程中温度变化的原因,培养学生的深度学习能力[4]。
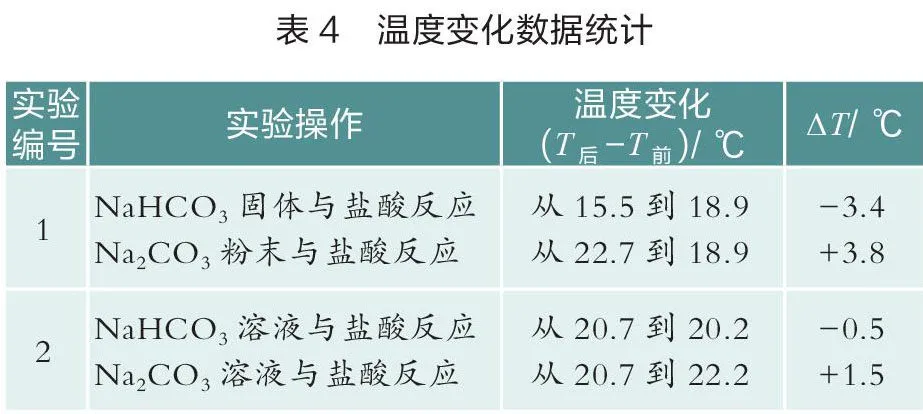
笔者设计了两组实验。一组称量3.36 g NaHCO固体和4.24 g NaCO粉末分别与40 mL 1.0 mol/L盐酸反应,用温度传感器测量温度变化(如图7)。另一组分别量取20 mL浓度均为1.0 mol/L NaHCO溶液和NaCO溶液分别与20mL 1.0 mol/L 盐酸反应,用温度传感器测量温度变化(如图8)。统计数据见表4。
分析表3和表4可知,NaHCO固体溶解时温度降低,为吸热过程,其溶液与盐酸反应温度也降低,同样为吸热过程,则NaHCO固体与盐酸的吸热反应是这两个过程共同作用的结果。NaCO粉末溶解是一个放热过程,其溶液与盐酸反应也是一个放热过程,因此NaCO粉末与盐酸的放热反应是上述两个过程综合作用的结果[5]。
五、结晶过程的热效应
将固态溶质的水溶液放在一个开放的容器里,让水慢慢蒸发,或者改变溶液的温度,可以使晶态溶质从溶液中沉淀出来,这个过程叫作结晶。结晶过程中伴随着能量的变化,可以通过温度传感器探究结晶过程中的热效应。
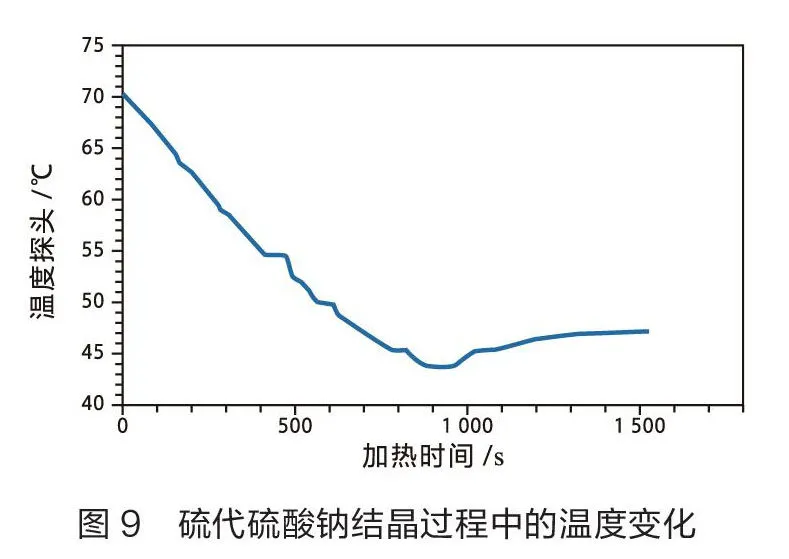
具体操作如下:在一个大试管中加入约20 g NaSO·5HO固体;加热,让其全部溶解在自己所含的结晶水中,形成NaSO·5HO饱和溶液;停止加热,插入温度传感器测量其温度变化。当温度降到45℃左右时,向试管中投入1~3粒NaSO·5HO固体。采集并保存数据(如图9)。
分析图9中数据可知,当溶液温度降到45℃左右时,将几粒NaSO·5HO晶体加入试管中,温度停止下降后,大量晶体析出,溶液温度开始升高,这说明溶液中NaSO结晶过程是一个放热过程[6]。
数字化实验准确、直观,使教学过程更加生动易懂,有利于提高学生的探究创新能力,获得更好的教学效果。然而,中学数字化实验尚未普及,存在教学资源少、利用不充分等现象[7]。同时,也不能为了数字化而推行数字化实验,有些传统实验效果很好。例如,对固体NaOH溶于水的热效应测定实验而言,如果只是了解固体NaOH溶于水的热效应,使用温度计就很好,甚至用手去摸试管也可以,完全没有必要使用温度传感器。只有在中学化学教学中合理运用数字化实验,才能取得较好的教学效果[8][9]。
注:本文系国家新闻出版署出版融合发展(人教社)重点实验室、人教数字教育研究院重点课题(编号:RJA0521002)和马鞍山市教育科学规划教育科研课题(编号:MJG19121)的研究成果。
参考文献
[1] 李玮辰.对中和反应热测定实验的改进[J].中学化学教学参考,2017(23):54-56.
[2]徐惠.以数字化探究实验引领“分子间作用力”教学[J].化学教育(中英文),2017,38(15):20-23.
[3] 葛春洋,马宏佳.碳酸钠与碳酸氢钠溶解过程热效应的比较[J].化学教与学,2012(9):86-87.
[4] 熊言林,徐泽忠,张燕,黄萍.碳酸钠、碳酸氢钠与盐酸反应过程热效应的实验探究[J].化学教育,2009,30(1):66-68.
[5] 吴晓红.基于手持技术的中学化学实验案例[M].北京:冶金工业出版社,2016:18-20.
[6] 裴传友.中学化学数字化实验案例研究[M].芜湖:安徽师范大学出版社,2020.
[7] 陈琛,姚如富,邵忠德,翟蒙.数字化手持技术实验在高中化学课堂教学中的应用研究[J].化学教育,2015,36(1):29-33.
[8] 裴传友,马善恒.数字化实验:从教师讲授到学生体验——以化学平衡移动原理教学为例[J].中小学数字化教学,2018(5):46-48.
[9] 马善恒,姚如富,姚娟娟.数字化实验下“多因素对化学平衡影响”的复习课[J].中小学数字化教学,2018(1):29-32.
(作者裴传友、杨芹系安徽马鞍山含山县第二中学教师;马善恒系安徽省合肥市第六中学教师)
责任编辑:祝元志
