运用数字化实验促进学生理解电离过程的自发性
2021-12-29佘平平刘然

摘要: 应用不锈钢宽温度传感器和电导率传感器可以测量溶液的沸点和电导率相对于纯水的变化量。用溶液沸点升高的数值可以反推溶液中分散微粒的质量摩尔浓度。在信息技术支持下,根据溶质在溶液中微粒数量的改变情况,解析溶质在溶液中加热而非通电即可电离的自发行为,有利于从本质上解释电离。
关键词:电离;沸点;电导率;数字化实验
一、问题的提出
电离需要通电吗?1884年,法拉第在《关于电的实验研究》一文中第一次使用“电解质”“离子”等术语。早在19世纪初期,尼科尔森和卡里斯尔已经成功完成水的电解实验,之后不久戴维也成功电解了熔融的氢氧化钠和氢氧化钾。当时科学界普遍认为[1],电解质只有在外加电压的作用下才能解离成正负离子。
1882—1887年,阿伦尼乌斯致力于研究电离理论。基于对酸、碱、盐稀溶液在渗透压、沸点、蒸气压方面出现偏差情况的分析和对这些溶液电导率的测定,阿伦尼乌斯创造性地提出溶液电离理论[2]。在《关于溶质在水中的离解》一文中阐述了电离学说的基本观点“由于溶剂的作用,电解质在水中自动解离为带相反电荷的正负离子”。人教版化学教材对电解质的定义如下:在水溶液里或熔融状态下能够导电的化合物叫作电解质[3]。此定义从导电性角度规定了电解质的属性,让人们透过电解质溶液可以导电的表层现象去认识电解质在水溶液中离解的实质。科学家们在电离理论的争论与探索中揭示了科学规律,其实,中学生思维能力提升与科学进步的规律是一致的。教学中,如果教师没有从本质上解释电解质溶液导电的原因,将会对学生正确理解电解质概念造成障碍。学生在书写电离方程式时会错误地加上“通电”条件。课堂上,使学生学会从微观角度理解电解质的本质属性是知识与技能维度的教学难点。
二、设计实验方案
(一)电导率的测量
分别配制100 mL 0.5 mol/L、1 mol/L和2 mol/L的氯化钠溶液、氢氧化钠溶液、蔗糖溶液、葡萄糖溶液、草酸溶液待用。说明:受草酸溶解度的限制,没有配制 2 mol/L的草酸溶液。利用数据采集器结合电导率传感器测量几种溶液的电导率。
(二)沸点的测量
分别配制100 mL 0.5 mol/L和2 mol/L氯化钠、氢氧化钠、蔗糖、葡萄糖、草酸溶液,待用。利用数据采集器和不锈钢宽温度传感器测量溶液温度变化情况,从而得到溶液的沸点。为保证加热过程中溶液浓度基本不变,使用冷凝回流装置分别对溶液加热(如图1)。
三、实验结果与讨论
(一)溶液电导率的测量结果
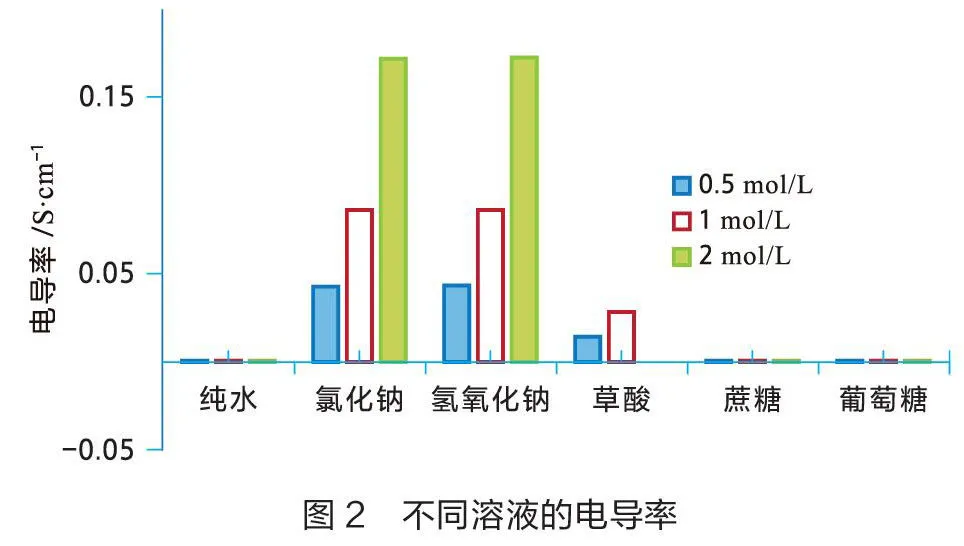
室温(22 ℃)环境下,用数据采集器和电导率传感器分别测量0.5 mol/L、1 mol/L和2 mol/L氯化钠溶液、氢氧化钠溶液、蔗糖溶液、葡萄糖溶液、草酸溶液的电导率,结果如图2 所示。实验结果和预期一致:相同浓度时强电解质电导率大,弱电解质电导率小,非电解质和纯水的电导率相当。三种电解质溶液(氯化钠、氢氧化钠、草酸)的浓度与电导率有关,浓度越大电导率越大。两种非电解质溶液(蔗糖、葡萄糖)的浓度对电导率几乎没有影响。
(二)溶液沸点的测量结果
1.非电解质溶液的沸点变化
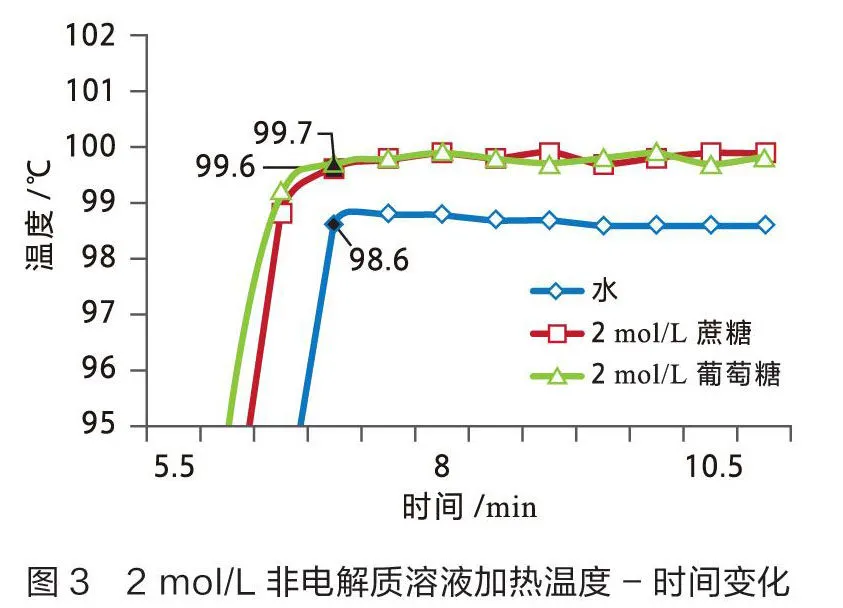
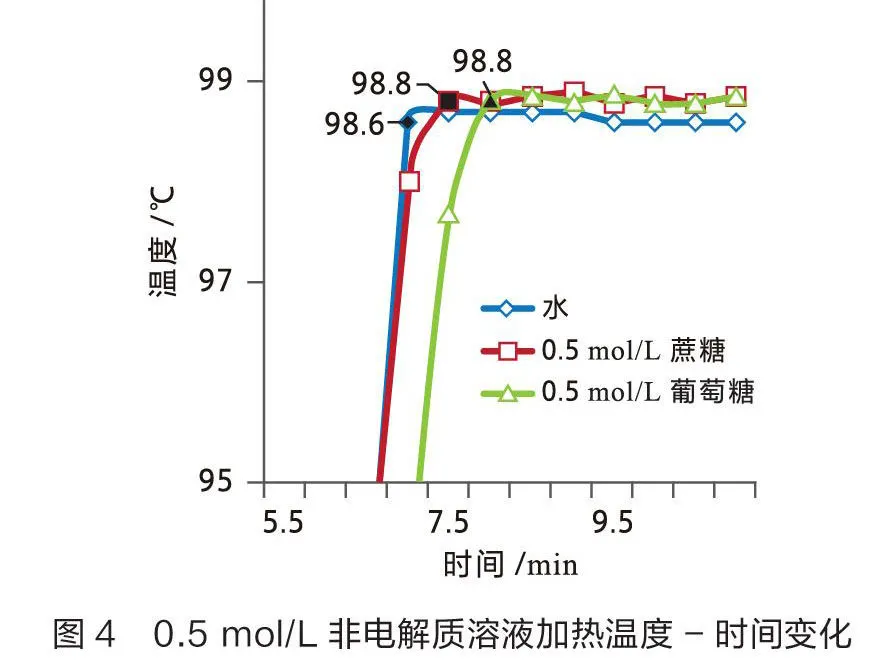
用数据采集器和不锈钢宽温度传感器测量0.5 mol/L和2 mol/L非电解质溶液(蔗糖和葡萄糖)的沸点,结果见图3和图4。
从图3可以看出纯水的沸点为98. 6 ℃,2 mol/L蔗糖溶液的沸点为99.7 ℃,2 mol/L葡萄糖溶液的沸点为99.6 ℃。2 mol/L蔗糖溶液的沸点较纯水升高1.1 ℃,2 mol/L葡萄糖溶液的沸点较纯水升高1.0 ℃。从图4可以看出0.5 mol/L蔗糖溶液的沸点为98.8 ℃,0.5 mol/L葡萄糖溶液的沸点为98.8 ℃。0.5 mol/L蔗糖溶液和葡萄糖溶液的沸点均较纯水升高0.2 ℃。
2.弱电解质溶液的沸点变化
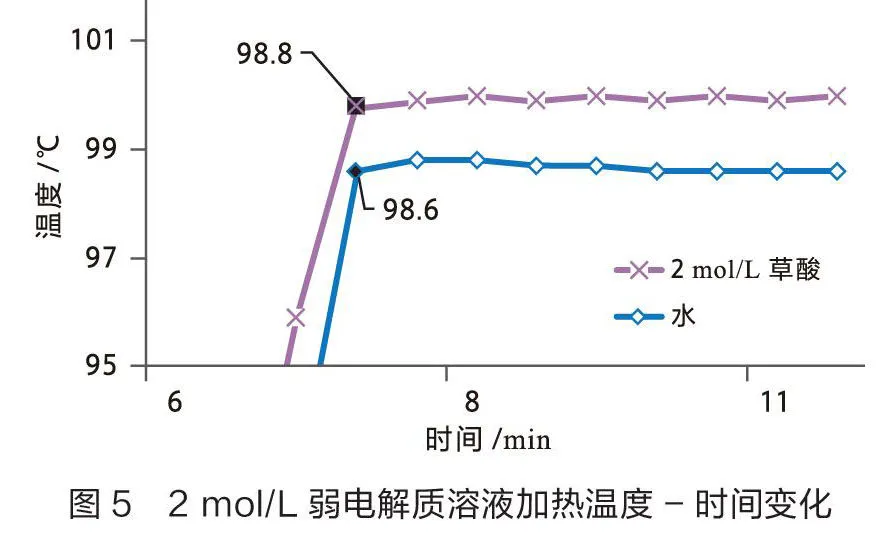
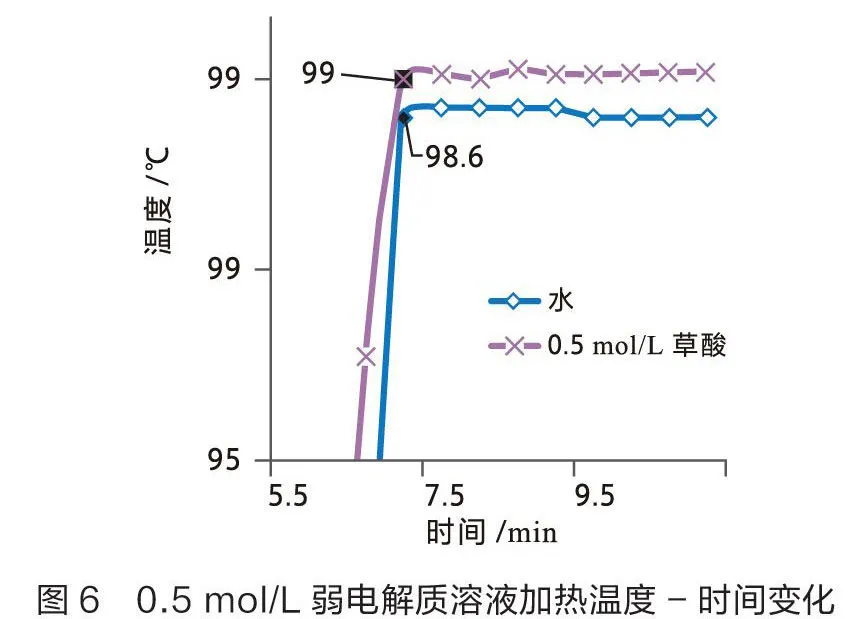
用数据采集器结合不锈钢宽温度传感器测量0.5 mol/L和2 mol/L弱电解质溶液(草酸)的沸点,结果见图5和图6。
从图5可以看出2 mol/L草酸溶液的沸点为99.8 ℃,沸点较纯水升高1.2 ℃。从图6可以看出0.5 mol/L草酸溶液的沸点为99 ℃,沸点较纯水升高0.4 ℃。
3.强电解质溶液的沸点变化
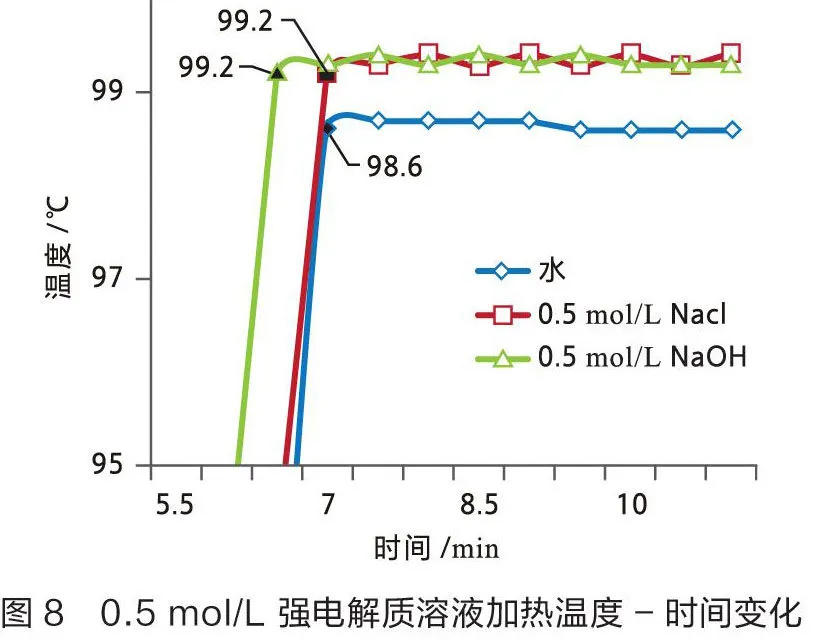
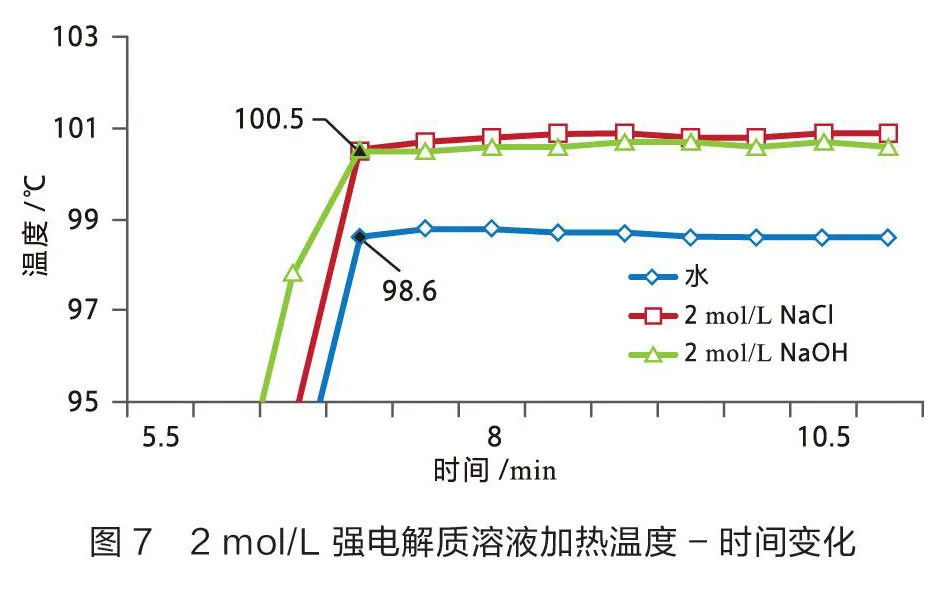
用数据采集器和不锈钢宽温度传感器测量0.5 mol/L和2 mol/L强电解质溶液(氯化钠和氢氧化钠溶液)的沸点,结果见图7和图8。
从图7可以看出2 mol/L氯化钠溶液和2 mol/L氢氧化钠溶液的沸点为100.5 ℃,两种2 mol/L的强电解质溶液沸点均较纯水高1.9 ℃。
从图8可以看出0.5 mol/L氯化钠溶液和0.5 mol/L氢氧化钠溶液的沸点为99.2 ℃,两种0.5 mol/L的强电解质溶液沸点较纯水高0.6 ℃。
(三)溶质的微粒数量关系
根据溶液的依数性[4],可知溶液沸点的升高与分散微粒的质量摩尔浓度成正比(见公式1)。
Δ= (公式1)
式中,Δ是沸点升高值,是溶液中分散微粒的质量摩尔浓度,是水的沸点升高常数,=0.513 K·kg·mol-1。
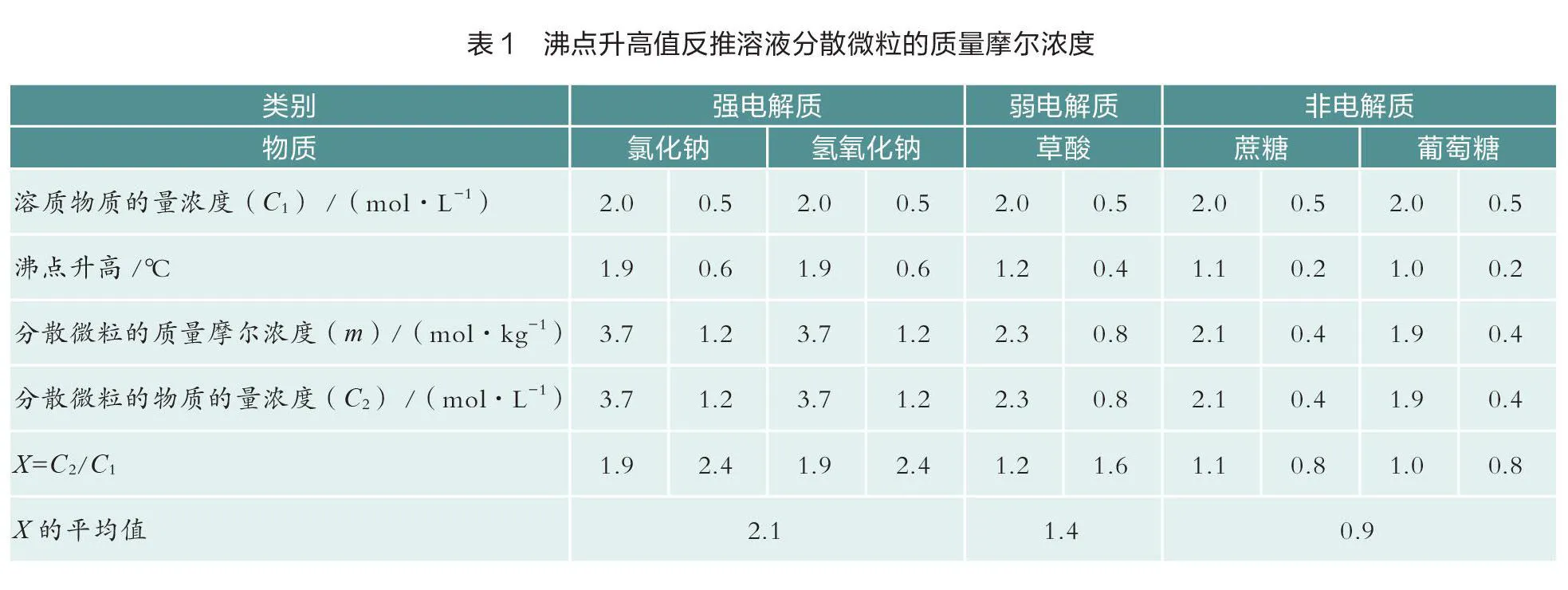
用沸点升高值反推溶液中分散微粒的质量摩尔浓度=Δ/。假设溶液的密度为1 g/mL,分散微粒的质量摩尔浓度()近似等于分散微粒的物质的量浓度()。将分散微粒的物质的量浓度()除以溶质的物质的量浓度()定义为,=/。笔者用值讨论溶质在溶液中微粒数量的变化,从而讨论溶质在溶液中的电离行为。具体数据处理结果见表1。
从实验结果可以看出:AB型强电解质(氯化钠、氢氧化钠)形成溶液后,= 2.1,即溶液中分散微粒的数量是溶质数量的2.1倍。弱电解质(草酸)形成溶液后,= 1.4,即溶液中分散微粒的数量是溶质数量的1.4倍。非电解质(蔗糖、葡萄糖)形成溶液后,= 0.9,即溶液中分散微粒的数量与溶质数量近似相等。沸点升高值较小,实验存在一定误差。在误差容许范围内,在未通电的情况下,强电解质完全电离,弱电解质部分电离,非电解质不电离。此实验结果与电导率实验结果一致。
四、传感器教学启示
(一)实现电离过程自发性的科学验证
对于电离过程自发性的探索,过去多采用测定溶液的电导率的方法进行实验。测定电导率过程中,有电流通过体系。此次实验,笔者通过测量溶液沸点与纯水沸点的差值,反推得到溶液中分散微粒的数量。实验过程中,仅仅对体系加热而没有通电,很好地向学生展示电离是自发的过程,电离过程不需要通电这一事实。由于沸点升高数值较小,传统的温度计因精确度低且无法连续测量,因此很难准确获取沸点的变化量。数字化实验的优势在于通过传感器实现连续测量和信号放大。此次实验中,笔者用温度传感器连续记录温度随时间变化的数据,利用拐点顺利找到了较为准确的沸点数值。
(二)帮助学生从微观上理解宏观概念
电离需要通电吗?以往,只能依靠文字阐述和符号分析来回答这个问题。数字化实验的研究和应用突破了传统概念原理教学的局限。将数字化实验引入化学原理教学,有利于教师引导学生根据实验图像和实验过程的变化进行清晰地辨识,为学生从反应体系中微观粒子数量变化的角度探析反应原理提供宏观认知的感性支撑。
《普通高中化学课程标准(2017年版)》明确提出“普通高中的培养目标是进一步提升学生的综合素质,着力发展核心素养”[5]。从这一目标出发,教学中教师可以借助数字化实验补足更多宏观的事实性材料,实现抽象原理的可视化,帮助学生更好地从微观上理解并探究抽象的概念与原理。在教学中发挥现代信息技术的作用,积极探索现代信息技术与化学实验的深度融合[5],可在“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”等多个维度发展学生的化学学科核心素养。
注:本文系中国化学会化学教育委员会“十三五”规划2018年规划课题“物质结构与性质项目式教学的实践研究”(课题编号:HJ2018-0023)的研究成果之一。
参考文献
[1] 蒋金玲.电解质概念的发展史[J].化学教育,2018(19):79-81.
[2] 张蕊,张宁,许燕红.立足化学史,突破“酸、碱、盐在水溶液中的电离”教学难点[J].化学教学,2017(4):39-44.
[3] 王晶,毕华林.普通高中教科书化学必修第一册[M].北京:人民教育出版社,2019.
[4] 华彤文,王颖霞,卞江,陈景祖.普通化学原理(第四版)[M].北京:北京大学出版社,2013.
[5] 中华人民共和国教育部.普通高中化学课程标准 :2017年版[S].北京:人民教育出版社,2018.
(作者佘平平、刘然系北京市第二中学教师)
责任编辑:祝元志
