融合传统与现代实验方法的深度学习
2021-12-29郑华



摘要: 文章以“金属的腐蚀与防护”为例,基于真实情境,借助手持传感器技术,按照化学事实—概念建立—知识价值的层级,探究了金属电化学腐蚀的本质和原理,设计了金属防护方法。实践证明,采用常规实验和手持数显氧气传感器相结合的方式演示实验,引导学生从微观角度分析宏观现象并应用电化学反应模型调控腐蚀的发生,有利于学生理解化学能与电能相互转化的过程,感受知识的价值,提高思辨能力,将知识迁移到生产、生活中,达到深度学习的效果。
关键词:化学教学;实验探究;传感器;深度学习
《普通高中化学课程标准(2017年版)》强调化学学科核心素养培养。“科学探究与创新意识”处于化学学科核心素养的中心位置。化学教学要达到如下目标:学生能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案;能运用化学实验、调查等方法进行探究。为此,教师需要组织深度学习活动,体现知识的教育价值和育人价值。胡久华等人将化学学科的深度学习界定为:在教师引领下,学生围绕具有挑战性的学习主题,开展以化学实验为主的多种探究活动,从宏微结合、变化守恒的视角,运用证据推理与模型认知的思维方式,解决综合复杂问题,获得结构化的化学核心知识,建立运用化学学科思想解决问题的思路方法,培养创新精神和实践能力,促进化学学科核心素养的发展。笔者以“金属的腐蚀与防护”为例,基于真实情境,提出探究问题,借助试管实验和手持传感器技术,探究金属电化学腐蚀的本质,并利用电化学模型解释金属电化学腐蚀的原理,设计金属防护方法。学生在学习知识的过程中,学会学习、学会思考,进而掌握知识的联系性、思辨性,达到深度学习的效果,真正发展创新能力和探究思维。
一、教学内容和整体设计
此次教学内容以人教版高中化学选择性必修1《化学反应原理》第四章第三节“金属的腐蚀与防护”为基础。学生在初中阶段,从宏观角度了解铁的生锈;高中阶段,认识原电池,明确了化学能与电能的转化关系。学生学习选择性必修1的知识,需进一步建立原电池和电解池的模型,理解化学能与电能相互转化的过程。在此基础上,学生进一步探究金属的电化学腐蚀,通过宏微结合,阐述金属腐蚀的原理,能解释日常生活中的相关应用,提高实验探究能力和分析解决问题能力。有关金属电化学腐蚀的知识层级如图1所示。
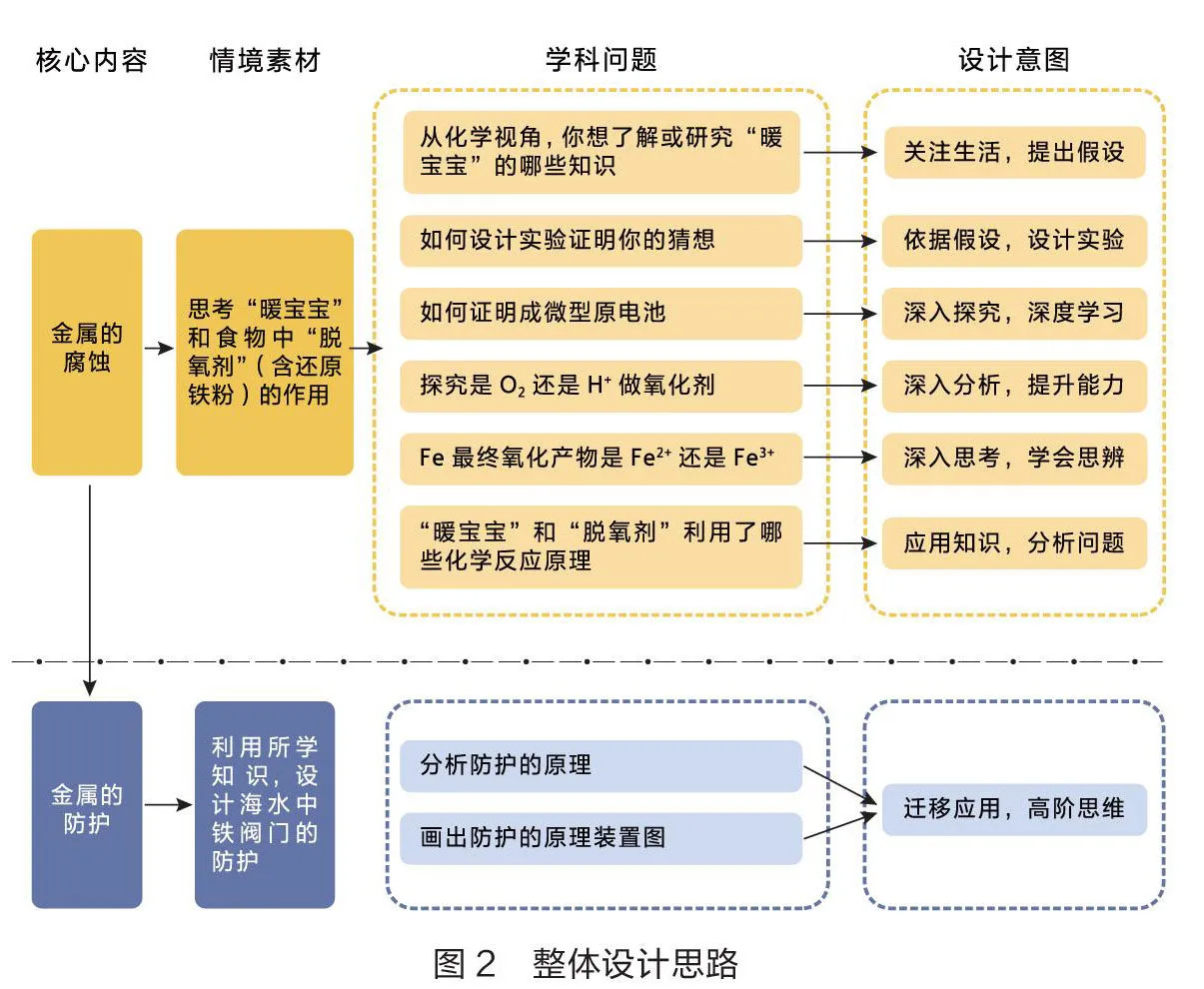
笔者根据知识主题和核心内容,选择“暖宝宝”和“脱氧剂”为素材(情境),以实验探究和小组讨论为主要活动方式,通过问题串引领学生参与学习过程,提高化学学科核心素养,发展高阶思维能力,从而达成深度学习的效果。整体设计思路如图2所示。
二、教学设计与实施
(一)课前学习
课前学习是整个教学活动的基础。课前,教师通过问卷,掌握学生已有知识基础和能力水平,引导学生首先激活旧知,之后自主对新知进行加工,最后将新知纳入原有的知识结构中,完成对知识的整体构建。具体问题见环节1。
环节1:课前问卷
(1)以“铁”为例,描述金属腐蚀的原理。
(2)应用原电池原理、电解原理,能够防止一块钢板(主要含铁)被腐蚀,请用相应的原理图展示设计方案。
(3)生活中接触过“暖宝宝”和“脱氧剂”吗?从化学视角,你想了解或研究它们的哪些知识?
资料:“暖宝宝”主要成分:铁粉、活性炭、水、蛭石(保温材料)、吸水性树脂、食盐。
铁系脱氧剂主要成分:铁粉、碳粉、钠盐、卤化物。
设计意图:引导学生回顾初中有关金属腐蚀的知识,为进一步的学习作铺垫。联系生活实际,帮助学生建立化学知识与实际的关联。
(二)课堂教学
1.知识体系构建
环节2:创设情境 提出问题
问题1:一包“脱氧剂”(含还原性铁粉)为什么能快速吸收O?一片“暖宝宝”为什么能快速产生大量热?
【学生】铁易被空气中O氧化,利用该反应可以吸收氧气。产生热量可能是反应放热。
【教师】铁生锈需要较长时间,即铁与空气中O反应较慢。这里是如何让反应快速放热的呢?
【学生】分析其成分并利用已有的电化学知识,猜测是发生原电池反应,从而加快反应速率。
问题2:如何证明猜测呢?
【学生设想1】不会制作微型原电池。能否用铁片和石墨棒模拟原电池实验,观察铁片—食盐水—石墨棒是否能产生电流。
【学生设想2】用传感器测“暖宝宝”或“脱氧剂”反应过程中的氧气含量或者压强变化。
【实验活动1】实验用品:U形管、灵敏电流计、导线、铁片、石墨棒、食盐水。
实验结果:灵敏电流计指针偏转。
实验结论:用铁片、石墨棒和食盐水可以组成原电池反应。由此推测“暖宝宝”和“脱氧剂”中应该发生了许多微型的原电池反应(见表1)。
【实验活动2】实验用品:塑料袋、铁粉、碳粉、食盐水、手持氧气传感器。
设计意图:让学生依据已有知识猜想并验证(提出假说,验证假说)。启发学生依据实验结论进行科学概括,得出金属腐蚀的电化学概念,并对比分析,比较电化学腐蚀与化学腐蚀的异同:发生的条件、反应的本质、是否产生电流等。学生在动脑动手过程中,主动获得新知识,并尝试使用电化学模型进行科学探究,实现深度学习。
环节3:交流讨论,分析原理
问题3 :上述电化学腐蚀过程中发生了什么?
【学生】依据原电池组成可知,电极材料是Fe、C,电解质溶液是NaCl溶液。实验发现,Fe失电子被氧化,同时氧气被还原,可应用电化学模型分析铁的电化学腐蚀。
【教师】Fe被氧化的产物是Fe2+还是Fe3+?O被还原产物又是什么呢?如何检验呢?
【学生】氧化产物Fe2+还是Fe3+?可以用铁氰化钾溶液和硫氰化钾溶液进行检验。不清楚O被还原的产物是什么。
【教师】引导学生分析电解质溶液成分,含大量Na+、Cl-、HO和少量H+、OH-。O得电子后,生成O2-,由于不稳定会结合H+,从而促进水电离,生成OH-。
【实验活动3】在实验活动1的基础上,取负极区溶液,滴加铁氰化钾溶液,有蓝色沉淀生成;滴加硫氰化钾溶液,溶液无明显现象。取正极区溶液,滴加酚酞溶液,溶液呈浅红色。
依据以上实验活动,完成电极反应式书写。
负极:Fe-2e-=Fe2+
正极:O+4e-+2HO=4OH-
总反应:2Fe+O+2HO=2Fe(OH)
【教师】讲解:通过吸收氧气而产生的金属的电化学腐蚀,称作吸氧腐蚀。生活中,钢铁表面有疏松的铁锈,主要成分是FeO。从Fe(OH)到最终的FeO发生的反应是什么。
【学生】依据学过的铁及其化合物的知识,写出反应式。
4Fe(OH)+O+2HO=4Fe(OH)
2Fe(OH)![]() = FeO+3HO
= FeO+3HO
设计意图:依据先修知识,分析实验现象,探究“暖宝宝”和“脱氧剂”发热原理,让学生体会通过合作讨论,实验验证解决问题的过程。学生在实验过程中学会分析,学会思考,深入理解金属吸氧腐蚀的原理。
【教师】提问:上述铁粉和碳粉混合物中滴入的是NaCl溶液,如果将NaCl溶液换成0.1 mol/L盐酸,会发生什么反应?微型原电池的两极反应如何表达?这种金属腐蚀过程如何命名?
【学生】讨论交流:已知Fe+2H+= Fe2++ H↑,判断负极反应不变Fe-2e-= Fe2+,正极变成H+放电2H++2e-=H↑。依据此现象和上述“吸氧腐蚀”,此过程中放出氢气,可称为“放氢腐Xxi3F/wNt8q+Iah+aCPQAErytng0AKzp+fFBdhgLW10=蚀”“出氢腐蚀”“析氢腐蚀”等。
【教师】点评与讲解:酸性条件下,不断有H放出的金属的电化学腐蚀称为“析氢腐蚀”。“吸氧腐蚀”和“析氢腐蚀”是化学学科中的专有名词,不能用其他同义词或近义词替代。
问题4:分析“吸氧腐蚀”和“析氢腐蚀”产生的条件,并讨论生活中金属腐蚀主要发生哪些腐蚀。
【实验活动4】实验步骤:将铁粉与碳粉混合后滴入不同电解质溶液,观察右侧U形管内红色溶液移动方向(如图3),判断发生腐蚀的类型(装置左侧可用手堵住,利用手指控制U形管内液面上升幅度,防止液面倒吸入瓶内或者溢出)。
实验现象:①中U形管内液面向右上移,瓶内有大量气泡生成。②中U形管内液面先向右上移一小段,后逐渐回移,再向左上移。③中U形管内液面向左上移。④中U形管内液面向左上移。
分析讨论:在其他条件相同的情况下,酸性较强的盐酸中,主要发生析氢腐蚀,产生H并释放热量,使体系内压强增大,造成U形管内液面向右上移;酸性较弱的盐酸中,开始可能发生析氢腐蚀,随着酸性的减弱,后发生吸氧腐蚀,使体8Kc+fROYGFudbaEjEpa0PiEeVnm1rYbpG54l8BV7x4Q=系内压强减小,造成U形管内液面向左上移。
【教师】拓展讲解:通过以上实验发现,吸氧腐蚀在弱酸性、中性和碱性溶液中发生;在强酸性溶液中以析氢腐蚀为主。从定量的角度研究后发现,当pH≤2时发生析氢腐蚀,pH=3~4时析氢腐蚀和吸氧腐蚀共存,pH > 4时发生吸氧腐蚀。日常生活中金属表面的水膜中会溶解来自大气中的CO气体,使水膜呈弱酸性。所以,生活中金属腐蚀以吸氧腐蚀为主。
设计意图:通过知识迁移,得出析氢腐蚀的存在;通过实验对比,让学生从物理角度和化学角度得出析氢腐蚀和吸氧腐蚀发生的条件,培养宏观辨识与微观探析的化学学科核心素养。
2.知识迁移应用
问题5:通过以上学习,金属腐蚀可能造成危害,也可能改善人们的生活。“暖宝宝”和“脱氧剂”的应用是从什么角度利用了金属腐蚀的?
【学生】“暖宝宝”是利用金属的电化学腐蚀过程中能量的变化,将化学能转化为热能。“脱氧剂”是利用金属的电化学腐蚀过程中的物质转化,吸收氧气。
问题6:利用原电池原理和电解原理能够防止一块钢板(主要含铁)被腐蚀,请用相应的原理展示设计方案。
【学生】合作讨论:利用原电池原理可防止钢板被腐蚀,连接一块活泼性比铁强的金属。根据电解池原理,将钢板与直流电源的负极相连。
在教师指导下,学生画出原理示意图。
【教师】高等化学中界定:有电子输出,发生氧化反应的一极称为阳极;有电子流入,发生还原反应的一极称为阴极。所以利用原电池防止某金属腐蚀,其名称为“牺牲阳极法”。
设计意图:相同的化学反应既能给社会造成危害,也能给人类带来便利,还能利用原理防止金属腐蚀的发生。学生感受到化学的魅力和作用,认识到只有深入学习,才能充分利用化学改善人类生活,促进社会发展。
三、教学反思
(一)利用手持传感器探究实验本质
手持数显氧气传感器简单易操作。教师用手持设备辅助完成探究实验,让学生切实感受到加入碳粉加快了铁与氧气的反应速率,有利于学生理解金属的电化学腐蚀原理。借助传感器实验探究现象背后的本质,有利于培养学生证据意识,激发他们探寻真理的兴趣。
(二)转换认识事物的角度
对于此课例的教学设计,以往多是由金属腐蚀的危害引入,探究腐蚀的原理,再探讨金属防护。笔者从日常用品“暖宝宝”和“脱氧剂”入手,探究腐蚀的原理,再应用腐蚀原理调控腐蚀的发生。笔者设计实验让学生感受到,金属腐蚀会带来危害,而理解其腐蚀原理,不仅可以调控腐蚀的发生,而且能应用到生产生活,造福于人类。
(三)从能量观、微粒观及反应观三方面理解并应用金属的电化学腐蚀
笔者采用常规实验(宏观现象)和手持数显氧气传感器(微观探析)相结合的方式,演示铁粉和碳粉混合与铁粉对比实验,引导学生从微观角度分析宏观现象(微粒观)。教师引导学生利用铁的吸氧腐蚀(反应观)做脱氧剂,利用反应的能量变化(能量观)做“暖宝宝”,利用电化学反应模型调控腐蚀的发生,有利于学生感受知识的价值,将知识迁移到生产、生活中。
(作者系北京市第九中学教师)
责任编辑:祝元志
