苜蓿花叶病毒和白三叶草花叶病毒复合侵染对本氏烟中5 种激素含量的影响
2021-12-29梁巧兰魏列新孟秀鹏姜玉玲陈应娥
岳 阳,梁巧兰,魏列新,何 辉,孟秀鹏,姜玉玲,蔺 珂,陈应娥
(甘肃农业大学植物保护学院 / 甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
植物激素(plant hormone)是植物自身代谢产生的、在极低浓度下可对植物的生命活动起调控作用的有机物质,水杨酸(salicylic acid, SA)、独脚金内酯(strigolactone, SLs)和油菜素内酯(brassinolide, BR)均可促进植物的光合作用、提高叶绿素含量、维持植物的直立与叶片形态、促进植物生长和分蘖[1-7];而茉莉酸(jasmonic acid, JA)通过调控乙烯(ethylene,ETH)含量变化调节植物生长和叶片脱落、诱导卷须卷曲、促进气孔关闭[8]。越来越多的研究发现生物胁迫和非生物胁迫均会引起植物体内激素的变化[2]。有研究发现,玉米褪绿斑驳病毒(maize chlorotic mottle virus, MCMV)侵染玉米(Zea mays)后会导致寄主新叶缩小,老叶皱缩萎蔫,诱导SA、JA、SLs 和BR 积累[9-10]。其中SA 作为信号分子,可提高植株体内可溶性糖、蛋白和游离脯氨酸等渗透调节物质的含量以及超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxide, POD)和过氧化氢酶(catalase, CAT) 3 种抗氧化酶活性,保护叶绿体,提高气孔导度和降低丙二醛(malondialdehyde, MDA)含量[3];而JA 会诱导蛋白酶抑制剂、苯丙氨酸转氨酶等与抗性有关的基因表达以提高植物抗逆性[11];SLs 在逆境下可消除活性氧自由基对植物的危害,其合成基因的表达水平受到SA、JA 和ETH 的调控,与SA 协同抑制病毒可进行自我复制,减少病毒数量,阻碍病毒在细胞间的传播[2,5,9];BR则在植物生长过程中能够增加有机物的合成、促进核酸和蛋白质的代谢,维持受到病毒胁迫后叶片的平展[12];ETH 合成受到SA、BR 的调控,与SA 和JA 介导的信号途径发生协同作用,共同激活由SA、JA 和ETH 信号途径组成的协同防御系统,调控脂肪氧化酶(lipoxygenase, LOX)、CAT、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性和H2O2含量,诱导产生病程相关蛋白(pathogenesis-related protein, PR)等抗病蛋白,使植物系统获得系统获得性抗性(systematic acquired resistance, SAR)[13-14]。因此,这5 种激素可共同抵御病毒等病原物侵染危害[1]。
植物在生长过程中常常会受到不同病毒的多次侵染或复合侵染,这种现象十分普遍。据报道,在马铃薯(Solanum tuberosum) X 病毒与马铃薯Y 病毒、大豆花叶病毒(soybean mosaic virus, SMV)与菜豆荚斑驳病毒(bean pod mottle virus, BPMV)、小麦线条花叶病毒(wheat streak mosaic virus, WSMV)与玉米矮花叶病毒(maize dwarf mosaic virus, MDMV)、甘薯羽状斑驳病毒(sweet potato feathery mottle virus, SPFMV)与甘薯褪绿矮化病毒(sweet potato chlorotic stunt virus,SPCSV)之间存在复合侵染现象,这些病毒在侵染寄主后发生协生作用,导致寄主出现比其中任意一种病毒侵染更加严重的症状[15-16]。引起苜蓿(Medicago sativa)病毒病的主要病原苜蓿花叶病毒(alfalfa mosaic virus, AMV)是苜蓿花叶病毒属中寄主最多的植物病毒,可以侵染包括苜蓿、白三叶草(Trifolium repens)、 豇豆(Vigna unguiculata)、 烟草(Nicotiana tabacum)、 辣椒 (Capsicum annuum)等51 科430 多种植物[17],常常在苜蓿、三叶草、豇豆和烟草等植物中与白三叶草花叶病毒(white clover mosaic virus, WCMV)、菜豆黄花叶病毒(bean yellow mosaic virus, BYMV)、豇豆花叶病毒(cowpea mosaic virus, CPMV)、红三叶草明脉花叶病毒(red clover vein mosaic virus, RCVMV)、烟草花叶病毒(tobacco mosaic virus, TMV)、黄瓜花叶病毒(cucumber mosaic virus, CMV)、大豆花叶病毒等发生复合侵染,同样加重病害发生[18-19];其中,AMV 与WCMV 复合侵染白三叶草的田间复合侵染率高达83.3%[20],在复合侵染的寄主体内2 种病毒的含量分别是单独侵染寄主体内病毒含量的5.897 和3.515 倍[21];复合侵染苜蓿后使叶片中与抗病性相关的多酚氧化酶(polyphenol oxidase, PPO)、过氧化物酶(peroxidase, POD)和苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL) 3 种防御酶活性显著升高、叶绿素和可溶性蛋白含量均降低,AMV 和WCMV 复合侵染苜蓿、三叶草等豆科牧草后,严重影响牧草的生长,使牧草产量降低[22]。
但是,有关AMV 和WCMV 复合侵染后,随着时间的延长是否会通过诱导寄主植物中SA、JA、SLs、BR 和ETH 的积累或减少来影响植物的正常生长,以及各激素之间的协同关系等问题尚未见系统报道。为此,本研究以提纯的AMV、WCMV 和不同比例混合的AMV、WCMV 病毒液接种本氏烟(Nicotiana benthamiana),通过测定不同时间下5 种激素的含量及变化,旨在明确AMV 和WCMV 复合侵染对寄主中SA、JA、SLs、BR 和ETH 等激素含量的影响,这对进一步从植物内源激素变化方面揭示AMV 和WCMV 复合侵染寄主的致病机理具有重要意义。
1 材料与方法
1.1 试验材料
1.1.1 供试材料
本氏烟:2020 年秋季种植于发光二极管(light emitting diode, LED)顶置人工气候箱中,温度25 ℃、16 h/8 h(L/D)、相对湿度60%、光照8 000 lx,共120株,备用。
AMV 和WCMV 病毒:保存于−80 ℃冰箱中,浓度300 pg·mL−1,备用。
AMV 和WCMV DAS-ELISA 定量检测试剂盒购自江苏晶美生物科技有限公司;SA、JA、SLs、BR、ETH ELISA 定量检测试剂盒 购自江苏晶美生物科技有限公司。
0.02 mol·L−1磷酸盐缓冲溶液(phosphate buffer solution, PBS):pH 7.0、pH 7.2。
1.1.2 供试仪器设备
试验设备:立式高压蒸汽灭菌器(上海申安医疗器械厂)、电热恒温水浴锅(上海跃进医疗器械有限公司)、高速冷冻离心机(德国Eppendorf 公司)。
试验仪器:酶标仪(美国Biotek 公司)。
1.2 试验方法
1.2.1 病毒接种处理
分别将AMV 和WCMV 按照体积比1 ꞉ 0、0 ꞉ 1、1 ꞉ 1、1 ꞉ 3、3 ꞉ 1 混合,然后取各病毒液1 mL 分别加PBS 缓冲液(pH 7.0) 4 mL,稀释成5 倍病毒液,从上述种植的本氏烟中选取60 株健康的、长势一致、4~5 片叶的幼苗,使用摩擦接种法,接种前用灭菌水冲洗接种叶,待叶片干净后轻轻洒少许金刚砂,并滴加0.1 mL 病毒液,用指腹小心摩擦接种[22],每株接种3 片叶,以只接种0.1 mL 0.02 mol·L−1PBS 缓冲液(pH 7.0)的本氏烟为对照,每个处理重复接种10 株,接种后用蒸馏水冲洗叶片上多余的病汁液,然后将幼苗置于人工气候箱中,定时定量浇灌营养液培养,并观察发病情况,待发病后进行带毒检测及病毒含量测定。
1.2.2 接种的本氏烟病毒含量检测
2 种病毒含量标准曲线制作:设空白孔和标准孔,分别取AMV 和WCMV 检测试剂盒中提供的AMV、WCMV 标准品,使用试剂盒提供的标准品稀释液将AMV 标准品稀释至15、30、60、120、240 pg·mL−1,将WCMV标准品稀释至12.5、25、50、100、200 pg·mL−1,然后分别取稀释好的不同浓度的2 种病毒标准品分别加入各自配套的酶标板上的不同标准孔内,每孔加标准品50 μL;按照AMV、WCMV 检测试剂盒的产品说明书操作步骤进行,反应完成后每孔加反应终止液50 μL 终止反应,以空白孔调零,用酶标仪在15 min内测定各孔450 nm 下的吸光值,以AMV、WCMV标准品不同浓度为横坐标x,以不同浓度下450 nm处吸光值为纵坐标y,在Excel 2010 中制作标准曲线y=ax+b。
接种幼苗病毒含量检测:取上述接种病毒72 h后的幼苗叶片,去叶脉后称取0.5 g,放入冰冻的研钵后,以1 ꞉ 4 的比例加入PBS 缓冲液(pH 7.0)冰浴研磨后于4 ℃下2 000 r·min−1离心20 min,取上清液备用;在酶标板上设置阴性对照孔、阳性对照孔、空白对照孔(空白对照孔不加样品及酶标试剂)和待测样品孔;阴性对照孔、阳性对照孔中分别加入阴性对照、阳性对照50 μL,待测样品孔中先加入样品稀释液40 μL,再加入离心后的上清液10 μL,不同处理做不同标记,每个处理重复3 次;然后按照AMV、WCMV 检测试剂盒的产品说明书操作步骤进行。反应终止后以空白对照孔调零,利用酶标板在450 nm 处测定OD 值,当阳性对照孔平均值≥ 1.00、阴性对照孔平均值 ≤ 0.10 即可判定试验有效;计算临界值(临界值 = 阴性对照孔平均值 +0.15);当样品孔的OD 值 ≥ 临界值即为AMV 或WCMV 阳性;并将测得的OD 值代入制作好的标准曲线中,求出x值,再乘以稀释倍数,即为样品中病毒浓度。
1.2.3 接种AMV 和WCMV 的本氏烟中5 种激素含量测定
5 种激素含量标准曲线制作:从5 种激素的检测试剂盒中取出5 种激素标准品,按照各试剂盒说明书进行稀释,样品稀释液取自各试剂盒。SA 标准品稀释至75、150、300、600、1 200 pmol·L−1,JA 标准品稀释至62.5、125、250、500、1 000 pmol·L−1,SLs 标准品稀释至3、6、12、24、48 ng·L−1,BR 标准品稀释至7.5、15、30、60、120 ng·L−1,ETH 标准品稀释至20、40、80、160、320 ng·L−1,并设空白对照孔,每个处理重复3 次;然后分别按照各激素检测试剂盒说明书的操作步骤进行,待反应完成后加入终止液,在15 min 内用酶标仪测定450 nm 处的吸光值,以5 种激素标准品浓度为横坐标x,以不同激素不同浓度对应的吸光值为纵坐标y,使用Excel 2010 制作标准曲线y=ax+b。
5 种激素样品液提取:分别于不同接种处理72、144、216、360、432、504、576、648、720 h 时剪去本氏烟叶片(去叶脉),称取0.2 g,立即放入−20 ℃冷冻的研钵中,加入少许石英砂和0.8 mL 0.02 mol·L−1的PBS 缓冲液(pH 7.2)冰浴研磨后转入1.5 mL 尖底离心管中,于4 ℃下2 500 r·min−1离心20 min,将上清液小心转移到灭菌离心管中,即为5 种激素样品提取液,立即转移至冰浴中,备用。
激素含量的测定:取上述提取的样品液10 μL加入试剂盒提供的对应样品稀释液(40 μL)中(稀释5 倍),每种激素各设空白对照孔、样品孔,按照产品说明书步骤进行5 种激素含量的测定,于450 nm处测得吸光值后,将待测样品吸光值代入各激素标准曲线回归方程中,计算出样品浓度,再乘以稀释倍数,即为样品中各激素的实际浓度,将各激素浓度换算为每克鲜叶中的激素含量。
1.3 数据统计分析
采用SPSS 25.0 进行数据统计和方差分析,用平均值和标准误描述测定结果,对同一时间不同处理的数据进行单因素方差分析,并用Duncan 法对所得数据进行多重比较;采用Excel 2010 进行标准曲线绘制、数据整理及制图。
2 结果与分析
2.1 本氏烟幼苗AMV 和WCMV 带毒检测
2.1.1 AMV 和WCMV 浓度标准曲线
DAS-ELISA 定量检测AMV 的标准曲线为y=226.63x−10.162(r= 0.999 2);WCMV 的标准曲线为y=145.17x+6.281 3(r= 0.992 6)。
2.1.2 本氏烟幼苗AMV 和WCMV 检测
采用DAS-ELISA 方法检测接种72 h 的本氏烟叶片中AMV、WCMV 带毒情况及浓度,结果表明2 种病毒按1 ꞉ 1、1 ꞉ 3 和3 ꞉ 1 混合接种和单独接种处理的10 株幼苗叶片, 均表现为AMV 和WCMV 阳性及AMV 或WCMV 阳性,带毒检出率均为100%。3 个不同比例接种2 种病毒混合液的处理中1 ꞉ 1 比例时AMV、WCMV 浓度分别为178.65、153.72 pg·mL−1,1 ꞉ 3 比例时AMV、WCMV 浓度分别为138.83 和152.60 pg·mL−1,均低于AMV、WCMV 单独接种的病毒浓度(328.28 和270.94 pg·mL−1)。AMV 和WCMV 以3 ꞉ 1 比例接种后本氏烟叶片中2 种病毒浓度分别为344.97、216.61 pg·mL−1,其中AMV 浓度高于单独接种AMV 的本氏烟叶片中AMV 浓度(表1)。

表1 接种72 h 后本氏烟叶片中AMV 和WCMV 病毒的浓度Table 1 Concentration of AMV and WCMV in Nicotiana benthamiana leaves after 72 hours of inoculation pg·mL−1
接种病毒720 h 后,复合侵染症状明显重于单独侵染,其中AMV 和WCMV (3 ꞉ 1)混合液复合侵染本氏烟叶片症状最明显,出现了严重花叶、明脉的症状;AMV 和WCMV (1 ꞉ 1)混合液侵染本氏烟叶片表现出明脉、斑驳症状;AMV 和WCMV (1 ꞉ 3)混合液侵染本氏烟叶片表现出较严重的皱缩、轻微斑驳花叶;AMV 单独侵染后本氏烟叶片出现斑驳花叶、明脉症状;WCMV 单独侵染后本氏烟叶片则出现轻花叶症状;对照(CK)表现健康、无症状(图1)。

图1 AMV 和WCMV 复合侵染720 h 时本氏烟叶片症状表现Figure 1 Symptoms on leaf inoculated with AMV and WCMV at 720 h in Nicotiana benthamiana
2.2 接种AMV 和WCMV 对本氏烟叶片5 种激素含量的影响
2.2.1 5 种激素含量标准曲线制作
通过DAS-ELISA 方法对5 种激素不同浓度标准品的OD 值进行测定,建立的标准曲线分别为:

2.2.2 水杨酸含量的变化
测定接种病毒后本氏烟叶片中的SA 含量(图2)发现,接种AMV 和WCMV 混合液及单独接种AMV或WCMV 后本氏烟叶片中SA 含量均高于健康植株(CK),并且SA 含量随着接种时间的增加表现出先升高后降低的趋势,在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 72 h 时SA 含量值最低,比单独接种WCMV 的本氏烟中SA 含量分别降低了12.33%、38.98%和14.69%,AMV 和WCMV 接种比例为3 ꞉ 1和1 ꞉ 3 的比单独接种AMV 的本氏烟中SA 含量分别提高了2.82%和0.70%,AMV 和WCMV 接种比例为1 ꞉ 1 处理的SA 含量低于单独接种AMV 处理,高于CK;SA 含量在接种AMV 和WCMV 混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 360 h 时达到最高值,分别为5.22、4.40 和3.89 ng·g−1,比单独接种AMV 的本氏烟叶片中SA 含量分别高61.61%、36.22%和20.43%,比单独接种WCMV 的本氏烟叶片中SA 含量分别高63.13%、37.50%和21.56%,比CK 分别高92.62%、62.36%和43.54%;144~720 h 时,AMV 和WCMV接种比例为3 ꞉ 1 和1 ꞉ 1 的本氏烟中SA 含量显著高于单独接种AMV、WCMV 和CK (P< 0.05);在不同测定时间,各接种处理植株叶片的SA 含量之间均存在明显差异。
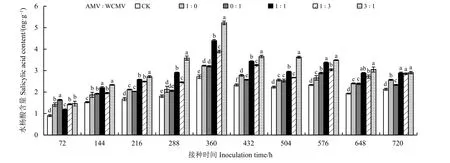
图2 接种AMV 和WCMV 对本氏烟叶片中水杨酸含量的影响Figure 2 Effects of inoculation with AMV and WCMV on salicylic acid (SA) content in Nicotiana benthamiana leaves
2.2.3 茉莉酸含量的变化
测定接种病毒后本氏烟叶片中JA 含量(图3)发现,接种AMV 和WCMV 混合液及单独接种AMV 或WCMV 后本氏烟叶片中JA 含量除648 和720 h 外均低于健康植株(CK),并且JA 含量随着接种时间的增加表现出先降低后升高的趋势,其中在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 360 h时本氏烟叶片中JA 含量降至最低,分别为0.54、0.72 和1.10 ng·g−1,比单独接种AMV 本氏烟叶片中JA 含量分别低59.09%、45.45%和16.67%,比单独接种WCMV 本氏烟叶片中JA 含量分别低61.43%、48.57%和21.43%,比CK 分别低66.46%、55.28%和31.68%;JA 含量在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 720 h 时本氏烟叶片中达到最大,分别为2.44、2.34 和2.25 ng·g−1,除了以1 ꞉ 3 比例接种外,接种其余两个比例混合液均使得本氏烟叶片中JA 含量高于单独接种AMV和WCMV、 CK, 比单独接种AMV 分别高11.93%和7.34%,比单独接种WCMV分别高8.93%和4.46%, 比CK 分别高5.17%和0.86%;接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 72 h时的本氏烟叶片中JA 含量仅次于720 h,高于其余接种时间的JA 含量,分别为1.91、2.03 和2.07 ng·g−1,比单独接种AMV 和WCMV 均高30.19%以上;接种时长在576 和720 h 时,所有处理之间均无显著差异,除此之外,其余接种时间下各接种处理间差异明显。
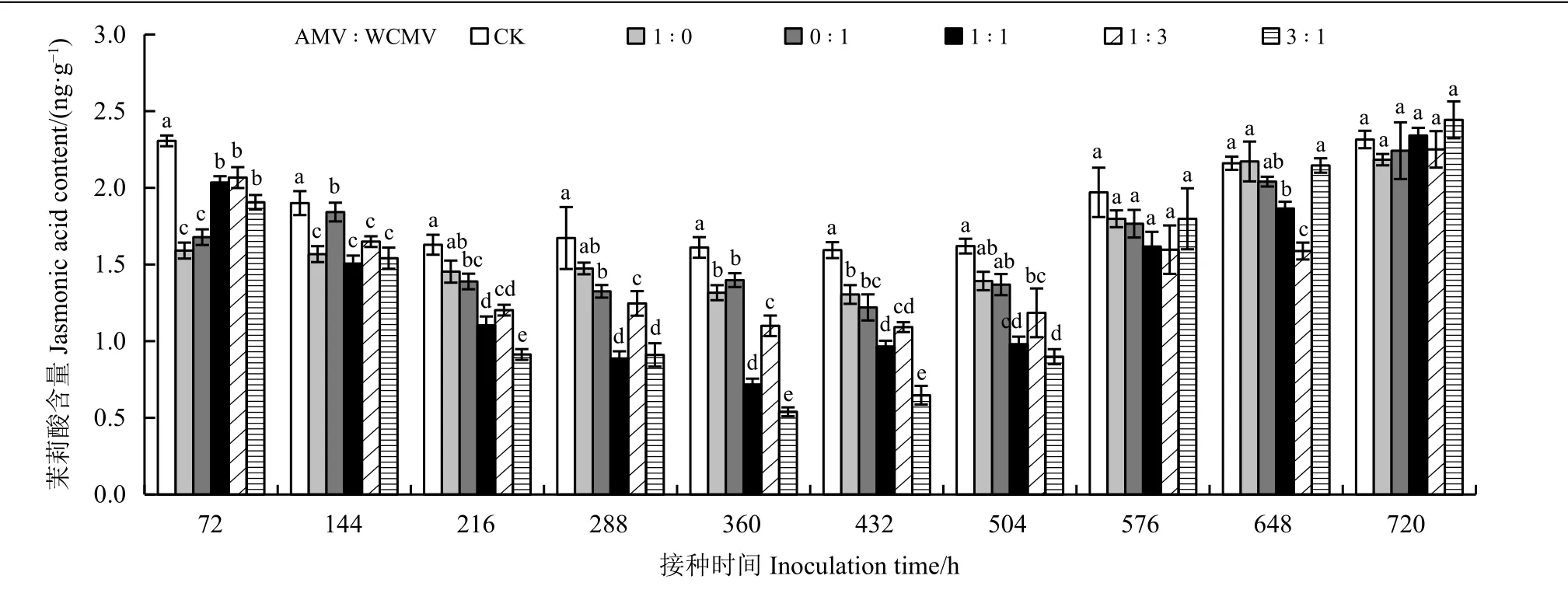
图3 接种AMV 和WCMV 对本氏烟叶片中茉莉酸含量的影响Figure 3 Effects of inoculation with AMV and WCMV on jasmonic acid (JA) content in Nicotiana benthamiana leaves
2.2.4 独角金内酯含量的变化
测定接种病毒后本氏烟叶片中SLs 含量(图4)发现,接种AMV 和WCMV 混合液及单独接种AMV或WCMV 后本氏烟叶片中SLs 含量除720 h 接种比例3 ꞉ 1 处理外均高于健康植株(CK),并且SLs 含量随着接种时间的增加表现出先升高后降低的趋势,其中SLs 含量在AMV 和WCMV 接种比例为3 ꞉ 1 处理360 h 时达到最大,为1.39 ng·g−1,此时,其比单独接种AMV 和WCMV、CK 分别高36.27%、39.00%和69.51%;SLs 含量在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 72 h 时降到最小,分别为0.61、0.53 和0.44 ng·g−1,其中,AMV 和WCMV 的接种比例为3 ꞉ 1 的处理比单独接种AMV、WCMV 和CK 中的SLs 含量分别高10.91%、12.96%和56.41%,而接种比例分别为1 ꞉ 1 和1 ꞉ 3 的处理中SLs 含量均低于单独接种AMV、 WCMV 处理, 但高于CK; 在216~648 h 接种时间内,接种比例为3 ꞉ 1 和1 ꞉ 1 的处理与其余处理植株叶片的SLs 含量之间存在明显差异。

图4 接种AMV 和WCMV 对本氏烟叶片中独脚金内酯含量的影响Figure 4 Effects of inoculation with AMV and WCMV on strigolactones (SLs) content in Nicotiana benthamiana leaves
2.2.5 油菜素内酯含量的变化
测定接种病毒后本氏烟叶片中BR 含量(图5)发现,接种AMV 和WCMV 混合液及单独接种AMV或WCMV 后本氏烟叶片中BR 含量除处理648 h 外其余处理时间均高于健康植株(CK),并且BR 含量随着接种时间的增加表现出先升高后降低的趋势,其中BR 含量在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉3) 360 h 时的本氏烟叶片中达到最大,分别为3.73、3.15 和2.64 ng·g−1,比单独接种AMV 处理分别高63.60%、38.16%和15.79%,比单独接种WCMV 处理分别高60.78%、35.78%和13.79%,比CK 分别高81.95%、53.66%和28.78%;BR 含量在AMV 和WCMV接种比例为3 ꞉ 1 处理 720 h 时降至最小,为1.27 ng·g−1,此时,其比单独接种AMV 和WCMV 处理分别低19.69%和16.54%,比CK 高30.93%;在360 和504 h 接种时间下各接种处理植株叶片的BR 含量之间有明显差异。
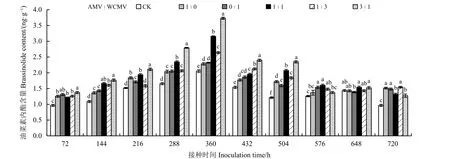
图5 接种AMV 和WCMV 对本氏烟叶片中油菜素内酯含量的影响Figure 5 Effects of inoculation with AMV and WCMV on brassinolide (BR) content in Nicotiana benthamiana leaves
2.2.6 乙烯含量的变化
测定接种病毒后本氏烟叶片中ETH 含量(图6)发现,接种AMV 和WCMV 混合液及单独接种AMV 或WCMV 后本氏烟叶片中ETH 含量均高于健康植株(CK),并且ETH 含量随着接种时间的增加表现出先升高、后降低、再升高、再降低的趋势,其中ETH 含量在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 648 h 时达到最大,分别为8.32、7.19 和6.51 ng·g−1,此时,3 个处理分别比单独接种AMV 处理高66.07%、43.51%和29.94%,分别比单独接种WCMV处理高63.46%、41.26%和27.90%,分别比CK 高108.52%、80.20%和63.16%;ETH 含量在接种两种病毒混合液(3 ꞉ 1、1 ꞉ 1、1 ꞉ 3) 360 h 时的本氏烟叶片中略低于648 h,分别为6.26、5.69、5.19 ng·g−1,此时,3 个处理分别比单独接种AMV 处理高38.50%、25.89%和14.82%,分别比单独接种WCMV 处理高31.51%、 19.54%和9.03%, 分别比CK 高65.17%、50.13%和36.94%;ETH 含量在AMV 和WCMV 接种比例为3 ꞉ 1 处理72 h 时降至最小,为1.60 ng·g−1,此时,比单独接种AMV 和WCMV 分别低30.63%和35.00%,比CK 高10.35%;72~720 h 不同接种时间下各接种处理植株叶片的ETH 含量之间差异明显。

图6 接种AMV 和WCMV 对本氏烟叶片中乙烯含量的影响Figure 6 Effects of inoculation with AMV and WCMV on ethylene (ETH) content in Nicotiana benthamiana leaves
3 讨论与结论
本研究发现,接种AMV 和WCMV 混合液(3 ꞉ 1)后复合侵染的本氏烟叶片症状明显重于接种AMV和WCMV 混合液(1 ꞉ 1、1 ꞉ 3)及单独接种AMV 或WCMV 本氏烟症状;而且在接种72 h 后,接种叶中AMV 浓度明显高于其他处理,WCMV 浓度除了略低于单独接种WCMV 的浓度外均高于其他处理。接种AMV 和WCMV 混合液的本氏烟叶片中SA、JA、SLs、BR 和ETH 含量分别在144~432 h、72~504 h、360~432 h、360~504 h 和288~648 h 与单独接种AMV、WCMV 及健康植株叶片中的含量之间有明显差异。接种AMV 和WCMV 混合液(3 ꞉ 1)的本氏烟叶片中SA、SLs、BR 和ETH 4 种激素的含量分别在360、360、360、648 h 达到最高,显著高于单独接种AMV、WCMV 和健康植株(CK),与单独接种AMV 和WCMV、CK 本氏烟叶片中4 种激素含量相比,SA 含量分别提高了61.61%、63.13%、92.62%,SLs 含量分别提高了36.27%、39.00%和69.51%,BR含量分别提高了63.60%、60.78%和81.95%,ETH 含量分别提高了66.07%、63.46%和108.52%;72~504 h 时,接种AMV 和WCMV 混合液(3 ꞉ 1)的本氏烟叶片中JA 含量均明显低于单独接种AMV、WCMV和健康植株(CK),其中接种360 h 时分别降低了59.09%、61.43%和66.46%。
SA 和JA 是植物体内重要的信号分子,在植物防御病原菌入侵过程中扮演着重要角色[23]。SA 化学名为邻羟基苯甲酸,是植物体内的小分子酚类物质,参与活体或半活体营养型病原菌引发的抗病并诱发植物的系统获得性抗性。JA 化学名称为3-氧-2-(2’-戊烯基)-环戊烷乙酸,是一种脂肪酸类的信号分子,参与死体营养型病原菌及其昆虫诱导的抗病并激发植物的诱导系统抗性(induced systemic resistance, ISR)。大量研究表明,当植物受到病原侵染后,体内SA、JA 和ETH 等信号分子将引起一系列的抗病信号传导,调控SLs 和BR 等相关激素的合成,最终激活病程相关基因(pathogenesis-related genes, PR)的表达[14]。
据报道,生物胁迫会导致寄主植物激素水平发生变化,植物响应逆境条件时,可以通过调节自身的激素合成量来增强抗逆性。病毒胁迫会导致寄主植物叶片中的SA、JA 和BR 积累并触发病原物相关分子模式触发式免疫(pattern-triggered immunity,PTI)[7,10,24-26]。拟南芥(Arabidopsis thaliana)感染AMV后,会通过调节JA 和SA 的合成相关基因来减轻病毒侵染对自身活力的影响[27],在病原菌胁迫下SLs 相关基因能够在维管组织和输导组织中大量表达,促进可阻碍病原菌在胞间连丝中传导的胼胝质的生成[9];同时在逆境胁迫下各激素间表现为协同或拮抗作用,组成抗胁迫网络,抵抗病害的发生;而ETH 含量随着SA 和BR 含量的升高而升高,SA 和BR 可促进ETH 的合成。有研究表明,SA 和JA 之间表现为拮抗作用[23]。玉米在抗MCMV 胁迫时SA 和BR 表现为协同作用,而与JA 之间表现为拮抗作用[10];寄主植物的症状表现也与激素水平的变化有关[28],出现植物组织变色、坏死、畸形等症状的根本原因就是病毒入侵寄主后对寄主激素代谢水平产生了一定的干扰[14]。5 种激素中,SA、SLs 和BR 均可以促进植物的光合色素合成和气孔关闭、提高光合速率、维持植株生长[1,4,6],JA、ETH 可以延缓植株生长、促进叶片衰老和脱落[11-12]。本研究也发现,接种AMV 和WCMV 两种病毒混合液(3 ꞉ 1、1 ꞉ 1)后,可提高本氏烟叶片中SA (144~720 h)、SLs(216~648 h)、BR (288、360、504 h)和ETH (216~360 h、504~648 h)含量,其含量均明显高于接种单个病毒处理和对照,JA 含量则是在216~504 h 低于接种单个病毒处理和对照,而且几种激素的相互作用使本氏烟叶片表现出重花叶、斑驳轻花叶、明脉、皱缩等不同的症状类型,产生不同程度的过敏反应,当复合接种发病的本氏烟中病毒含量越大、症状越严重时叶片中SA、SLs、BR 和 ETH 含量越大,而JA 含量越小;432~720 h 时ETH 含量先随着SA、SLs 和BR 含量的降低而降低,之后受到JA 的促进作用,与JA 一起大量合成、积累[29],植株叶片变小、生长速度降低,导致了本氏烟植株的衰亡。
本研究仅针对AMV、WCMV 复合侵染本氏烟中5 种激素含量变化进行了检测,证明了AMV、WCMV 复合侵染存在协生作用,提高了寄主植物叶片内病毒浓度并加重了症状表现,明确了AMV 和WCMV 复合侵染对本氏烟720 h 内5 种激素含量影响的变化规律。但是,由于苜蓿叶片较小、表面具绒毛、采用摩擦接种病毒发病慢,故只选择使用模式作物本氏烟来进行试验;有关AMV 和WCMV 复合侵染苜蓿后叶片中激素含量变化与两种病毒复合侵染致病机理之间的关系、AMV 和WCMV 复合侵染本氏烟与苜蓿后5 种激素之间的协同关系以及对寄主光合色素合成及光合速率、苜蓿品质的影响等问题尚未涉及,还有待进一步的研究。
