桉树种植区水库秋冬季“翻黑水”形成机理研究
2021-12-29倪利晓蒋志云李象岚陈旭清
李 琰,倪利晓,2,蒋志云,徐 楚,李象岚,徐 俭,陈旭清
(1.河海大学环境学院,江苏 南京 210098;2.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098;3.无锡市蓝藻治理办公室,江苏 无锡 214071)
0 引言
由于桉树具有适应性强、经济价值和药用价值高等优势而被各国广泛种植,我国也为桉树种植大国。目前,桉树主要种植在我国南方地区,以广西、福建、云南为代表,种植桉树对当地经济和中国林业发展均作出了重要贡献[1]。但大规模种植桉树也造成土壤肥力下降、生物多样性减少、水体污染等危害[2]。桉树砍伐过后残留的大量剩余物,在高温、潮湿的环境下,容易诱发黑水现象[3]。黑水汇入河流后,导致水体pH 值降低,色度和COD 浓度升高,使地表水水质显著降低[4]。
水体泛黑主要原因有:①浮游藻类大量聚集;②Fe,Mn 等金属元素在缺氧环境下形成黑色硫化物;③土壤中深色有机质(如腐殖酸)在长期淋溶作用下迁移进入水体[5-6]。研究发现,桉树叶释放出大量单宁酸和水库中的Fe,Mn 元素及底泥中硫化物发生一系列反应,生成黑色络合物使水库出现泛黑现象[7]。水体泛黑现象多发生在夏季,如2007年无锡太湖“黑水团”事件[8],这主要是因为夏季高温藻类疯长,导致水体缺氧而生成硫化物沉淀;也有部分水体泛黑现象发生在秋、冬季,如广西桉树种植区那降水库、天雹水库及百合水库[9]等,这与水温分层阻碍金属离子迁移,秋冬、季节水温分层结构失稳而导致黑水滞后有关。由于水源型水库有一定的深度,导致水库水体出现季节性水质变化现象,因此水体泛黑现象也出现季节性变化。
通过模拟硫化物存在情况下,考察pH 值、温度、离子强度等因素对体系中单宁酸及Fe3+,Mn2+相互作用的影响,探讨单宁酸,Fe,Mn 形态的分布特征及结合机制,以期对水库保护及防止水库翻黑水现象提供一定的理论依据。
1 材料与方法
1.1 试剂与仪器
主要试剂:Na2S,单宁酸,FeCl3,MnCl2·4H2O,NaCl,均为分析纯。
主要仪器:离心机、紫外分光光度计、冷冻干燥仪、傅里叶变换红外光谱仪、高效液相色谱仪、可见分光光度计、恒温振荡箱。
1.2 试验方法与步骤
将一定量的单宁酸、Na2S 倒入离心管中,再分别加入FeCl3和MnCl2·4H2O,先用HCl 和NaOH 调节其初始pH 值,随后将离心管放入恒温振荡器中振荡(转速为150 r/min,时间为24 h),再取出测量溶液的Zeta 电位,并取一定体积的液体离心(转速为3 000 r/min,时间为15 min)后,经0.45 μm 的滤膜过滤,再分别采用高效液相色谱法[10]邻菲罗琳分光光度法[11]和高碘酸钾分光光度法[12]测定溶液中单宁酸、Fe3+和Mn2+浓度。
2 分析单因素(pH 值、温度、离子强度) 对单宁酸与Fe,Mn 形态的影响
2.1 pH 值
控制体系中单宁酸质量浓度为20 mg/L,Fe3+,Mn2+的质量浓度均为10 mg/L,离子强度(以不同浓度的NaCl 涪液代表反应体系的离子强度):体系中NaCl 浓度为0.1 mol/L,初始pH 值分别设置在2~10范围内,其他步骤同1.2。
2.2 温度
控制体系中单宁酸质量浓度为20 mg/L,初始pH 值为7.0,离子强度:体系中NaCl 浓度为0.1 mol/L,试验设置6 种金属质量浓度梯度分别为0,3.3,6.6,9.9,13.2,16.5 mg/L,温度分别设置为15,25,35 ℃,其他步骤同1.2。
2.3 离子强度
控制体系中单宁酸质量浓度为20 mg/L,初始pH 值为7.0,温度为25 ℃,试验设置6 种金属质量浓度梯度分别为0,3.3,6.6,9.9,13.2,16.5 mg/L,离子强度:体系中NaCl 浓度分别设置为0,0.01,0.1,1 mol/L,其他步骤同1.2。
3 络合物的红外光谱测定
将200 mg 干燥的KBr 和5 mg 络合物样品(烘干)磨细混匀后进行压片处理[13],设定扫描范围为400~4 000 cm-1进行红外扫描。
4 结果与讨论
(1)pH 值对体系中单宁酸与Fe,Mn 形态的影响
pH 值对Fe3+,Mn2+体系中单宁酸形态的影响见图1。由图1可以看出,当pH 值在2~6 时,在Fe3+,Mn2+体系中溶解态单宁酸的占比均随pH 值的增大而逐渐降低;当pH 值>6 时,体系中溶解态单宁酸的占比保持在一个相对平稳的状态。研究发现,单宁酸的酚羟基随着pH 值的增加逐渐发生去质子化反应,当pH 值>11 时,单宁酸的2 个酚羟基均离解成氧负离子,离解后的氧负离子与金属离子发生络合反应[14]。当体系中pH 值较低时,溶液中H+浓度较高,抑制了单宁酸酚羟基的电离,不利于单宁酸与Fe3+,Mn2+的络合,此时体系中溶解态单宁酸的占比较高。随着溶液pH 值不断增大,酚羟基电离程度加大,有利于单宁酸与Fe3+,Mn2+的络合,导致体系中溶解态单宁酸的占比下降。当体系环境为中性或碱性时,溶液中部分S2-会和单宁酸竞争络合Fe3+,Mn2+,但S2-含量极低,单宁酸分子在pH 值较高时容易失去酚氧基配体而氧化成醌,不利于金属离子的络合[15],导致体系中溶解态单宁酸的占比保持在一个相对平稳的状态。
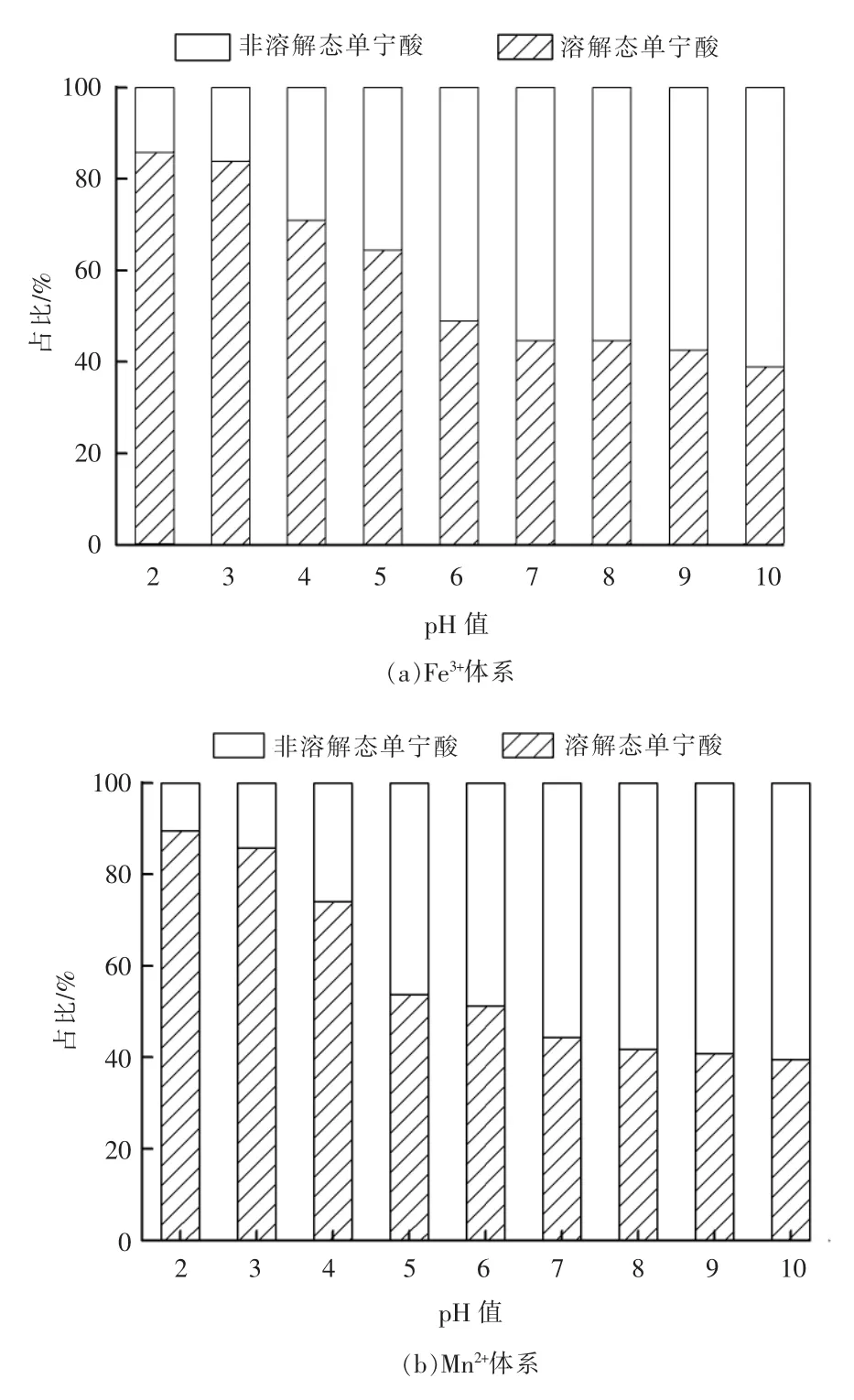
图1 pH 值对Fe3+,Mn2+体系中单宁酸形态的影响
pH 值对体系中Fe3+,Mn2+含量及其占比的影响见图2。由图2可以看出,体系中Fe3+,Mn2+的浓度及其占比均随着pH 值的增大而逐渐降低。对比Fe3+和Mn2+体系可知,在pH 值相同情况下,Mn2+含量均比Fe3+高,是由于Fe3+与单宁酸的络合稳定常数比Mn2+与单宁酸络合稳定常数更大,且根据尔文-威廉姆士规则:Fe3+与单宁酸络合的稳定性也比Mn2+高。当反应体系的pH 值较低时,单宁酸与溶液中大量H+发生酸效应,减少了与Fe3+,Mn2+络合的可能,故溶液中Fe3+,Mn2+浓度及占比较高。随着反应体系的pH 值升高,单宁酸的酸效应减弱,而OH-含量却增多[16],此时,Fe3+和Mn2+不仅与单宁酸发生络合,也会水解生成Fe(OH)3,Mn(OH)2沉淀使得总Fe3+,Mn2+的浓度迅速降低。同时体系中S 元素在pH值为5~12 时有很少一部分以S2-形式存在[17],S2-与金属离子结合形成硫化物沉淀,进一步降低了Fe3+,Mn2+的浓度。
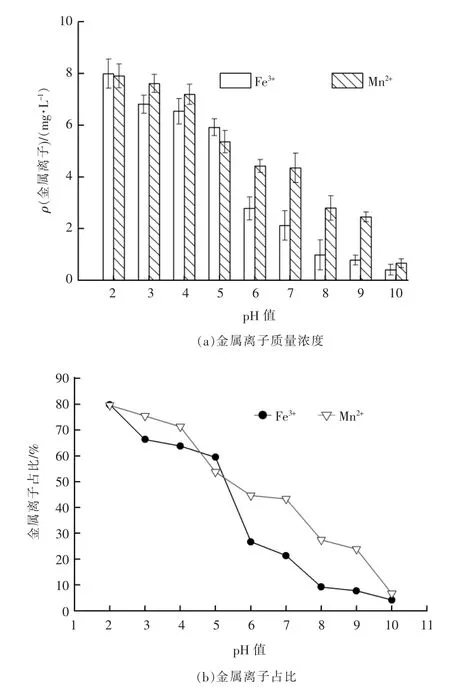
图2 pH 值对体系中金属离子质量浓度及其占比的影响
(2)pH 值对体系Zeta 电位的影响
反应体系的Zeta 电位随pH 值变化趋势见图3。Fe3+,Mn2+体系的Zeta 电位均随着pH 值的增大而下降,其中Fe3+反应体系的Zeta 电位从-11.5 mV 降至-24.7 mV,Mn2+反应体系的Zeta 电位从-11.2 mV降至-27.5 mV。研究表明,单宁酸的酚羟基随着pH值的增加不断离解成氧负离子[14],使溶液中负电荷增多,Zeta 电位不断降低。此外,体系中S 元素在pH值>5 时以HS-的形式存在,进一步使体系的Zeta电位降低。
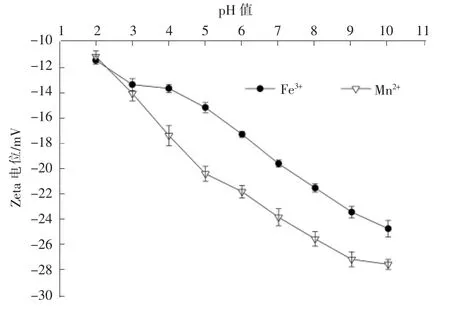
图3 pH 值对体系Zeta 电位的影响
(3)温度对体系中单宁酸与Fe,Mn 形态的影响
体系中溶解态单宁酸的占比随温度变化见图4。由图4可以看出,随着温度的升高,Fe3+和Mn2+体系中溶解态单宁酸的占比均逐渐降低。苏小宝[18]研究发现温度升高有助于单宁酸电离,促使单宁酸与Fe3+,Mn2+形成络合物,导致溶解态单宁酸的占比降低。这与那降水库8月水温出现分层,表层(水温高)单宁酸含量比底部(水温低)含量低的现象相吻合[9]。
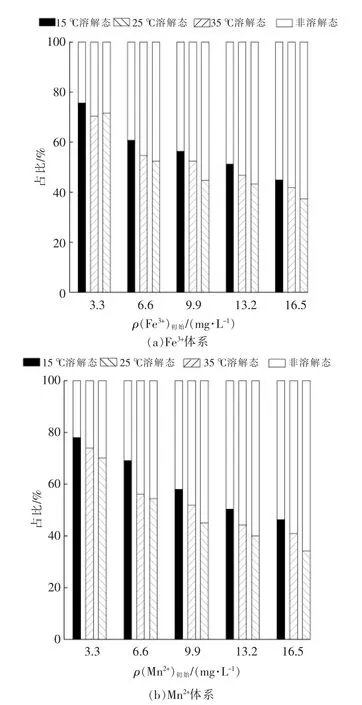
图4 温度对Fe3+,Mn2+体系中单宁酸形态的影响
温度对体系中金属离子浓度及其占比的影响见图5。由图5可以看出,体系中Fe3+,Mn2+浓度及其占比随反应温度的升高而降低。在单宁酸-铁-硫体系中,初始Fe3+质量浓度为3.3 mg/L 时,体系中Fe3+的质量浓度从0.47 mg/L(15℃)降至0.36 mg/L(35℃);在单宁酸-锰-硫体系中,初始Mn2+质量浓度为3.3 mg/L时,体系中的质量浓度从1.17 mg/L(15℃)降至0.58 mg/L(35℃)。研究表明,升温更有利于单宁酸的解离,从而有利于单宁酸与重金属的络合[23],使得体系中Fe3+,Mn2+浓度降低。温度升高也会使离子活度增加,有利于单宁酸和Fe3+,Mn2+的结合。同时随着温度的升高,Fe3+和Mn2+的水解程度也会增大,导致反应体系中Fe3+,Mn2+浓度进一步降低。
(4)温度对体系Zeta 电位的影响
温度对体系Zeta 电位的影响见图6。由图6可以看出,溶液的Zeta 电位值随温度升高而不断下降。在Fe3+体系中,初始Fe3+质量浓度为3.3 mg/L 时,溶液Zeta 电位值从-22.3 mV(15 ℃)降至-36.2 mV(35 ℃);在Mn2+体系中,初始Mn2+质量浓度为3.3 mg/L 时,溶液Zeta 值从-20.4 mV(15 ℃)降至-35.7 mV(35 ℃)。体系中带电粒子的布朗运动随着温度升高而加快,带电粒子之间的碰撞更加频繁,导致电荷相互转移而逐渐失稳,因此体系中的Zeta 电位随温度升高而下降。
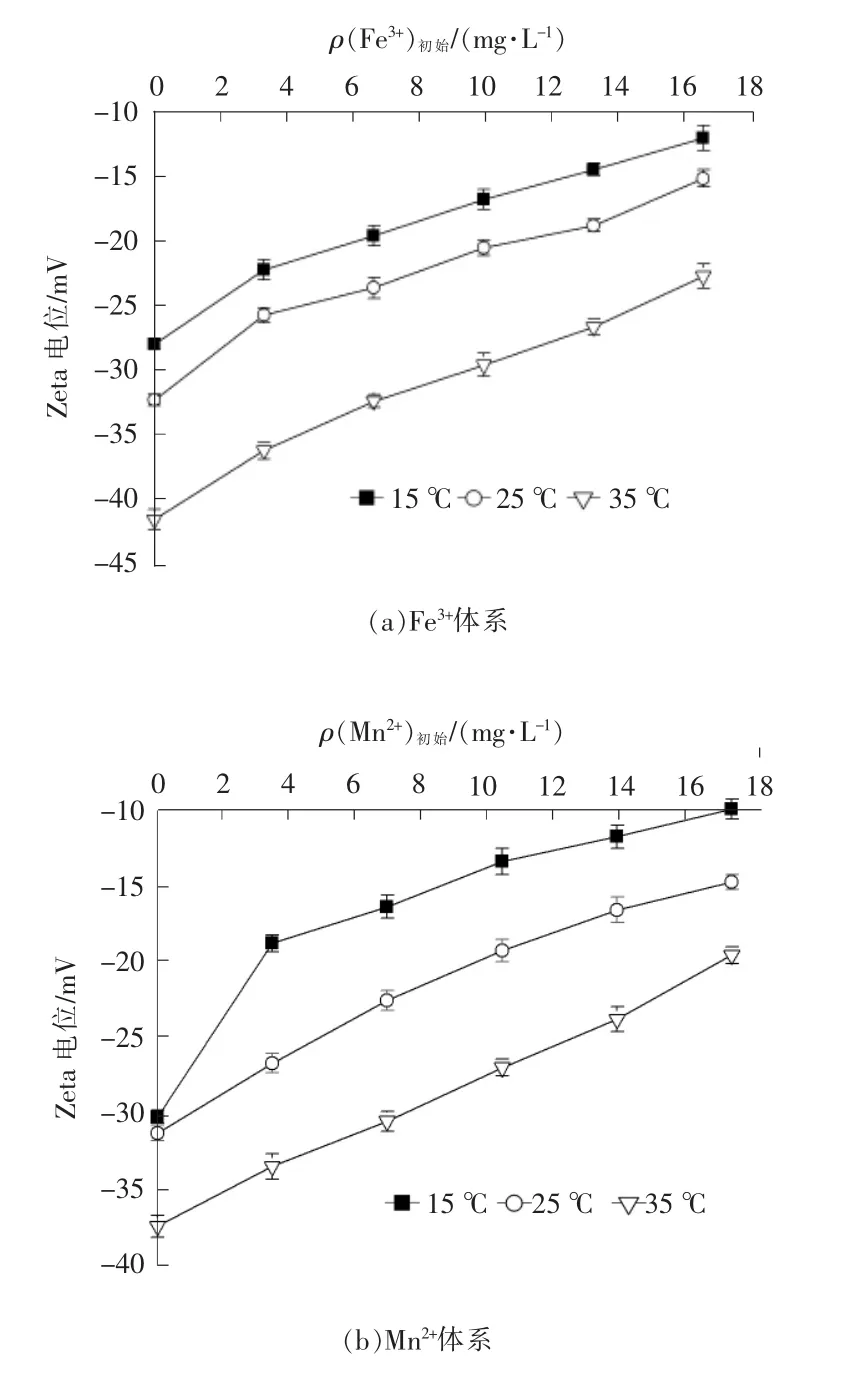
图6 温度对体系Zeta 电位的影响
(5)离子强度对体系中单宁酸与Fe,Mn 形态的影响
离子强度对体系中溶解态单宁酸占比的影响见图7。由图7可以看出,离子强度对单宁酸形态的影响较小。在初始条件相同的情况下,体系中NaCl 浓度为0.1 mol/L 时,溶解态单宁酸占比最低,但有利于单宁酸与Fe3+,Mn2+的络合,过低或过高的离子强度都不利于单宁酸与金属离子形成络合物。这与王强的研究结果相似[19]。
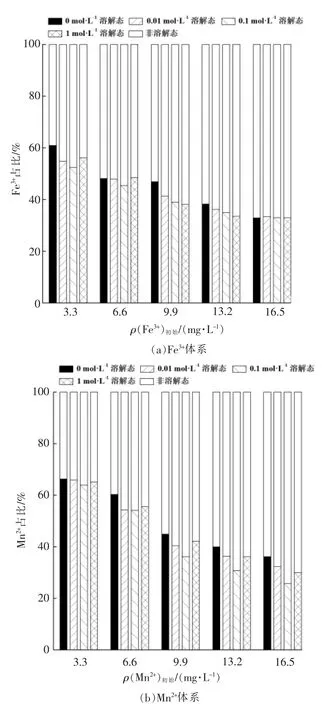
图7 离子强度对体系中单宁酸形态的影响
离子强度对体系中金属离子浓度及其占比的影响见图8。由图8可以看出,反应体系中NaCl 浓度在0~0.1 mol/L 时,离子强度越高,金属离子浓度及其占比越低。而当体系中NaCl 浓度为1 mol/L 时,金属离子浓度及其占比反而增大。原因是当体系中NaCl 浓度为0~0.1 mol/L 时,随着电解质浓度的增加,引起水界面双电层压缩作用,分子间缔合能力增强,单宁酸络合Fe3+,Mn2+的能力增强,从而导致体系中金属离子浓度的下降。当体系中NaCl 浓度大于0.1 mol/L 时,不仅使得Fe3+,Mn2+活度减小,同时溶液中Na+浓度的增加,与单宁酸的酸性基团发生电性中和,占据络合位点,导致体系中Fe3+,Mn2+的浓度增大。当体系中NaCl 浓度为1 mol/L 时,溶液中大量的Cl-也可能与Fe3+,Mn2+离子配位,影响单宁酸和S2-对金属离子的络合作用[19],从而导致Fe3+,Mn2+浓度增加。

图8 离子强度对体系中金属离子浓度及其占比的影响
(6)离子强度对体系Zeta 电位的影响
离子强度对体系Zeta 电位的影响见图9。由图9可以看出,溶液的Zeta 电位值随着反应体系离子强度的增强而逐渐增大,可能是由于电解质的加入抑制了单宁酸酚羟基的解离,导致单宁酸粒子的聚合度增加,溶液中负电荷变少。当离子强度增强时,Na+会通过静电引力作用中和溶液中的负电荷[20]。同时,溶液中Na+会与Fe3+,Mn2+竞争结合位点,影响单宁酸与Fe3+,Mn2+的络合,溶液中更多的正电荷导致Zeta 电位值增加。
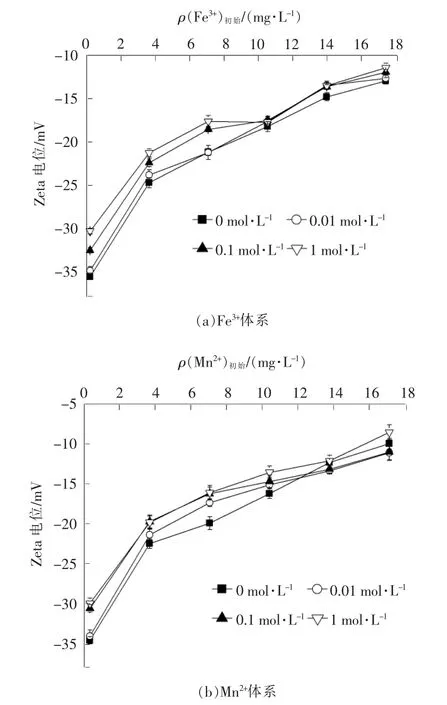
图9 离子强度对体系Zeta 电位的影响
(7)络合物的红外光谱图像分析
单宁酸-铁/锰(TA-Fe/Mn) 和单宁酸-铁/锰-硫(TA-Fe/Mn-S) 络合物的红外光谱见图10。由图10可以看出,4 种物质均在3 436 cm-1附近有峰形较宽的吸收峰,这是-OH 的缔合造成的[18]。在1 620 cm-1处的吸收峰主要是由O-H 的伸缩振动引起的,表明4 种物质均含酚羟基[21]。1 375 cm-1处的吸收峰主要由C-H 键伸缩振动引起的[22],Fe3+与酚羟基之间的相互作用对单宁酸中的C-H 键伸缩振动产生影响。1 126 cm-1处的吸收峰主要是由于C-O 伸缩振动引起的,在1 030 cm-1左右的吸收峰主要是C=O伸缩振动引起的[23]。在580~620 cm-1之间的吸收峰是由Fe-O 和Mn-O 键的振动引起的[24],表明Fe3+和Mn2+与单宁酸的酚羟基发生螯合作用。由此说明,单宁酸和Fe3+,Mn2+之间的相互作用主要是O-H,CH,C-O,C=O,Fe-O 和Mn-O 键之间的反应。
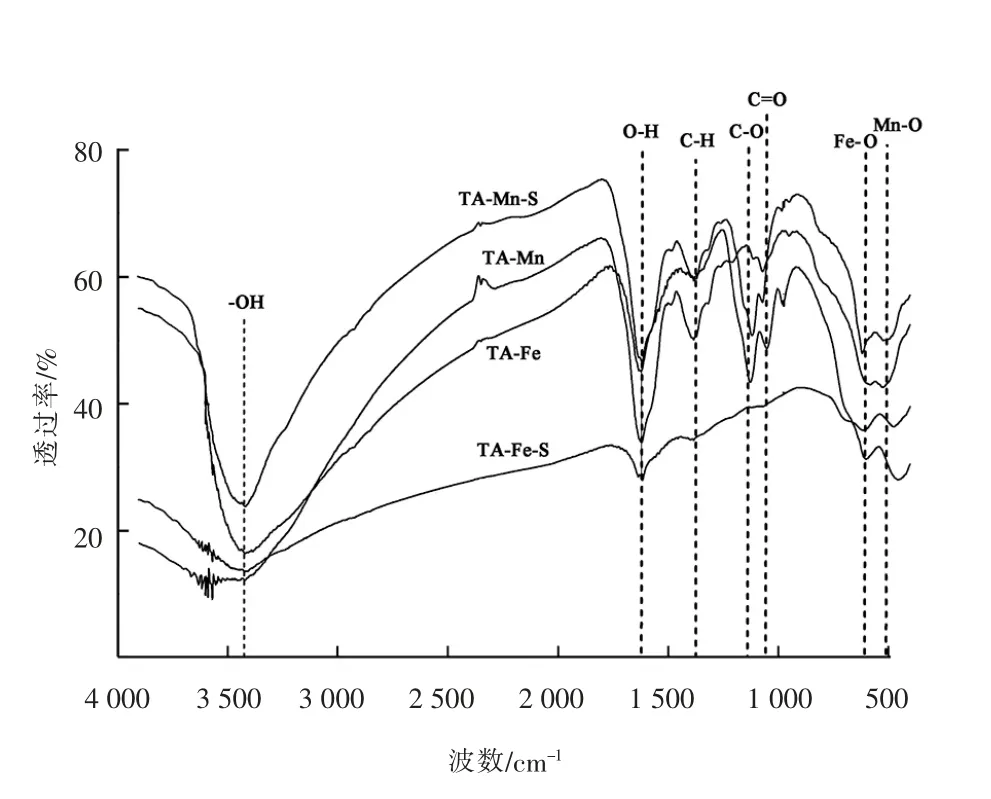
图10 络合物的红外光谱图像
5 结论
(1)水库泛黑现象与单宁酸和Fe3+,Mn2+,硫化物和Fe3+,Mn2+形成的黑色络合物有关,体系的pH 值、温度、离子强度均会对络合反应产生一定影响,其中pH 值对络合反应的影响最大。
(2)pH 值和温度的增加均有利于络合反应的进行,体系中溶解态单宁酸和Fe3+,Mn2+的浓度及其占比逐渐降低,而离子强度对络合反应的影响比较小,体系中NaCl 浓度为0.1 mol/L 时最有利于络合反应的进行。
(3)络合物的红外谱图表明主要的吸收峰为-OH,C-H,C=O,Fe-O 和Mn-O 官能团,络合物主要是Fe3+和Mn2+与单宁酸的酚羟基发生螯合作用形成的。
