ω3多不饱和脂肪酸的临床应用
2021-12-28孙贺伟杜会博刘学英赵自刚
孙贺伟 杜会博 刘学英 赵自刚
ω3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω3-PUFAs)是人体必需的脂肪酸,在人体中不能大量合成,须从食物中获取。α亚麻酸(α-linolenic acid,ALA)、二十碳五烯酸(eieosapentaenoic acid,EPA)、二十二碳六烯酸(dueosahexenoie acid,DHA)是ω3-PUFAs的3种重要成分。通常,ALA可从食物中摄取,存在于绿叶蔬菜、核桃、大豆、菜籽油等食物中。EPA和DHA来源于鱼类,例如三文鱼,摄入鱼油可补充EPA和DHA;摄入的ALA也可以向EPA及DHA转换[1]。因ω3-PUFAs具有抑制如白细胞介素(interleukin,IL)-1、IL-6及肿瘤坏死因子(tumor necrosis factor,TNF)-α等炎性因子生成的作用,逐渐受到人们的关注,ω3-PUFAs不仅可以消除多种疾病发病的危险因素,而且在预防和治疗心血管疾病、神经系统疾病、骨代谢疾病、胰岛素抵抗、肿瘤方面具有潜在价值。本文综述ω3-PUFAs在心血管疾病、神经性疾病、骨代谢疾病、某些肿瘤治疗中的作用,以期进一步了解ω3-PUFAs的药理学作用,为拓展ω3-PUFAs的临床应用提供基础。
一、ω3-PUFAs的心血管保护作用
慢性炎症被认为是包括心血管疾病在内的诸多慢性疾病的原因或风险因素。食物中的ω3-PUFAs,尤其是EPA和DHA,具有抗炎和降低氧化应激的作用。饮食摄入ω3-PUFAs的量与氧化应激及炎性反应降低的标志物间有一定关联,因此,认为ω3-PUFAs是调节炎性反应的重要物质[2]。研究表明,ω3-PUFAs对慢性炎性反应、冠状动脉粥样硬化、高血压、高血脂、血流动力学异常等心血管疾病均有一定的治疗作用,可减少致命性心血管事件(如心房颤动)的发生;EPA和DHA可降低再复发冠状动脉事件的发生风险,减少突发心脏病、急性心肌梗死后突发心脏死亡、心力衰竭、脑卒中事件的发生[3]。为此,美国心脏病协会建议患有冠心病的患者每天至少服用DHA+EPA 130mg。
目前建议ω6-PUFAs与ω3-PUFAs摄入的比率大约是1∶1,但实际摄入比值在15.0∶1~16.7∶1之间。有证据表明,ω6-PUFAs与ω3-PUFAs摄入比率降低有利于减少心血管疾病以及其他慢性病的发病风险,二者摄入比率升高可提高炎性反应发生率[4]。因此,在日常饮食中应考虑增加富含ω3-PUFAs的食物,如各种蔬菜、水果、坚果、深海鱼、植物油等。循环血中的炎症标志物如C反应蛋白(C-reactive protein,CRP)、TNF-α、IL-6水平与心血管事件的发生呈正相关。炎症标志物IL-6导致肝脏中CRP合成增多,CRP上升水平与心血管疾病发病因素增多存在联系;应用EPA和DHA治疗心血管疾病可明显降低CRP的升高程度[5]。对人的血样研究显示,EPA和DHA摄取可改变1040个基因表达的高低,可导致参与炎症和动脉粥样硬化形成的相关通路信号分子的基因表达下降,如:核转录因子(nuclear factor,NF)-κB通路、类花生酸的合成、清道夫受体的活性、脂肪生成、缺氧通路,研究表明EPA和DHA与上述炎性反应信号通路的基因表达下降有关[6]。
高血脂是冠状动脉粥样硬化形成以及心脑血管疾病发生的危重因素。研究显示,每天摄入ω3-PUFAs可明显降低血甘油三脂水平,也可轻微升高甘油三脂血症患者的高密度脂蛋白水平[7];ω3-PUFAs还可增加高密度脂蛋白和低密度脂蛋白比率,降低总胆固醇与高密度脂蛋白的比率,减少高血压、血栓形成、心肌梗死、心律失常的发病风险;EPA和DHA能改善动脉斑块的稳定性,降低血管内皮活化,改善血管通透性,减少心血管事件的发生。血浆脂蛋白A升高是冠状动脉疾病、脑血管疾病、动脉粥样硬化、血栓和脑卒中的一个危险因素,双盲随机对照研究表明,每天补充亚麻仁,连续补充10周后血清脂蛋白A浓度或水平降低14%[8]。ω3-PUFAs联合维生素E补充亦可降低患者的脂蛋白A浓度与血脂、氧化应激标志物水平[9]。动物实验也表明亚麻仁摄入可明显改善高胆固醇血症兔的动脉粥样硬化生成情况[10]。上述研究表明,ω3-PUFAs在冠状动脉粥样硬化形成和周围血管疾病中发挥重要作用。
自主神经系统的慢性失衡,交感神经活性升高或副交感神经活性降低,增加了主要心血管事件的危险因素和心律失常的发生率。EPA和DHA可能会升高大脑皮质乙酰胆碱水平,从而提高副交感活性及心率的变动,降低恶性心律失常和突发心脏死亡的发生率。横断面研究显示,饮食中高摄入ALA可以逆转心率失常的发生,且与男性和女性的QT和JT间期均呈现剂量关系。胆固醇喂养建立的高脂血症兔的QT间期延长,亚麻仁喂养缩短了高脂血症兔的QT间期,降低了心律失常的发生率[11]。ω3-PUFAs对心脏的直接作用表现在干预心肌细胞的离子通道,其代谢产物可抑制延迟整流钾离子通道、快速电压依赖性钠离子通道和L型钙离子通道,降低潜在心律失常风险与心血管不良事件[12]。
此外,ω3-PUFAs作用于膜磷脂和环氧化酶脂氧化酶复合物,引起血小板活性降低,从而发挥抗血小板活化作用,减少血栓形成[13, 14]。也有研究显示ω3-PUFAs可以改善心肌细胞的结构和功能,改善心肌细胞动作电位,从而对心力衰竭具有潜在的预防和治疗作用[15]。
二、ω3-PUFAs的神经保护作用
神经细胞膜上含有丰富的DHA,占神经细胞膜磷脂脂肪酸成分的60%;细胞膜上DHA通过磷脂酶释放的衍生分子例如神经保护素D1、消退素对神经细胞发挥保护作用,提升Bcl-2家族抗凋亡蛋白的水平以及抗炎作用。DHA可改变神经元细胞的膜结构,通过磷酸肌醇、甘油二脂和蛋白激酶C调节细胞信号转导,通过调节电压依赖性钙离子通道改变细胞外钙离子浓度,减少半胱天冬酶(caspase)介导的凋亡,亦可通过神经DHA代谢产物的特定靶受体抑制促炎基因表达,从而减弱脂多糖诱导的神经炎性反应,减少乙醇对神经干细胞神经源性分化的有害影响[16]。DHA可以在细胞膜水平上改善血-脑脊液屏障的功能,其机制与调节膜流动性变化、改变膜受体表达(例如视紫红质)、调节膜结合酶的活性、离子通道、多巴胺能受体介导的神经传递有关;还可在细胞水平上阻止神经细胞凋亡,刺激PC-12细胞长出神经突触,提高突触的传导功能,调节神经生长因子,影响神经元的大小[17]。ω3-PUFAs、DHA在神经退行性疾病中的治疗作用已得到认可。因此,在每天摄入DHA 60~80mg的基础上,专家建议每天增加摄入DHA 200~300mg,有利于降低神经退行性病变的发生。此外,在孕期补充亚麻酸有利于提高子代脑内DHA水平,提高记忆能力。
流行病学研究表明,摄入高剂量的ω3-PUFAs可以降低帕金森病的发病危险;饮食摄入的不饱和脂肪酸被饱和脂肪酸代替时,帕金森病发病的危险因素上升;同样,长期食用鱼油、水果、蔬菜则降低了帕金森病的发病危险,长期摄入ω3-PUFAs亦能减少帕金森病并发症的发生[18]。近年来,肠道微生物态变化在帕金森病发病过程中的作用受到关注,但不同菌群引起的后果不同,肠内外营养补充ω3-PUFAs是否能通过改善肠道微生物态发挥神经保护作用值得研究[19]。
三、ω3-PUFAs调节骨代谢的作用
饮食中的脂肪成分可能对骨成长产生影响。长链多不饱和脂肪酸尤其是ω3-PUFAs,抑制破骨细胞的生长,能够增加骨的形成,抑制骨的再吸收,减少骨的丢失,对骨质疏松有良好的干预作用[20];相反,ω3-PUFAs摄入过少可能会引发骨质疏松症,给切除卵巢小鼠补充富含ω3-PUFAs食物可以减少骨钙的丢失,有利于骨的生成[21]。可见,ω3-PUFAs的成骨作用与骨骼生长有着密切联系,适量补充ω3-PUFAs对骨骼健康很有益处。
前列腺素E2(prostaglandin E2,PGE2)介导炎性因子抑制软骨细胞增殖、诱导软骨细胞降解;PGE2产生过多可加剧炎性反应,导致关节软骨蛋白多聚糖的丢失及类风湿关节炎的发生;ω3-PUFAs调节骨代谢的机制与减少PGE2释放以及降低重要的破骨细胞分化因子和NF-κB配体活化受体的表达有关[22]。增加ω3-PUFAs的摄入可抑制ω6-PUFAs活化环氧化酶(cyclooxygenase,COX)-2释放PGE2,从而抑制PGE2引发的炎性反应;选择性应用COX-2抑制剂可以有效缓解骨关节炎和类风湿症状,提示类花生酸参与上述骨关节疾病的炎性反应过程;补充含有EPA和DHA的鱼油亦可抑制软骨组织中IL-1、IL-2、TNF-α的合成[23]。此外,ω3-PUFAs还可通过调节促炎性细胞因子的表达,促进胰岛素样生长因子(insulin like growth factor,IGF)-1产生,提高钙在骨骼上的沉积[24]。可见,ω3-PUFAs调节骨代谢的作用是通过抗炎机制实现的。
ω6-PUFAs与ω3-PUFAs比率的变化也会影响骨代谢。富含ω6-PUFAs的饮食导致细胞膜上ω6-PUFAs与ω3-PUFAs比率的升高,增加IL-1、IL-6、TNF-α等炎性细胞因子的含量,不仅能引起一系列的心血管问题,还能升高骨髓中脂肪细胞的数量,促进骨髓间充质干细胞向脂肪细胞的分化,抑制其向成骨细胞的分化。因此,高ω6-PUFAs饮食对骨代谢会产生消极影响。
四、ω3-PUFAs的抗肿瘤作用
ω3-PUFAs对肿瘤的治疗作用也受到关注。研究发现,ω3-PUFAs可通过诱导细胞凋亡和自噬抑制恶性胶质细胞瘤细胞的生长,DHA亦可通过活化单磷酸腺苷依赖的蛋白激酶、抑制3磷酸肌醇激酶/蛋白激酶B信号通路,从而抑制雷帕霉素靶位引起细胞自噬,降低人非小细胞肺癌细胞的生长,DHA和EPA均能够有效抑制食管癌细胞的增殖,上调caspase-3和Bax表达,抑制Bcl-2表达,从而诱导食管癌细胞凋亡[25~27]。临床资料显示,应用ω-3 PUFAs进行肠内营养干预,可明显降低胃癌术后患者血清CRP水平,提高维生素B12浓度、体重、体重指数,提高生活质量评分[28]。给予ω-3 PUFAs肠外营养可明显改善结肠癌患者术后的白蛋白等营养指标以及免疫功能[29]。蛋白质组学分析发现,静脉注射ω-3 PUFAs抗胰腺腺癌的作用是通过抗炎、抑制血管新生、上调免疫补休系统功能实现的[30]。这些研究表明ω3-PUFAs对多种肿瘤均具有很好的抑瘤作用。
五、展 望
综上所述,ω3-PUFAs对心血管、神经、骨代谢等疾病均具有较好的治疗作用以及抗肿瘤作用,其机制涉及整体、细胞、分子不同层面,涉及抑制炎性反应、降低氧化应激、调节细胞凋亡等过程(图1)。同时也要注意,ω3-PUFAs极易氧化,过量摄入ω3-PUFAs,可消耗大量的抗氧化剂,导致机体的抗氧化能力降低,引起一系列的生理功能导演。因此要合理、科学饮食。
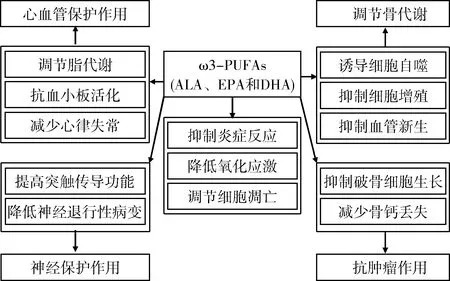
图1 ω3多不饱和脂肪酸(ω3-PUFAs)的作用与机制
由于ω3-PUFAs药理学作用的普遍性,因此要积极进行ω3-PUFAs防治难治性疾病的基础与临床研究,促使ω3-PUFAs的临床应用越来越广泛。随着蛋白质组学、基因组学、脂质代谢组学和分子生物学技术的发展以及多中心、大样本量、随机临床试验的开展,科研工作者将对ω3-PUFAs的药理学作用有更深入的了解,以明确ω3-PUFAs治疗多种疾病的作用机制,这将有利于进一步拓展ω3-PUFAs的临床应用,为一些难治性疾病的防治提供新思路。
