有机食葵仁样品中霉菌和酵母菌检测的重复性和实验室内再现性分析
2021-12-27卢福荣
高 阳,卢福荣
1.欧陆食品检测服务(大连)有限公司,辽宁 大连 116023;2.营口市食品药品检验检测中心,辽宁 营口 115000
霉菌和酵母菌是食品正常菌相的一部分,有些可用来加工食品,也可能导致食品腐败,影响食品质量。因此评价食品卫生质量的指示菌也包括霉菌和酵母,其计数结果可用来评判食品被污染的程度。目前国内外均规定了各种对霉菌和酵母菌的检测标准,其中平板计数法检测结果相对精准[1],故本试验采用国际标准(ISO 21527—2008)中平板计数法检测霉菌和酵母菌,并对检测结果的精密度进行统计分析。
精密度分析可用于定量方法方法确认,也可用于实验室内部质量监控。一个实验室内通过一个方法确认时所获得的质量指标包括重复性限(r)、重复性标准偏差(Sr)、重复性相对标准偏差(RSDr)、再现性限(R)、再现性标准偏差(SR)、再现性标准偏差(RSDR)[2]。本次试验采用GB/T 6379.2—2004规定的重复性计算方法和《食品微生物检测统计学》中的实验室内期间再现性(本试验采用不同分析人)推导方法对试验结果进行重复性和实验室内再现性统计分析,该实验室内期间再现性推导方法是由ISO TS 19036:2006/Amd 1:2009中提出的方法改进而来的。因此本试验所获得的相对标准偏差用于评定实验室内该方法确认结果,同时其重复性限和实验室内再现性限指标亦可为日后该检测方法的实验室内部质量控制评价提供依据。
1 材料与方法
1.1 材料
1.1.1菌种来源
白曲霉CICC 41312,由中国工业微生物菌种保藏管理中心提供。酿酒酵母ATCC 9763,由广东环凯微生物科技有限公司提供。
1.1.2培养基
DG18琼脂培养基;0.1%蛋白胨水(PW)。
1.1.3试剂与仪器
霉菌培养箱:(25±1)℃;恒温水浴锅:(46±1)℃;电子天平:分度值0.1 g;均质器;移液器;无菌培养皿:直径90 mm。
1.2 方法
1.2.1检测样品制备
本实验选择的样品基质为有机食葵仁(水活度<0.95),其自然污染水平小于10 CFU/g,使用人工污染样品方式,添加阳性菌种白曲霉和酿酒酵母。白曲霉阳性添加量为104~105CFU/25 g;酿酒酵母阳性添加量为105~106CFU/25 g。
因微生物检测行业标准中要求重复性的测定通常需要测定10个以上的测试样品[3],故本试验采用11个测试样品进行实验室内重复性和实验室内再现性试验。
1.2.2霉菌酵母菌检测方法
按照国际标准ISO 21527-2:2008 Microbiology of food and animal feeding stuffs — Horizontal method for the enumeration of yeasts and moulds — Part 2:Colony count technique in products with water activity less than or equal to 0,95 规定的倾注平板法检测程序进行。
检测过程为:
① 无菌称取25 g样品并加入225 mL PW,置于无菌均质袋内均质,用拍打式均质器拍打1 min,充分混合制成10-1初始稀释液。
② 取两块无菌平皿。用2 mL无菌吸管分别吸取 1 mL 样品的初始悬浮液(10-1稀释度)加到每块平皿中。
③ 用2 mL无菌吸管转移1.0 mL 10-1稀释溶液到9.0 mL无菌PW中,充分混合制得10-2稀释溶液。
④ 另取两块无菌平皿,用另一支无菌吸管,分别吸取 1 mL 10-2样品稀释液加到每块平皿中。
⑤ 另取一支新的2 mL无菌吸管,重复上述③操作,获得进一步稀释,本试验一直稀到10-5稀释度。每稀释一次即换用1支新的灭菌吸管。
⑥ 试验选取后4个连续的十倍稀释液接种到平皿中,以期获得生长菌落数小于150 CFU的平皿,以便计数。
⑦ 每块平皿倒入20 mL~25 mL冷却到 44 ℃~47 ℃的DG18琼脂,从制备好初始悬浮液(如果是液体样品为10-1稀释液)向平皿内倾倒琼脂,时间不得超过 45 min。
⑧ 采用顺时针逆时针各三圈、水平和左右方向各三次的方式,将接种液体与琼脂混合均匀,平皿放置在凉的水平面上待凝固[4]。
⑨ 将平皿正置于(25±1)℃的霉菌培养箱中,培养 5 d。
⑩ 菌落计数。选择菌落数少于150 CFU的培养皿计数,必要时使用双目放大镜或显微镜进行检查,以便区分酵母或霉菌和菌落中的细菌。
1.2.3重复性测量方案
1.2.3.1 重复性检测
由操作人员A或操作人员B对11份人工污染有机食葵仁样品进行霉菌和酵母菌计数试验,试验方案的描述如图1,即对1个实验室内一个操作人员对11个样品的1个污染水平取两次试验的用量,制备初级稀释液进行重复2次检测,共22次测试。具体检测方法按1.2.2 霉菌酵母菌检测方法进行。

图1 测算试验实验室内重复性的试验方案
1.2.3.2 重复性计算[5,6]
(1-1)
(1-2)
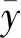
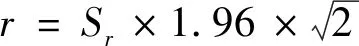
(1-3)
1.2.4再现性测量方案
1.2.4.1 再现性检测
由操作人员A和操作人员B分别对11份人工污染有机食葵仁样品进行霉菌和酵母菌计数试验,试验方案的描述如图2,即对1个实验室内每个操作人员对11个样品的1个污染水平取两次试验的用量,制备初级稀释液进行重复2次检测,共44次测试。具体检测方法按1.2.2 霉菌酵母菌检测方法进行。
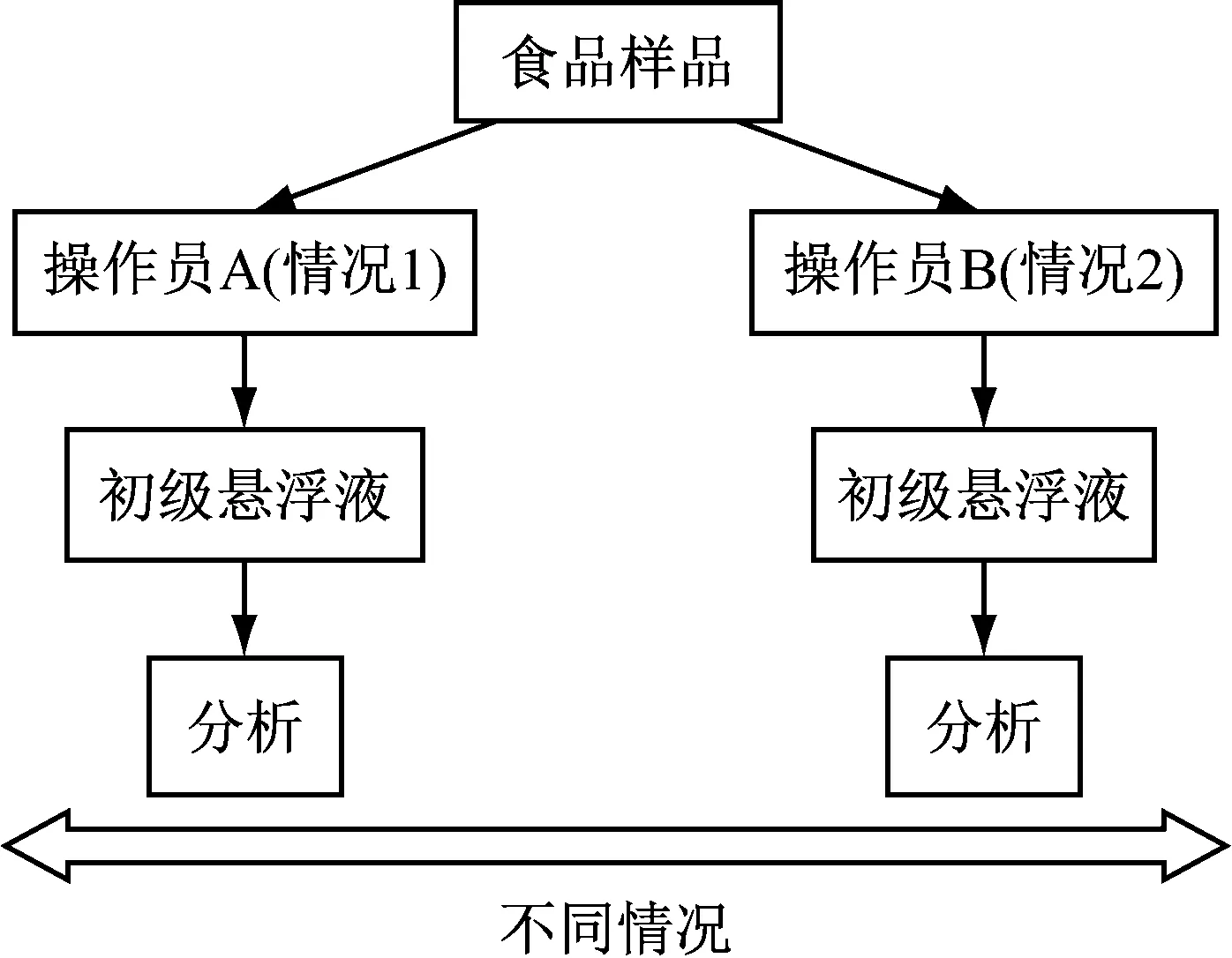
图2 测算试验实验室内再现性的试验方案
1.2.4.2 再现性计算[6-8]
实验室内再现性方差:
(2-1)
再现性标准偏差为独立数据集平均方差的平方根,将方差之和除以n,即:
(2-2)
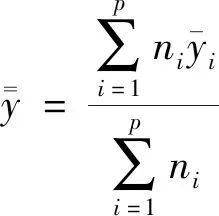
(2-3)
(2-4)
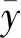
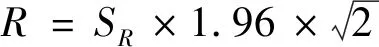
(2-5)
2 结果与讨论
2.1 结果
对两名操作人员A、B在同一天检测的11个人工污染有机食葵仁样品的霉菌和酵母菌计数结果进行归纳分析,详细计算数据分别见表1和表2。
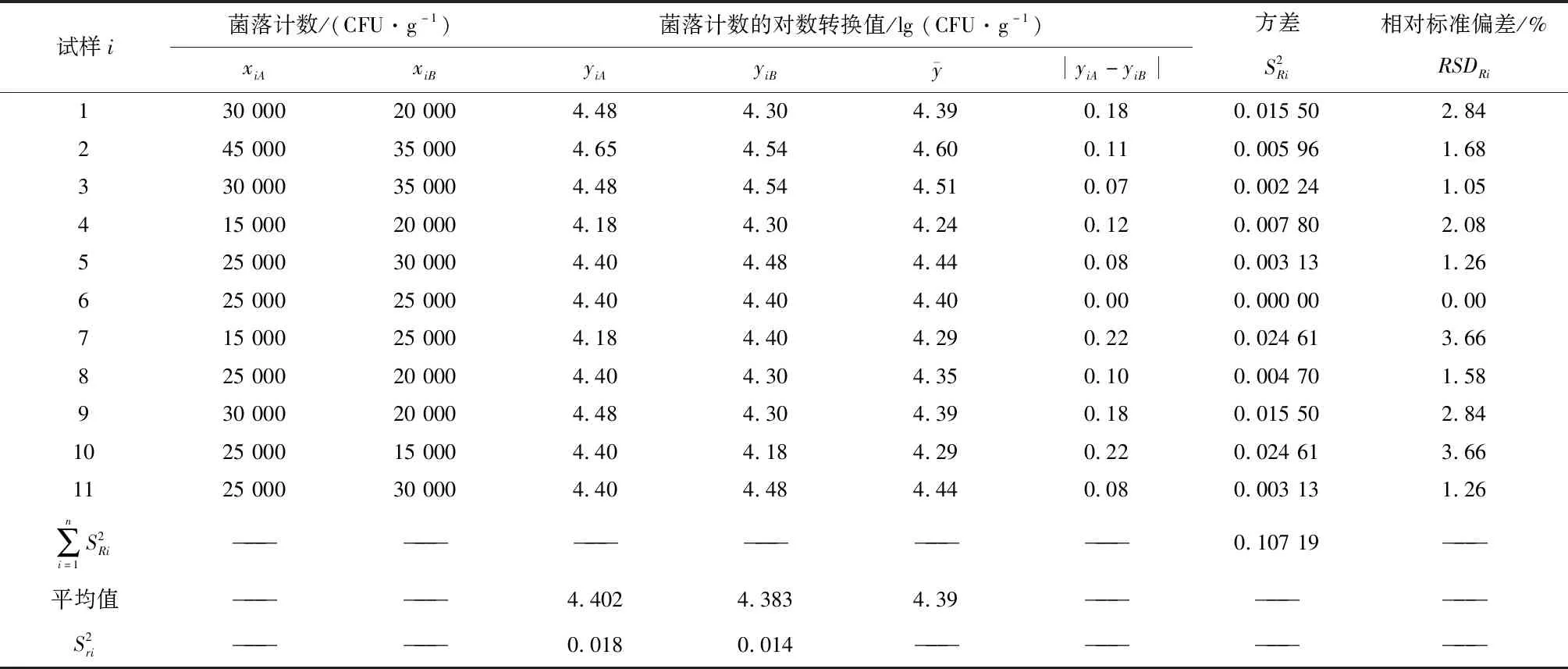
表1 11组霉菌计数数据对的重复性和实验室内再现性计算
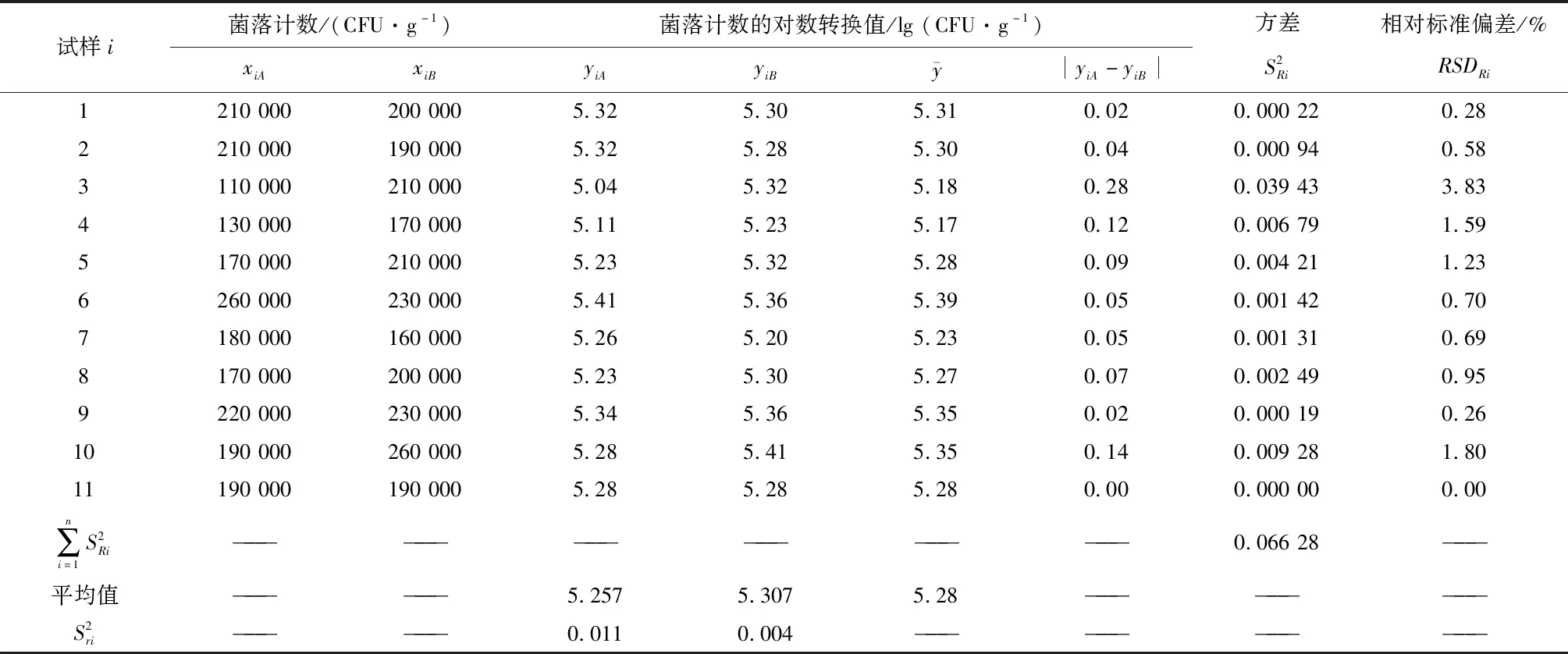
表2 11组酵母菌计数数据对的重复性和实验室内再现性计算
2.1.1重复性(Sr)
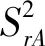
2.1.2重复性限(r)
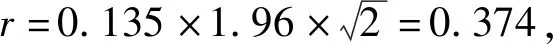
2.1.3再现性(SiR)
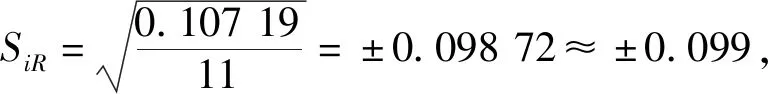
2.1.4实验室内再现性限(iR)
2.2 讨论
实验室内重复性是定量分析试验的精密度指标,指在相同的条件下(如:设备、操作者、实验室或培养时间)对同一个样品使用相同的方法分析获得的一系列独立测试结果之间的一致程度。再现性分为实验室间再现性和实验室内再现性。国际标准中指出实验室内再现性是指再现性条件下单个实验室对再现性的测量[9]。因此在试验中得出的相对标准偏差能够反映不同平均值的变异程度。结合霉菌和酵母菌的重复性相对标准偏差和再现性相对标准偏差结果,以表达本实验室该方法确认结果。本试验人工污染有机食葵仁的霉菌重复性相对标准偏差为3.07%和2.70%,内部再现性相对标准偏差为2.25%;酵母菌重复性相对标准偏差为2.00%和1.13%,内部再现性相对标准偏差为1.47%,结果均小于5%,表明本次试验结果没有显著性差异。
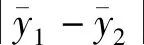
3 结论
本试验霉菌精密度检测结果:分析人A重复性SrA为0.135,重复性限r为0.374;分析人B霉菌重复性SrB为0.118,重复性限r为0.328。实验室内再现性SR=±0.099,再现性限R为0.274。
本实验酵母菌精密度检测结果:分析人A重复性SrA为0.105,重复性限r为0.291;分析人B重复性SrB为0.060,重复性限r为0.167。实验室内再现性SiR=±0.078,再现性限R为0.215。
