重组谷氨酰胺转胺酶突变体的表达、分离纯化及其催化应用
2021-12-27宋小平沈何放余银马若彤潘李娜
宋小平,沈何放,余银,马若彤,潘李娜
1(安徽医学高等专科学校 药学系,安徽 合肥,230061) 2(安徽省重组蛋白药物工程技术研究中心,安徽 合肥,230022)
谷氨酰胺转胺酶(transglutaminase,TG)能够催化蛋白质肽链中谷氨酰胺残基的γ-羧酰胺基与各种酰基受体发生酰基转移反应,是一种有效的蛋白质交联剂[1-3]。微生物谷氨酰胺转胺酶(microbial transglutaminase,MTG)具有低蛋白分子质量、非Ca2+依赖性和较广的底物范围等优点,在食品工业[4-6]、生物医药[7]、组织工程[7]、定点蛋白交联[8]和同源抗体偶联药物的构建等行业均具有广泛的应用价值[8-10]。近年来,通过分子进化获得更高活性和热稳定性的突变酶,并扩大其应用范围的研究一直受到国内外学者的密切关注。
我们在前期研究中,成功构建了一种5位点组合突变的毕赤酵母菌株pro/rDNA-mtg-mut2,其表达的重组酶MTG-MUT2为5个氨基酸组合突变体:S2P-S23V-Y24N-R215A-H289Y。MTG-MUT2比酶活力为(39.3±1.6) U/mg,是野生酶的2.4倍[野生酶(16.7±0.7) U/mg];最佳酶反应温度是55 ℃;50和60 ℃的半衰期分别为446.9和 27.6 min,分别是野生酶的11.7和10.2倍(野生酶在50和60 ℃的半衰期分别为38.5和2.7 min)。本研究首先通过高密度发酵获得粗酶液,分离纯化得到纯酶;并对该纯酶的3个组分进行分离,分析糖基化对酶活性的影响及其影响机制。然后,研究该纯酶催化氨基酸交联反应,旨在拓展重组酶MTG-MUT2的应用。
1 材料与方法
1.1 材料
1.1.1 菌株
毕赤酵母重组菌株pro/rDNA-mtg-mut2为本实验室构建并保藏。
1.1.2 仪器
AKTA Pure蛋白质层析纯化系统、Superdex 75 prep grade,GE公司;BWS465-785S拉曼光谱仪,美国必答泰克公司。实验用水为超纯水。
1.1.3 试剂与培养基
N-carboxybenzoyl-L-glutaminyl-glycine(N-CBZ-Gln-Gly)、L-谷氨酸-γ-单羟胺酸、牛血清蛋白,Sigma-Aldrich公司;还原型谷胱甘肽,华美生物工程有限公司;anti-MTG,Eurogentec公司;L-谷氨酰胺(纯度>99%),国药集团试剂有限公司;L-赖氨酸(纯度>99%),麦克林试剂公司。其他试剂均为国产分析纯。
毕赤酵母培养基:YPD、BMGY、BMMY,参照Invitrogen公司的操作手册配制,毕赤酵母培养温度28 ℃,诱导温度25 ℃[9-10]。
1.2 实验方法
1.2.1 pro/rDNA-mtg-mut2 的高密度发酵及纯化
高密度发酵在14 L发酵罐中进行。采用起始发酵体积为3 L的发酵体系,初始培养基组成:2.4 L BMGY(4%甘油)+300 mL YNB+300 mL PPB,发酵参数设定为:pH 6.0,生长温度28 ℃,搅拌转速800 r/min,通气量10 L/min。当罐内基础甘油用完后,溶氧会在短时间内上升,此时开始补加甘油,50%甘油(含12 ml/L PTM1)恒速补料25 mL/(L·h)。当菌体湿重达到(195±2)g/L时停止补甘油,开始补加100%甲醇诱导(甲醇含12 mL/L PTM1)。甲醇诱导采用3步补料(根据甲醇电极判断补料时间点),诱导温度调整为25 ℃。整个发酵过程中控制溶氧水平为25%~30%[9-11],诱导40 h。每8 h取样测定菌体湿重和酶活力,采用非还原SDS-PAGE检测,胶浓度10%,Western Blot鉴定目标蛋白,鉴定用抗体为anti-MTG。发酵产物的分离纯化采用His Trap HP组氨酸标记亲和层析法,操作步骤见参考文献[9-10]。纯化样品检测方法同上。
1.2.2 MTG-MUT2酶活力测定
异羟肟酸比色法测定MTG酶活力,按照参考文献[12-14]的方法进行。MTG酶活力定义为:在37 ℃下,MTG每分钟催化底物(N-CBZ-Gln-Gly)生成1 μmoL谷氨酸-单羟胺酸(氧肟酸)为1个酶活单位。蛋白浓度测定采用Bradford方法,标准蛋白为牛血清蛋白[13]。
1.2.3 糖基化对MTG-MUT2酶活性的影响
将1.2.2 所得纯化样品过分子筛(Superdex 75 prep grade),并在同一条件下测定这3个组分的酶活力,以探索糖基化对酶活性的影响,酶活力测定方法见1.2.2。流程为:平衡→上样→洗脱。PBS(pH 7.4)平衡分子筛,上样流速为2 mL/min,PBS洗脱,手动收集各个紫外峰组分,SDS-PAGE检测,胶浓度10%,每孔上样量2.5 μg,考马斯亮蓝R-250染色。
1.2.4 MTG-MUT2催化条件优化
为了进一步探讨MTG-MUT2对蛋白质中氨基酸的交联作用,以L-谷氨酰胺和L-赖氨酸作为底物,首先分析反应底物的配比对产物生成的影响。固定L-谷氨酰胺的浓度为300 mmol/L,L-赖氨酸与其的比例为A∶0.9、B∶1.0、C∶1.1、D∶1.2,在55 ℃、pH 6.5下反应2 h,比较谷赖二肽产量,确定2种底物最适合的添加比例。接着,研究L-谷氨酰胺的浓度分别为100、200、300、400、500、600 mmol/L时,L-赖氨酸和L-谷氨酰胺添加比例的最适比例,比较谷赖二肽产量。
1.2.5 MTG-MUT2催化产物的检测
采取柠檬酸钠还原法制备银纳米颗粒(Ag nanoparticles,AgNPs),Ag+被还原成直径为纳米级的AgNPs。具体制备依据文献[14-19]的方法进行制备。
将待测样品用PBS缓冲液(pH 7.2)稀释为100 μg/mL。取50 μL待测样本与50 μL修饰后的AgNPs混合后放入微量比色皿中进行表面增强拉曼散射光谱(surface enhanced Raman scattering,SERS)测试。激发波长为785 nm,积分时间5 ms,激光功率20 mW。数据采集及光谱处理均采用光谱仪自带软件。
2 实验结果
2.1 pro/rDNA-mtg-mut2在14 L发酵罐中的表达和纯化
典型的发酵曲线如图1-a所示,包括间歇培养、甘油进料和甲醇诱导阶段。在间歇培养阶段,酵母种子在含4%甘油(pH 6.0)的BMGY培养基中培养,28 ℃控制,持续17~18 h,当细胞湿重(wet cell weight,WCW)达到140 g/L,开始补甘油。在甘油补料阶段,补50%的甘油(含有12 mL/L PTM1溶液),将DO控制在30%,温度维持在28 ℃,至WCW达到约(195±2)g/L时,补料结束。当溶氧(dissolved oxygen,DO)出现急剧上升,开始甲醇诱导(100%甲醇,含12 mL/L PTM1),甲醇采取3步诱导:3.6、7.2和10.8 mL/(L·h),诱导过程DO保持在大约30%(图1-a)。甲醇诱导持续40 h,当酵母WCW达到约340~350 g/L时结束。在甲醇诱导的前32 h,MTG-MUT2的酶活力和表达逐渐增加(图1-b~图1-d);然而,诱导32 h后,MTG-MUT2酶活力和表达量增加不明显,发酵结束时,发酵上清液的最高酶活力为7.45 U/mL(图1-b)。
2.2 MTG-MUT2的纯化和SDS-PAGE分析
对pro/rDNA-mtg-mut2高密度发酵的70 h培养上清液进行1步镍柱亲和层析纯化,收集洗脱液215 mL。如表1所示,酶活力为12.3 U/mL,蛋白质量浓度274.3 μg/mL,蛋白纯化2.7倍,回收率为87.4%。SDS-PAGE结果如图2所示,重组MTG-MUT2有3条特异性蛋白带,分别为1条非糖基化条带和2条糖基化条带,大小为38 k~42 kDa,这与前期实验结果及文献报道的1~3条带的结果相一致[10-12]。
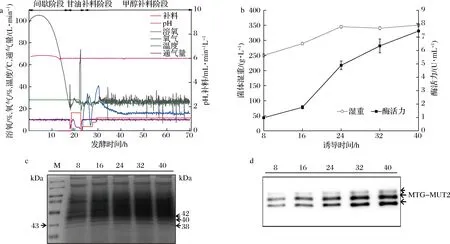
a-发酵曲线;b-不同诱导时间的生物量和酶活力;c-SDS-PAGE不同诱导时间发酵上清液;d-WB检测不同诱导时间发酵上清液图1 pro/rDNA-mtg-mut2高密度发酵过程的检测Fig.1 Parameters detected at different induction time of high-density pro/rDNA-mtg-mut2 fermentation

表1 重组MTG的纯化方案Table 1 Purification scheme of recombinant MTG-MUT2
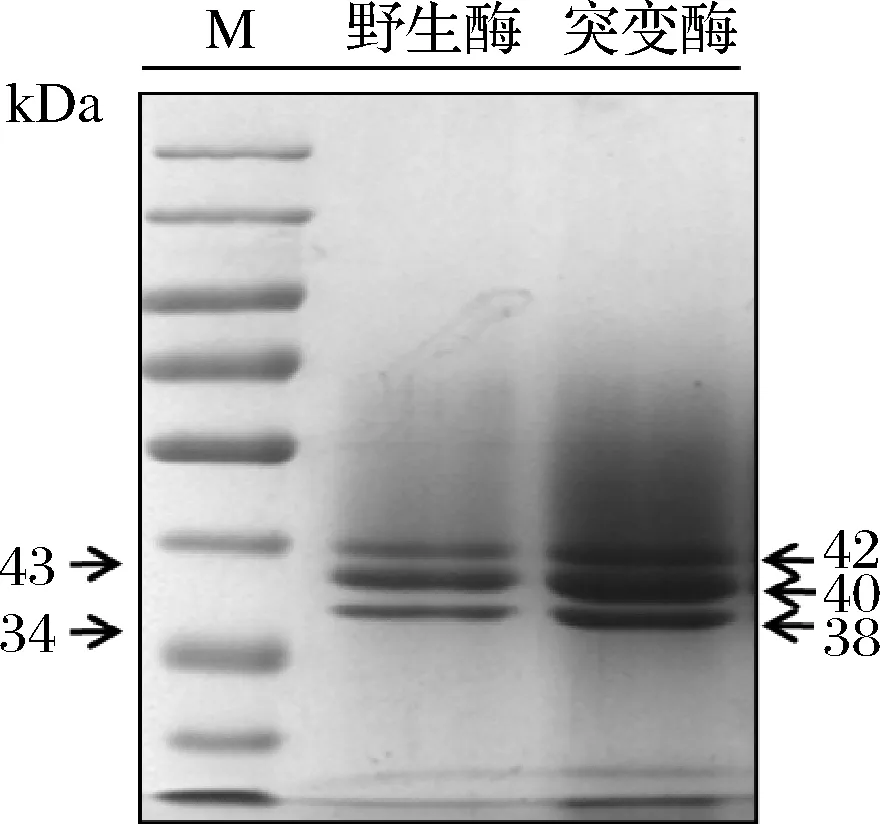
图2 SDS-PAGE检测纯化MTG-MUT2Fig.2 Detection of purified MTG-MUT2
2.3 糖基化对MTG-MUT2酶活性的影响
MTG-MUT2的3个组分分离结果如图3所示。与未分离蛋白条带比较,3条蛋白带的主带已分离,根据分子质量从大到小依次为42、40、38 kDa,但由于2条带表观分子质量相差只有约2 kDa,所以条带没有完全分开,但不影响后续酶活力的分析。以未分离酶作为对照,在同一条件下检测这3个组分(42、40、38 kDa)的酶活力,结果分别为:10.6、14.7和8.7 U/mL,40 kDa糖蛋(14.7 U/mL)是非糖基化酶(8.7 U/mL)的1.7倍;2个位点均发生糖基化的酶活力次之(10.6 U/mL),是非糖基化酶的1.2倍。

1,5-未过分子筛样品(不同批次);2~4-分离后的蛋白样品图3 MTG-MUT2分离后组分的SDS-PAGE检测Fig.3 Components seperated by MTG-MUT2 detected by SDS-PAGE
2.4 MUT2催化条件优化
固定谷氨酰胺的浓度为300 mmol/L,L-赖氨酸与其的比例为A∶0.9、B∶1.0、C∶1.1、D∶1.2,在55 ℃、pH 6.5下反应2 h,结果如图4所示(图中数据均为扣除基线和溶剂的峰)。拉曼光谱特征峰在298~2 000 cm-1,与Gln和Lys比较,Lys与Gln连接产物可能的峰在719、755、1 180、1 288、1 476、1 602 cm-1(图4)。其中719、755 cm-1主要是酰胺Ⅳ的CO面内弯曲所致,1 180 cm-1是NCαC骨架伸缩振动的特征峰,1 288 cm-1主要是酰胺Ⅲ中NH 面内弯曲引起的峰,因此1 288 cm-1可作为Gln的γ-羧酰胺基与Lys的酰基形成酰胺键(肽键)的重要指征,是2个氨基酸交联的重要依据,其峰强可反映谷赖二肽的生成量。
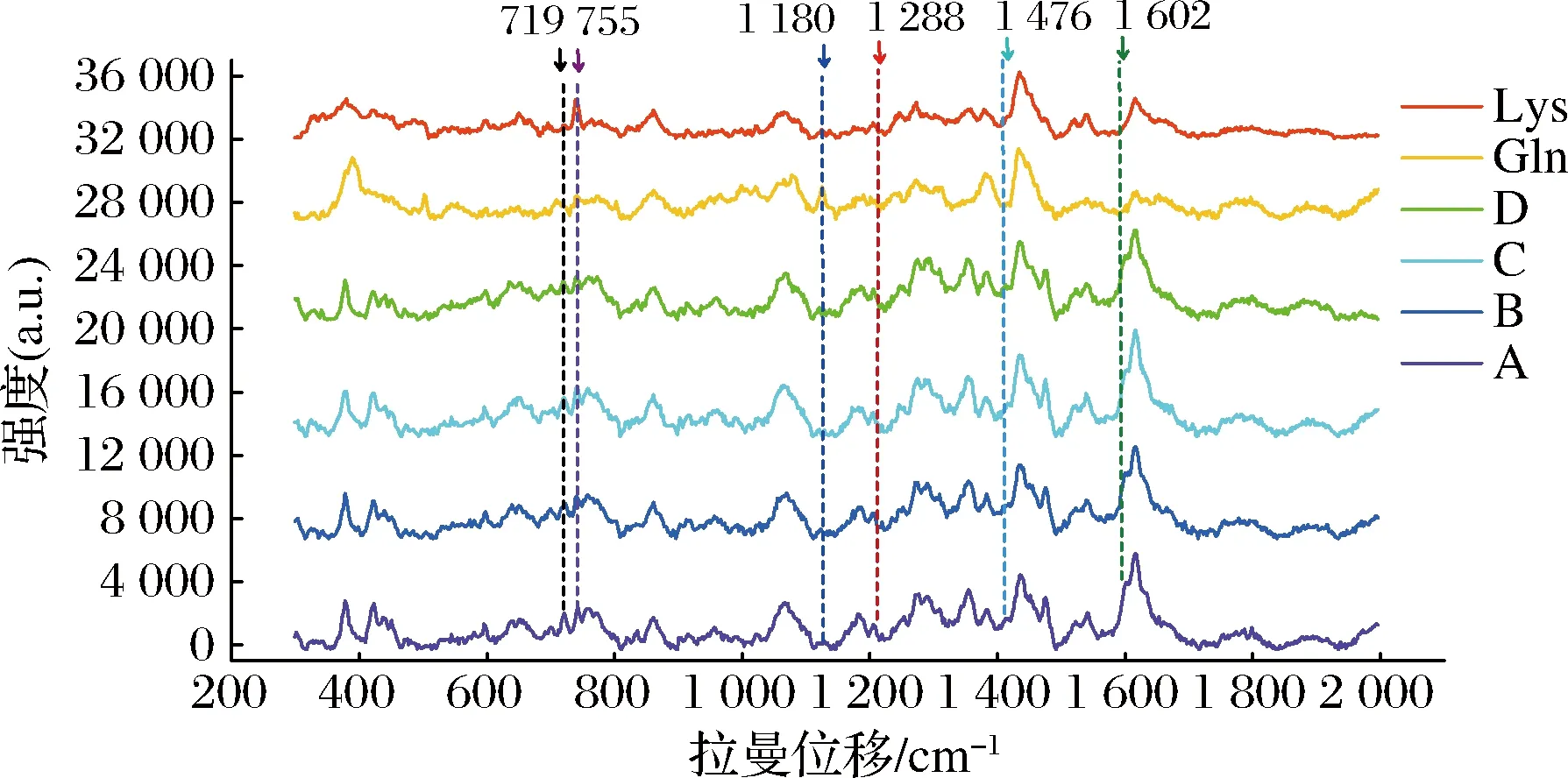
图4 Lys和Gln交联反应产物的拉曼光谱图Fig.4 Raman spectra of Lys and Gln cross-linked reaction products
谷赖二肽在1 288 cm-1的拉曼光谱峰强度随着底物赖氨酸浓度的增加而增大,但当比例大于1.1时,峰强增加有限(峰强度3 550.7 a.u.),所以当赖氨酸浓度为330 mmol/L,谷氨酰胺浓度为300 mmol/L,即比例1.1为底物的最佳浓度比(图5-a)。L-赖氨酸和L-谷氨酰胺的添加比例为1.1,谷赖二肽的产量如图5-b所示。随着L-谷氨酰胺的浓度从100 mmol/L 增加到600 mmol/L,谷赖二肽在1 288 cm-1的拉曼光谱峰强度随着底物谷氨酰胺浓度的增加而增大,分别为3 191.8、3 250.1、3 550.7、3 764.7、3 994.6和4 274.7 a.u.。
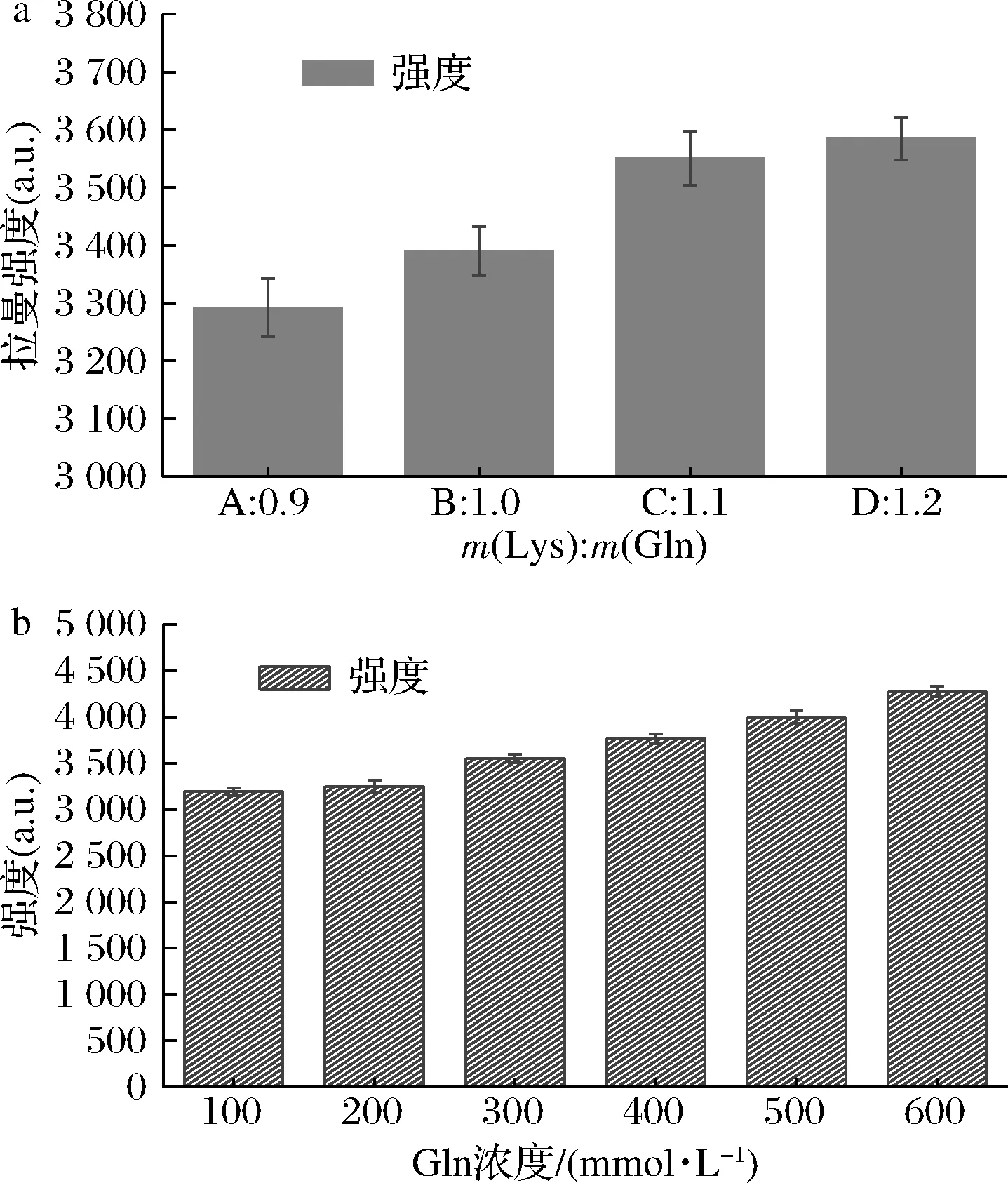
a-Lys/Gln对催化反应的影响;b-Gln浓度对催化反应的影响图5 底物的配比和底物浓度对MTG-MUT2催化反应的影响Fig.5 Effect of substrate ratio and substrate concentration on MTG-MUT2 catalytic reaction
3 结论与讨论
本研究对前期构建的毕赤酵母pro/rDNA-mtg-mut2,在14 L发酵罐高密度发酵表达获得MTG-MUT2,对其纯化酶的催化交联反应进行了研究,并探索了糖基化对酶活力的影响。
研究表明,在pH 为6.0时,诱导WCW为(195±2) g/L,采取甲醇3步补料工艺3.6 mL/(L·h) 5~6 h、7.2 mL/(L·h) 2~3 h和10.8 mL/(L·h)持续到下罐,产酶速率最快,为8.89 U/g WCW;酶活性最高,达到3.12 U/mL。一般诱导时间越长,目的蛋白的表达量越高,但诱导时间过长,可能会影响共表达2种蛋白(前导肽PRO和MTG-MUT2)的平衡[3,10-11],反而会抑制MTG-MUT2的活性表达,故本研究中诱导时间不超过45 h。在优化的最适合培养条件下,对该菌株在14 L发酵罐中高密度发酵表达,表达产物通过1步镍柱亲和层析纯化,蛋白纯化2.7倍,回收率为87.4%。
表达的重组蛋白在内质网中正确折叠是其正常分泌的重要条件,这是影响毕赤酵母高效表达蛋白的重要因素,分子伴侣和N-糖基化对有些蛋白的正确折叠是必不可少的[20-23]。本研究中Western Blot鉴定结果显示MTG-MUT2在34~43 kDa处有3条特异性蛋白带,表明有2个位点均参与了MTG-MUT2的糖基化修饰。分析其晶体结构发现MTG-MUT2有2个N-糖基化位点:N282和N297,N282环绕在活性位点C64附近,推测通过N-糖基化修饰增加肽链的亲水性,从而使肽链能够避免修饰位点与附近其他蛋白发生疏水作用,从而提高蛋白折叠的可能性,并增大了与底物的接触面积,赋予其较高的酶活。另一个糖基化位点N297,与N282相距较近,因位阻作用影响其糖基化以及与底物结合,从而影响酶活,因而N297只是一个潜在的糖基化位点,这就解释了2个位点均发生糖基化的蛋白酶活(10.6 U/mL)要低于1个位点糖基化(N282)的酶活(14.7 U/mL),但是均高于非糖基化蛋白酶活(8.7 U/mL)。以上研究结果表明,糖基化有助于MTG-MUT2的正确折叠,增大了与底物的接触面积,从而赋予其较高的酶活。
本研究还对该纯化酶催化L-谷氨酰胺的酰基转移给L-赖氨酸的交联反应条件进行了研究,并采用SERS快速、灵敏分析交联反应产物[24-26]。实验结果显示底物赖氨酸的拉曼特征峰位于651、1 203、1 354、1 518 cm-1,谷氨酰胺的拉曼特征峰位于384、501 cm-1,赖氨酸与谷氨酰胺连接产物可能的峰位于719、755、1 180、1 288、1 476、1 602 cm-1(图4)。其中1 288 cm-1主要是酰胺Ⅲ中NH 面内弯曲引起的峰,因此1 288 cm-1可作为Gln的γ-羧酰胺基与Lys的酰基形成酰胺键(肽键)的重要指征,是2个氨基酸交联的重要依据,其峰强可反映谷赖二肽的生成量。确定了赖氨酸和谷氨酰胺的最适添加比例为1.1;在最适反应条件下(反应温度55 ℃,最适pH 6.5),当谷氨酰胺浓度为600 mmol/L、赖氨酸浓度为660 mmol/L时,反应2 h,谷赖二肽在1 288 cm-1的特征峰强度为4 274.7,高于野生酶在同等反应条件下峰强的20%(野生酶:2 992.5),显示出该酶在较高反应温度下较好的氨基酸交联反应。双缩脲反应适用于分子中含两个或两个以上肽键(—CO—NH—)等基团的物质,不能用于二肽的检测。研究结果表明,采用银溶胶作为SERS基底,能够快速简便、高效灵敏检测谷氨酰胺转氨酶催化的反应产物。
综上所述,MTG-MUT2具有良好的热稳定性和催化效率高的优良特性,在工业生产中具有良好的应用潜力。MTG-MUT2催化蛋白质内或蛋白质间交联反应的性质,使其在组织工程上有潜在的应用,有待后续研究。
