应用高通量蛋白芯片技术筛查糖尿病小鼠创面差异蛋白的研究
2021-12-27刘国涛
刘 鹏, 徐 阳, 刘国涛, 周 玉, 王 军
糖尿病(diabetes mellitus,DM)是影响人类生命健康的重大疑难疾病,2013数据显示:全球20~79岁成年人中约有3.82亿糖尿病患者,预计到2035年将达到5.92亿[1]。糖尿病足(DF)作为糖尿病的严重并发症,以创面溃疡经久不愈为主要特点,因糖尿病足溃疡住院治疗的患者住院时间动辄数月,而每次治疗的费用则以万计[2]。而DF发病的具体机制尚未完全阐明,本研究通过高通量芯片技术筛查法,对比糖尿病与正常小鼠创面组织中蛋白因子的差异,探讨糖尿病性创面难愈的可能机制,为临床及基础研究提供新的实验依据。
1 材料与方法
1.1 动物和主要试剂 8周龄SPF级BALB/c小鼠20只,体质量(19.56±1.63)g,购自中国食品药品检定研究院,实验动物许可证号:SCXK(京)2014-0013;高脂高糖饲料成分:基础料72%、猪油18%、蛋黄粉8%、胆固醇2%,购自天津市奥臣实验动物销售有限公司。实验小鼠饲养于标准笼中,环境温度(23±2)℃,空气湿度为50%±10%,光照时间7:00-19:00,自由进食、饮水。将20只小鼠分开饲养,5只/笼。所有动物相关操作均遵循国家及天津中医药大学实验动物学部的有关动物伦理学规定及条例。链脲佐菌素(streptozotocin,STZ)(美国Sigma公司),通用型组织固定液(武汉赛维尔生物科技有限公司)、Cy3-链霉亲和素(广州瑞博奥公司)、GSMCAA-4000试剂盒(广州瑞博奥公司)。
1.2 方法
1.2.1 糖尿病性创面模型复制 将20只BALB/c小鼠在屏障环境内适应性饲养1周后,每次随机抓取1只小鼠赋予编号;使用随机数字表法挑选出10只作为正常组,余作为糖尿病组。正常组予普通饲料喂养,糖尿病组予高糖高脂饲料喂养,连续4周。禁食不禁水12 h,正常组小鼠腹腔注射相应量的柠檬酸-柠檬酸钠缓冲液,糖尿病组小鼠腹腔注射STZ 50 mg/kg,注射后继续禁食不禁水4 h(同时密切关注小鼠状态以防止死亡),4 h后,正常组予以普通饲料喂养,糖尿病组予以高脂高糖饲料喂养,连续注射3 d。初次注射STZ 7 d后尾尖采血,葡萄糖酶氧化法检测随机血糖,同时称量体质量。连续3次测量血糖水平均≥ 16.7 mmol/L,体质量明显下降,并出现多饮、多尿、体毛干枯等表现,即可视为糖尿病模型诱导成功[3]。正常组于相同时间点监测血糖水平及体重。
糖尿病模型稳定2周后,将糖尿病小鼠和正常组小鼠用动物剃毛器在背部刮出25 mm×25 mm区域,将脱毛膏均匀涂抹在刮毛区,作用10 min后,用无菌纱布蘸取温水温和地清除剩余的脱毛膏,正常喂养1 d。禁食不禁水8 h后,将小鼠以4%的异氟烷诱导麻醉,将小鼠俯卧位固定,以3%异氟烷维持麻醉。稍用力拉伸小鼠腰背部皮肤使之拉伸变平,用15 mm×15 mm的印章标记,局部碘伏消毒,用眼科剪沿着印章边缘剪去全层皮肤,医用无菌敷料贴敷,外层用医用强力胶布固定,分笼饲养[4]。
1.2.2 取材及保存方法 创面造模成功后观察小鼠体重和血糖的变化3 d,采用随机数字表法从状态稳定的正常组和糖尿病组中各随机挑选7只小鼠,以4%的异氟烷诱导麻醉,俯卧位固定,以3%异氟烷维持麻醉,剪取15 mm×15 mm的圆形创面组织,取材后脱颈椎法处死小鼠。1/4的创面组织平贴于滤纸片上展平,置于通用型组织固定液中摇床固定48 h,用于检测组织病理变化;剩余创面组织先于液氮中速冻,再放进-80 ℃冰箱中保存,用于蛋白芯片检测。
1.2.3 GSM-CAA-4000检 测 方 法 将2× Cell Lysis Buffer稀释2倍备用,用蒸馏水或者双蒸水稀释。配制Protease Inhibitor Cocktail:将Protease Inhibitor Cocktail(蛋白酶抑制剂)小管简单离心,加入60 μL稀释好的1×Cell Lysis Buffer在小管中,混匀溶解蛋白酶抑制剂。按10 μL蛋白酶抑制剂,990 μL的1×Cell Lysis Buffer的比例进行裂解液配制。向每个组织中加入上述裂解液,匀浆;冰上裂解30 min,每5 min振荡一次;用冷冻离心机以13 000 r/min的速度离心20 min,取上清。将玻片芯片取出,在室温平衡20~30 min后,真空干燥器或者室温干燥1~2 h。每个孔中加100 µL的样品稀释液,室温摇床上孵育1 h,封闭定量抗体芯片。抽去每个孔中的缓冲液,添加100 µL的样品到孔中,在摇床上4 ℃过夜孵育。使用Thermo Scientific Wellwash Versa芯片洗板机清洗玻片。检测抗体混合物的孵育:离心抗体混合物小管,然后加入1.4 mL的样品稀释液,混合均匀后再次快速离心。添加80 µL的检测抗体到每个孔中,室温摇床上孵育2 h。离心Cy3-链霉亲和素小管,然后加入1.4 mL的样品稀释液,混合均匀后再次快速离心。添加80 µL的Cy3-链霉亲和素到每个孔中,用铝箔纸包住玻片避光孵育,室温摇床上孵育1 h。清洗后进行荧光检测,并采用GSM-CAA-4000软件进行数据分析。
1.3 统计学方法 数据采用 SPSS 22.0软件进行统计分析。计量资料以表示,两组比较采用独立样本t检验。以P<0.05为差异有统计学意义,使用RayBiotech分析工具对GSM-CAA-4000所有阵列数据进行分析,Moderated t-statistic统计学筛选差异蛋白,foldchange表示差异变化比率:大于1表示上调;小于1表示下调。
2 结果
2.1 两组小鼠体重、血糖的变化 造模前,两组小鼠体重差异无统计学意义(P>0.05)。注射STZ前,糖尿病组小鼠体重明显高于正常组(P<0.05)。注射完STZ 7 d后及复制创面模型3 d后,糖尿病组小鼠体重显著下降,差异有统计学意义(P<0.05,表1)。造模前和注射STZ前,两组小鼠空腹血糖差异无统计学意义(P>0.05)。注射完STZ 7 d后和复制创面模型3 d后,糖尿病组小鼠空腹血糖明显高于正常组小鼠,差异有统计学意义(P<0.01,表2)。

表1 两组小鼠体重变化

表2 两组小鼠空腹血糖变化
2.2 小鼠创面组织形态学变化 复制创面模型后,两组小鼠可见明显的皮肤全层缺损;3 d后正常组小鼠皮肤创面出现收缩,面积较前缩小;糖尿病组小鼠皮肤创面收缩不明显,局部渗出较多,伴有少量脓液。见图1。
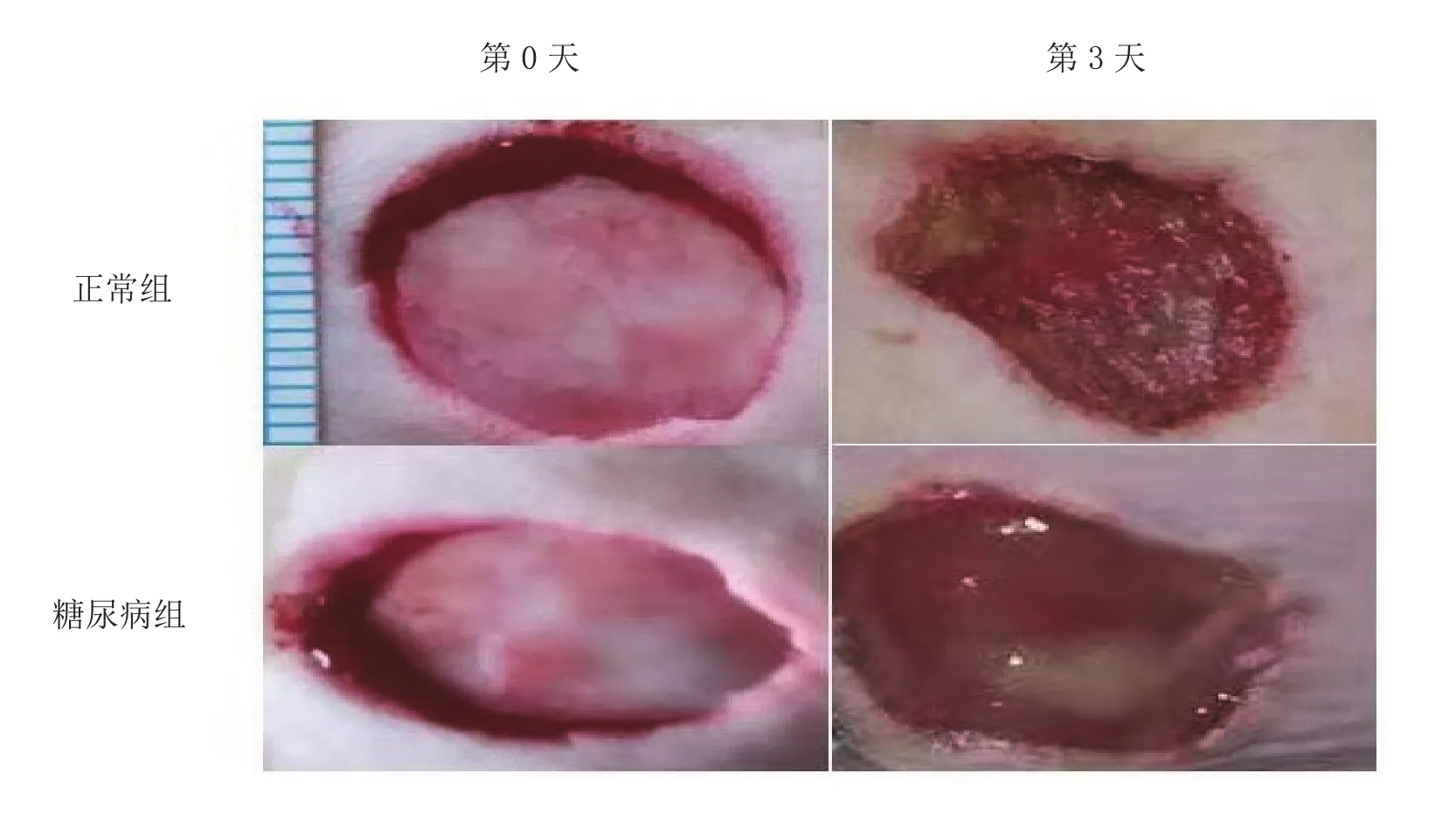
图1 小鼠创面第0天、第3天情况
2.3 创面组织染色情况 正常组小鼠创面组织损伤处大面积坏死,表皮、真皮结构不清,呈嗜酸性丝网状或均质状(黑色箭头),局部可见出血(红色箭头),外侧大量脓细胞渗出(黄色箭头),损伤一侧可见较多胶原结缔组织(绿色箭头)、较多新生毛细血管(蓝色箭头)及少量炎性细胞浸润(橙色箭头)。糖尿病组小鼠创面组织损伤处大面积坏死,表皮、真皮结构不清,呈嗜酸性丝网状或均质状(黑色箭头),外侧大量脓细胞渗出(黄色箭头),局部可见少量肉芽组织,肉芽组织内少量纤维结缔组织(绿色箭头)、大量新生毛细血管(蓝色箭头)及较多炎性细胞浸润(橙色箭头),见图2。
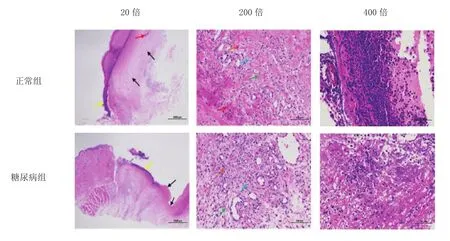
图2 创面组织HE染色
2.4 GSM-CAA-4000芯片筛选结果 经GSMCAA-4000蛋白芯片检测发现,正常组创面与糖尿病组创面200个蛋白中的29个表达量有统计学差异。与正常组对比,糖尿病组创面组织中含量降低的蛋白因子包括:ACE、Gas 1、IL-33、P-Cadherin、E-selectin、6Ckine、IL-1ra、Periostin、VEGF-D、Dtk、MCSF、SDF-1a、VEGF、TARC、Pro-MMP-9、gp130、VCAM-1、TNF RI(P< 0.05);含量升高的蛋白因子包括:MBL-2、CD36、SHH-N、Renin 1、Fetuin A、Limitin、IL-10、VEGF-B、Persephin、TRANCE(P< 0.05)。见图3、表3。

图3 抗体阵列中不同蛋白因子谱图
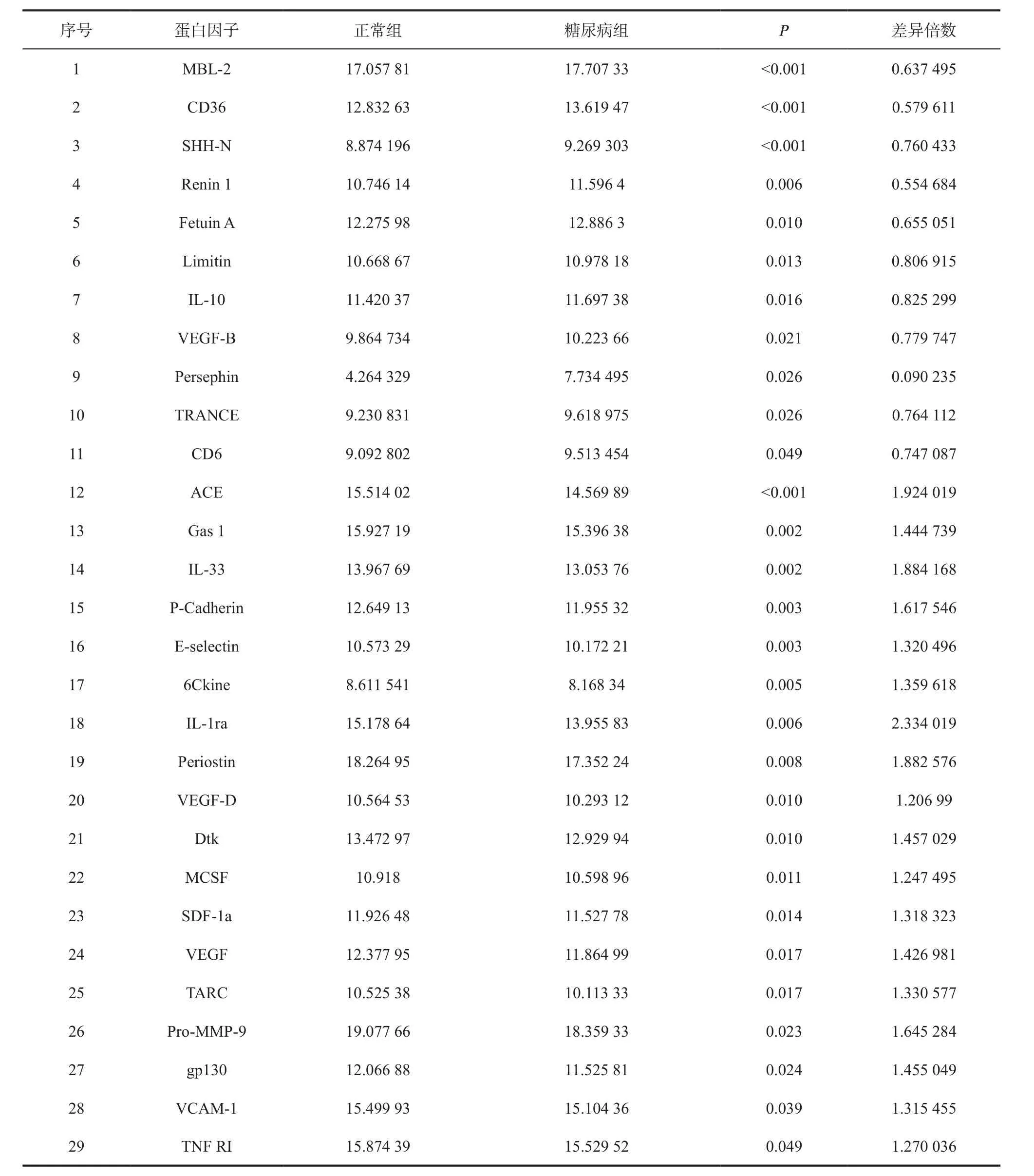
表3 正常组与糖尿病组表达有差异的蛋白因子
3 讨论
糖尿病性创面作为糖尿病后期常见并发症,以创面溃疡经久不愈为主要特点。蛋白质芯片是一种通过将大量不同的蛋白质有序地排列、固定于固相载体表面,形成微阵列,利用蛋白质分子间特异性结合的原理,实现对生物蛋白质分子精准、快速、高通量的检测技术[5]。本研究结果显示,糖尿病小鼠创面呈现愈合延迟状态,应用GSMCAA-4000蛋白芯片对糖尿病及正常小鼠创面组织进行分析对比后发现:在创面形成的第3天,创面组织存在多种类型蛋白差异,以糖尿病创面趋化 因 子 类(6Ckine/CCL21、SDF-1a/ CXCL12、TARC/ CCL17、MCSF)、黏附分子类(P-Cadherin、E-selectin、VCAM-1)、白细胞介素家族(IL-10、IL-33、IL-1ra),生长因子类(VEGF、VEGF-B、VEGF-D、Persephin)、肿瘤坏死因子类(TRANCE、TNF RI)差异较为集中,这也提示糖尿病创面微环境中存在细胞间交互介导的炎症启动缓慢,以及生长因子和黏附分子缺乏等综合因素共同导致了其愈合缓慢。
趋化因子是一类分子量8~10 ku带正电荷的蛋白,能够通过自分泌和旁分泌机制促进细胞之间的交互通讯。在结构上,根据N端半胱氨酸残基的位置和数量,将其分为4类:C、CC、CXC和CX3C[6]。在功能上,趋化因子可分为两类:一类是稳态时能持续性的表达,以维持白细胞运输的稳定;另一类发挥促炎作用,由炎症状态下被激活的细胞大量产生,以招募白细胞定向迁移。趋化因子的生物学效应主要通过与相应受体结合来发挥,特定结构的趋化因子仅能被相应类别受体识别,二者结合后通过一系列的信号传导产生细胞趋化反应,诱导细胞向机体的特定部位迁移,在各类免疫反应中发挥重要作用[7-8]。炎症状态下,趋化因子、炎症因子之间是存在联系的。在关节炎疼痛过程中,肿瘤坏死因子(TNF)和粒细胞巨噬细胞集落刺激因子(GM-CSF)致炎作用是相互依赖的,且这个过程由TARC/CCL17介导[9]。经低氧预处理(<0.1% O2)后的大鼠脂肪来源干细胞(rat adipose-derived stem cells, rASCs)较常氧浓度培养状态下的SDF-1a和VEGF-A含量明显提高,且体外管状形成能力增强,表现出更好的旁分泌及体外血管化能力[10]。
黏附分子是一类膜表面糖蛋白,主要分为5大类:整合素家族、选择素家族、免疫球蛋白超家族、钙离子依赖的细胞黏附素家族、其他未归类的分子[11]。黏附分子能够介导细胞间,或细胞与外基质间的相互作用,p-钙黏蛋白介导的Rho GTPase能够调控细胞集体迁移过程。E-选择素仅表达在内皮细胞上,当内皮细胞受到炎性因子白细胞介素1(IL-1)、TNF-α、细菌脂多糖等刺激后,表达明显增加,采用E选择素靶向微粒包装microRNAs(miR-146a/-181b)递送,能够明显改善内皮炎症和动脉粥样硬化[14]。上皮-间质转化(EMT)是极性上皮细胞向可移行间质细胞转化的现象,能够参与组织的再生和器官纤维化过程,也是组织创伤修复过程中的一个重要环节[15]。本研究结果表明,糖尿病性创面中多种黏附分子含量下降,提示在糖尿病状态下可能存在EMT水平低下,进而影响了组织的修复。
综上,糖尿病能够导致创面微环境炎症启动缓慢,以及多种生长因子、黏附分子缺乏。针对趋化因子和黏附分子表达水平的干预措施,或许能够改善细胞间的交互状态、恢复创面炎症时相,促进糖尿病性创面的愈合。
