B7-H1与B7-H4在膀胱癌大鼠及其癌旁组织中的差异表达
2021-12-27崔言秀李倩云马云峰
崔言秀, 李倩云, 马云峰
膀胱癌是泌尿系统肿瘤中发病率居第一位的恶性肿瘤。膀胱癌的预后与肿瘤的分级、分期密不可分,但同时与手术以及治疗方法的选择存在密切相关性[1]。最新的研究显示,除了这些因素之外,更多的分子参与了膀胱癌的病情演变[2]。B7家族共刺激分子在抗肿瘤免疫中的作用越来越被重视,已经成为新的研究热点。B7家族进行抗肿瘤免疫的主要途径是介导T淋巴细胞活化,同时也能够直接参与肿瘤组织的形成。肿瘤组织在成长的过程中,产生正常组织不能够表达的物质,改变组织细胞的免疫表型。其中B7-H1、B7-H4是最重要的共刺激分子,作用途径也最接近,二者在人体多种肿瘤组织中均异常表达,与肿瘤的生物学特性及肿瘤患者的预后密切相关[3]。B7-H1、B7-H4在人类多种肿瘤组织中异常表达已经被研究确认,但与膀胱癌的关系尚不十分明确[4]。本研究通过制备膀胱癌大鼠模型,检测膀胱癌组织及癌旁组织中B7-H1与B7-H4的表达差异,并分析二者的相关性,为进一步研究这两种分子在膀胱恶性肿瘤中的作用提供依据。
1 材料与方法
1.1 材料 健康雌性SD雌性大鼠42只,11~12周龄,清洁级,体质量(200±20)g,青岛大学附属医院SPF级实验室提供并饲养,动物合格证号(SCXK 20190009)。饲养条件:12 h昼夜节律,自由进食,温度21~23℃,相对湿度60%。随机分为3组:12只大鼠膀胱灌注生理盐水,作为对照组(A组),其余大鼠膀胱灌注N-亚硝基-N-甲基脲(MNU)溶液[1],成功制备膀胱癌大鼠模型28例,取膀胱癌组作为B组,取膀胱癌组织外2 cm处癌旁组织作为C组。
1.2 主要试剂与仪器 MNU(1 g/瓶)购自百灵威科技有限公司;聚维酮碘消毒液购自广东在田药业有限公司;RNA提取试剂(Trizol)购自美国Invitrogen公司;逆转录试剂盒购自美国Promega公司;碘造影剂欧乃派克购自中国通用电气药业上海有限公司。PCR试剂盒购自美国Invitrogen公司。PCR仪购自美国BioRad公司,型号:T100。
1.3 大鼠麻醉方法 采用腹腔注射水合氯醛法麻醉大鼠。称重大鼠后,以5 mL/kg的药物剂量进行麻醉。注射部位:右下腹部靠近下肢根部处。注射完成后注意观察,防止漏液,保证麻醉效果。
1.4 MNU溶液膀胱灌注 将大鼠麻醉成功后,固定于实验台上,仰卧位,碘伏消毒尿道外口,石蜡油润滑后,将硬膜外导管插入尿道,排空尿液,将调整好的MNU溶液或者生理盐水推入膀胱,拔除硬膜外导管,金属架夹闭尿道1 h,大鼠苏醒后自行排尿,排出膀胱灌注溶液。灌注周期8周,每2周1次,每次2.0 mg溶液,灌注总量8.0 mg。
1.5 MNU组大鼠成瘤鉴定 病理检查:灌注8周后处死所有大鼠,取MNU溶液组新鲜膀胱癌组织和癌旁组织,在低温下用生理盐水洗净,固定、脱水、包埋,以5~8 μm层厚切片,苏木素-伊红(HE)染色,光镜(×400)下进行病理诊断。
1.6 RT-PCR检测 各基因引物均购自上海英骏生物技术有限公司,引物序列见表1。取3组组织,应用逆转录-聚合酶链反应(reverse transcriptasepolymerase chain reaction, RT-PCR)技术测定B7-H1和B7-H4的mRNA含量,操作严格按照RT-PCR试剂盒说明书进行操作。组织溶解后,吹打30 s,离心5 min(2000×g),先后加入TaKaRa RNAiso Reagent提取液1 mL,氯仿0.2 mL,异丙醇0.5 mL,75%乙醇2 mL,离心溶解,待沉淀自然干燥,加入无RNase水50 μL,混匀备用。逆转录反应条件:30 ℃ 10 min,42 ℃ 30 min,然后95 ℃ 5 min,然后冰上骤冷。PCR扩增反应条件:B7-H1、B7-H4 反应:94 ℃、1 min,94 ℃、30 s,55 ℃、30 s,72 ℃、45 s,36 个循环,72 ℃、10 min。GAPDH 反应:94 ℃、1 min,94 ℃、30 s,57 ℃、30 s,72 ℃、45 s,34个循环,72 ℃、10 min。PCR产物4.0 μL与10×载体样缓冲液1.0 μL混匀,点样,80 V稳压电泳45 min,在凝胶成像仪上观察、拍照。蛋白条带灰度分析应用Quantity One软件,以GAPDH的表达量作为内对照,对Cat Sper1 mRNA进行半定量分析。
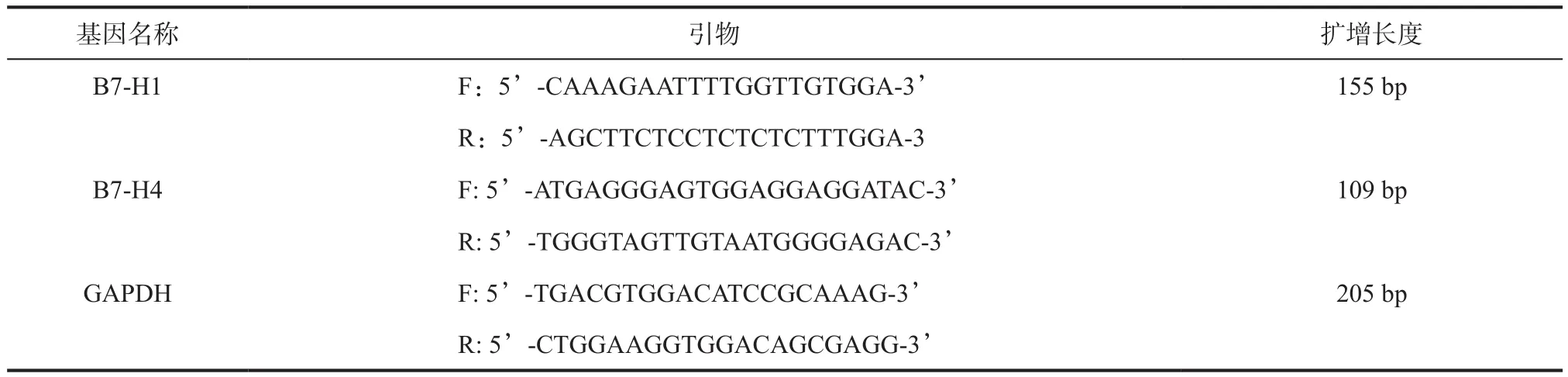
表1 基因扩增引物序列
1.7 统计学方法 应用SPSS 23.0统计软件进行分析,数据结果以表示,多组比较用方差分析,进一步组间两两比较用LSD-t检验,相关性分析采用Pearson相关,P<0.05为差异有统计学意义。
2 结果
2.1 原位膀胱肿瘤细胞鉴定 对MNU组所有大鼠进行病理检查,其中在28只大鼠中检测到膀胱肿瘤组织,成瘤率93.3%,病理类型主要为膀胱原位癌,见图1。
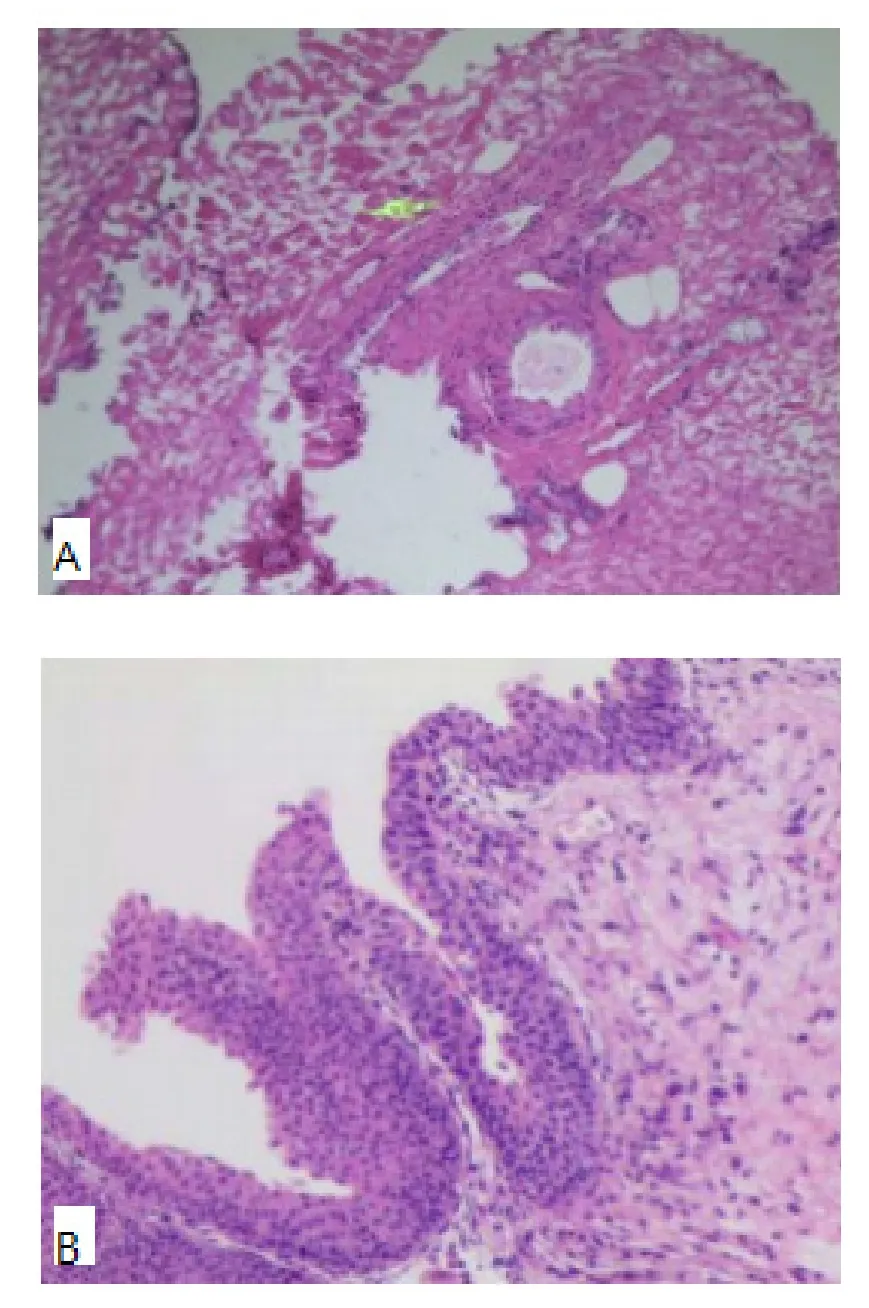
图1 大鼠膀胱病理切片(HE,×400)
2.2 各组B7-H1、B7-H4 mRNA的表达量比较 A组、C组B7-H1、B7-H4 mRNA含量均明显低于B组,差异有统计学意义(P<0.01);提示B7-H1与B7-H4 mRNA在肿瘤组织中的表达量明显高于正常膀胱组织和癌旁组织。C组B7-H1、B7-H4 mRNA的表达量与A组差异无统计学意义(P>0.05)。见表2、图2。
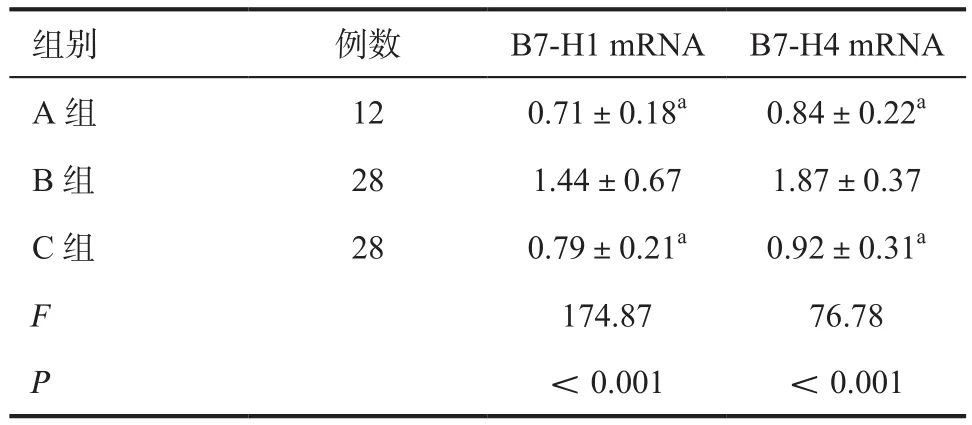
表2 各组B7-H1、B7-H4 mRNA相对表达量比较
图2 各组B7-H1与B7-H4 mRNA的表达量
2.3 Pearson相关性分析 膀胱癌组织(B组)中的B7-H1与B7-H4 mRNA表达量呈正相关(r=0.908,P<0.05)。见图3。
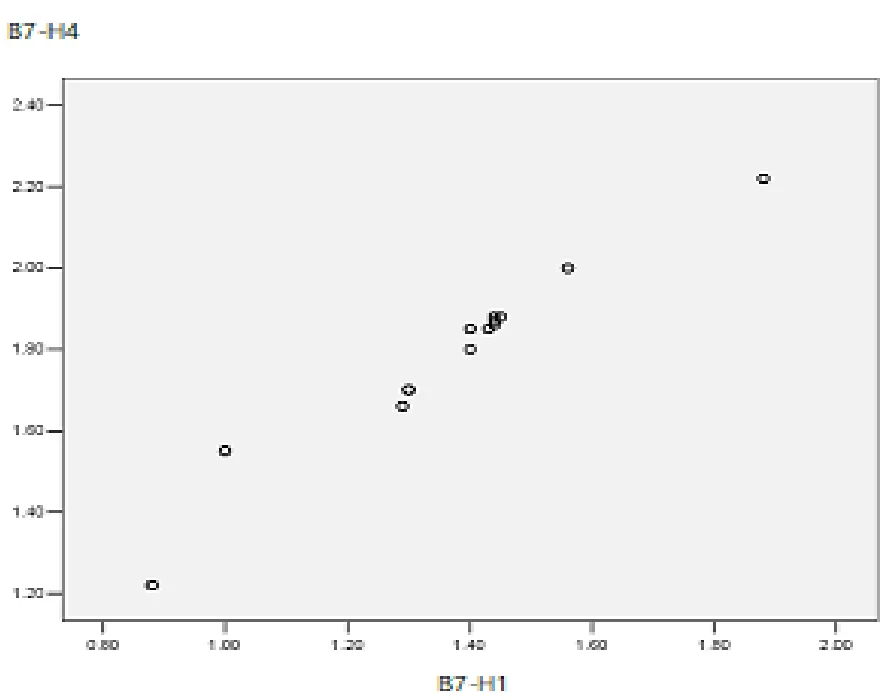
图3 B7-H1与B7-H4的相关性分析
3 讨论
动物实验在医学研究中占有十分重要的地位,可以有效避免临床研究的不确定因素和干扰,尤其在肿瘤细胞的研究中,所以成功建立动物模型是十分重要的环节。目前,膀胱肿瘤大鼠模型的构建方法很多,诸如病毒诱导、移植等,但都存在非常多的缺点,无论成瘤率还是成瘤效率都不能令人满意,对实验研究造成极大地限制[5]。MHU膀胱灌注法主要能够构建膀胱原位癌,在本研究中也得到了验证。此方法操作简单、诱癌率高,操作性和实用性都比较高,最适合应用于实验研究中。本实验应用MHU膀胱灌注法诱导大鼠膀胱癌,成瘤率93.3%。由于雌性大鼠尿道较短,进行膀胱灌注操作更加简单,所以本研究应用雌性大鼠作为实验载体。但缺点是成瘤的类型相对单一,对肿瘤的分期、分级不好控制。
B7-H1又称为PD-L1,是第3个被发现的B7家族成员,被称为免疫关卡点分子,在T细胞的免疫应答中具有重要作用,可以诱导T细胞凋亡和肿瘤免疫逃逸,从而抑制T细胞的作用,使细胞的免疫应答不能发挥作用[6]。近年研究发现,在人体的正常组织中,能够发现少量的B7-H1分子,但大多数肿瘤组织中B7-H1的表达量明显上调,它促使肿瘤患者机体免疫力下降的因素是多方面的[7]。首先,它可以抑制T淋巴细胞的增殖,减少其数量。其次,它可以促进分泌抑制性细胞因子。最后,抑制分泌活化性细胞因子以及细胞毒性的杀伤力。B7-H4又称为B7x,也是B7家族成员的重要组成部分,它是一种I型跨膜糖蛋白,基因位于1号染色体上。B7-H4同样可以抑制机体的免疫反应,从而形成肿瘤组织的免疫逃逸或者免疫抑制[8-10]。虽然B7-H4的具体受体尚存在争议,但其与受体结合以后可以下调细胞的增殖,主要的方式是减少细胞因子、延长细胞分裂周期、下调细胞的表达量等等。同时研究发现,CD28可以促进或者激化B7-H4的作用,而细胞活化的标志IL-2 的表达量与B7-H4含量呈正相关[11-14]。
在众多的恶性肿瘤研究中,B7-H1和B7-H4都呈高表达,并与肿瘤的发展、预后存在密切相关性[15-17]。但二者在膀胱癌的表达情况以及二者的相关性报道较少,本研究应用RT-PCR技术检测膀胱癌大鼠模型癌组织中B7-H1 和B7-H4的表达情况。结果显示,B7-H1和B7-H4 mRNA表达量在癌组织中均明显高于癌旁组织及非癌大鼠膀胱组织。提示二者在膀胱癌的发生、发展过程中扮演了重要的角色,可能与二者的免疫调节存在密切相关性。另外,经过对二者的相关性分析,发现者表达量呈正相关,二者可能在机体的抗肿瘤免疫反应中共同扮演着负性调控因子的作用,相互协调,相互促进。以往研究发现膀胱癌患者的癌组织中B7-H1表达增高,并且与肿瘤组织的分期、分级存在相关性,分期、分级越高,表达量越大,提示B7-H1可以作为膀胱癌病情发展以及治疗效果的潜在标志物[17]。本研究采用膀胱癌大鼠模型,排除临床上众多的不可控因素,将载体标准化,从而判定B7-H1和B7-H4在膀胱癌组织中的生物学特性,为临床膀胱癌的免疫靶向治疗提供新的研究方向,从而为临床诊断及治疗寻找到新的靶点。但本研究同样存在一定局限性,主要表现在动物模型不能具备肿瘤类型的多样性,对肿瘤的分期及分级也好控制,缺乏这方面的设计。对B7-H1 和B7-H4阻断之后,在动物模型中的免疫变化也需要进一步的研究。
