骨代谢标志物在多发性骨髓瘤骨病评估中的意义
2021-12-26章涵硕吴月蓉夏海龙
章涵硕,吴月蓉,夏海龙
安徽医科大学第一附属医院血液科,安徽合肥 230022
多发性骨髓瘤(MM)是一种以浆细胞恶性增殖为特征的B细胞恶性肿瘤,发病率占血液系统恶性疾病的13%,且发病率有上升趋势。多发性骨髓瘤骨病(MBD)是MM最常见的并发症之一,严重影响MM患者生存质量,骨损害的严重程度与MM患者生存质量和预后相关[1]。大多数MM患者在初诊时即有溶骨性病变。早期诊断、尽早治疗MBD对保障MM患者生存质量具有重要意义。虽然影像学检查对MBD诊断提供了直观证据,但是不能对MBD进行早期和精确定量评价。骨代谢标志物是评价骨组织生理代谢的指标,将其用于MM患者MBD评价的报道较少。本研究通过检测MM患者和健康人群部分骨代谢标志物,分析了骨代谢标志物与MBD严重程度间的关系,旨在探讨骨代谢标志物在评估MBD严重程度中的价值。
1 资料与方法
1.1一般资料 选取2017年2月至2019年12月本院血液科收治的64例MBD患者作为MBD组。MBD组患者均符合国际骨髓瘤协作组(IMWG)中的诊断标准[2],而且通过X线摄片、CT、MRI或正电子发射计算机断层扫描(PET-CT)等检查发现存在多发溶骨性改变和(或)伴发骨折的严重骨质疏松。MBD组男39例、女25例,年龄41~83岁;按MM国际分期体系(ISS)分期[3]:Ⅰ期24例、Ⅱ期23例、Ⅲ期17例;根据MBD患者影像学检查结果进行骨病分级:A级,仅有骨质疏松或溶骨性损害≤2处;B级,溶骨性损害≥3处或发生病理性骨折[4]。另外,选取同期于本院体检中心体检的31例健康者作为对照组,排除有骨质疏松症、近期骨折及代谢性骨病者,男20例、女11例,年龄39~83岁。各组间性别、年龄比较差异无统计学意义(P<0.05)。
1.2方法 采集患者及健康体检者晨间空腹静脉血3 mL,分离出血清标本,保存于-80 ℃冰箱中。5项骨代谢标志物:N端中段骨钙素(N-MID)、β-Ⅰ型胶原羧基端肽(β-CTX)、Ⅰ型前胶原N末端前肽(PⅠNP)、甲状旁腺激素(PTH)、25-羟基维生素D3[25-(OH)D3]采用罗氏E170全自动电化学发光仪及配套试剂进行检测。所有检测均在仪器定标、质控合格后进行。纳入研究者均对本研究知情同意并签署知情同意书。
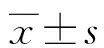
2 结 果
2.1MBD组与对照组5项骨代谢标志物水平比较 MBD组N-MID、PTH水平高于对照组,差异均有统计学意义(P<0.05);MBD组与对照组25-(OH)D3、PⅠNP、β-CTX水平比较,差异无统计学意义(P>0.05),见表1。

表1 两组间5项骨代谢标志物水平比较[M(P25~P75)]
2.2不同ISS分期患者间5项骨代谢标志物比较 MBD组中,ISS Ⅲ期患者血清β-CTX水平高于ISS Ⅰ期患者,差异有统计学意义(P<0.05)。不同ISS分期患者间其余各项骨代谢标志物水平比较,差异均无统计学意义(P>0.05)。见表2。

表2 不同ISS分期患者间5项骨代谢标志物水平比较[M(P25~P75)]
2.3不同骨病分级患者间骨代谢标志物水平比较 MBD组中,A级和B级患者间血清25-(OH)D3、PTH、PⅠNP和β-CTX水平比较差异无统计学意义(P>0.05);A级患者N-MID水平高于B级患者(P<0.05),见表3。
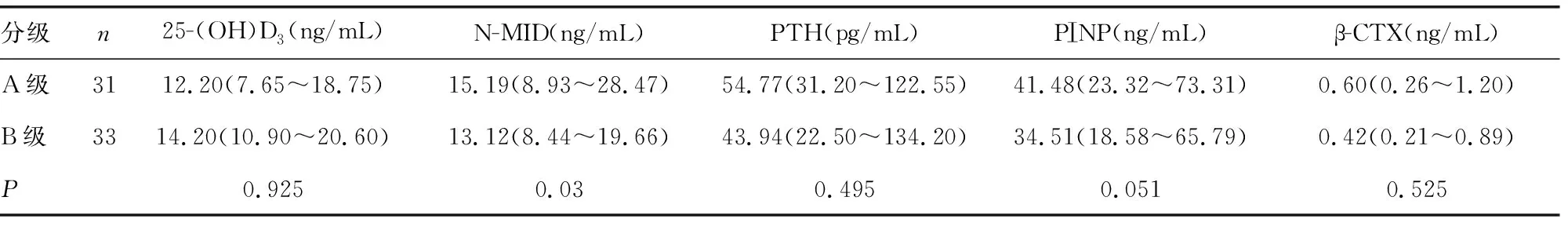
表3 不同骨病分级患者5项骨代谢标志物水平比较[M(P25~P75)]
3 讨 论
MBD是MM最严重的并发症之一,MBD的发生可加快MM疾病进展,严重影响患者生活质量[5]。骨形成和骨吸收的动态平衡可以维持正常的骨稳态。由骨髓瘤细胞和骨髓微环境产生的相关因子通过核因子κB受体活化因子(RANK)/RANK配体(RANKL)通路激活破骨细胞,抑制成骨细胞。骨稳态的失调导致了MBD的发生。骨代谢生化标志物可反映骨吸收和骨形成活性,可用于对患者骨状态的评估,相较于骨髓活检及影像学检查,具有创伤小、经济以及可早期反映骨病等特点。有研究报道,骨代谢标志物可用于预测恶性肿瘤患者骨转移骨相关事件(SRE)的发生风险以及疾病进展和预后[6]。临床上能特异地反映骨代谢的标志物包括骨代谢调控激素,如维生素D及其代谢产物、PTH,以及骨转换标志物(BTMs)等。BTMs可反映骨骼细胞活性与骨基质代谢水平,分为骨形成和骨吸收标志物两类。骨吸收标志物(包括β-CTX)主要为Ⅰ型胶原的降解产物,能反映破骨细胞活性,而骨形成标志物[N-MID、PⅠNP、Ⅰ型前胶原羧基末端前肽(PⅠCP)]反映成骨细胞活性[7]。
25-(OH)D3是反映体内维生素D水平的金标准,其在肾1α-羟化酶的作用下转化成1,25-二羟基维生素D3[1,25-(OH)2D3],能促进小肠绒毛上皮细胞对钙的吸收,升高血钙水平,增加骨密度水平。在骨组织中,生理剂量下1,25-(OH)2D3直接作用于骨的矿物质代谢,促进骨基质形成及类骨质矿化。大剂量时,1,25-(OH)2D3调节破骨细胞生成,促进骨吸收[7]。本研究中,MBD组与对照组间、不同ISS分期间、不同骨病分级间25-(OH)D3水平差异均无统计学意义(P>0.05),提示维生素D水平不是影响MM发病及MBD发生、发展的主要因素。
本研究中,MBD组血清PTH水平明显高于对照组(P<0.05),这与BADROS等[8]的报道一致。PTH是由甲状旁腺主细胞合成并分泌的,其在维持机体钙磷平衡和调节骨代谢中发挥着重要作用。PTH通过直接刺激破骨细胞前体细胞,促进破骨细胞成熟并增加其破骨能力,动员骨钙入血,导致血钙水平升高[9]。这也解释了部分MBD患者临床出现高血钙水平的情况。此外PTH还可与成骨细胞前体细胞及成骨细胞结合,抑制两者活性,导致骨形成减少。有研究报道了高水平的PTH可促进浆细胞生长,促进MM的病情进展,高水平PTH者预后较差[10]。但是MM患者PTH升高的机制目前尚未被阐明,还有待进一步的研究。
N-MID是骨基质中的特异性非胶原蛋白,主要由成骨细胞产生并释放,其他细胞(如骨髓巨噬细胞等)也可产生并释放。血清骨钙素水平能反映骨更新及骨转换率,已有研究表明血中骨钙素水平与骨形成具有良好的相关性[11]。本研究中MBD患者的血清N-MID水平高于对照组(P<0.05),提示MBD患者相较于对照组有更高的骨转换活性。本研究的MBD患者根据骨病严重程度分级,骨病较重的患者血清N-MID水平低于骨病较轻的患者(P<0.05),这与文献报道的结果类似[12-13],说明N-MID水平能较好地反映MM骨破坏增加的病理改变。
β-CTX为骨吸收过程中被破骨细胞溶解的Ⅰ型胶原释放入血的片段,由成熟胶原降解产生,其水平反映了破骨细胞骨吸收活性,即β-CTX水平升高反映骨损害的增强[13],其升高程度与破骨细胞活性增高的程度一致。将MBD组患者按ISS分期,比较不同分期患者血清β-CTX水平。本研究发现,MM ISS分期较高组β-CTX水平高于ISS分期较低组(P<0.05),结果与既往相关研究一致[14-15]。本研究表明血清β-CTX水平可以作为MM患者临床分期的重要参考指标。
PⅠNP水平能间接反映骨形成过程中成骨细胞的活性。本研究发现PⅠNP在骨病较重组中的水平略低于骨病较轻组,但差异无统计学意义(P>0.05)。
综上所述,本研究发现MBD患者血清PTH及N-MID水平明显高于同龄健康人群;β-CTX水平与MBD患者ISS临床分期有关,N-MID水平与MBD严重性有关。因此,部分骨代谢生化指标可用于MBD严重性的评估。本研究有样本量较少的不足,此外,笔者认为骨髓瘤细胞造成骨破坏的途径,以及骨代谢标志物水平变化的机制还有待进一步研究。
