miR-145 对三阴性乳腺癌细胞增殖、侵袭及转移能力的影响
2021-12-26朱凌霄张雪鹏李昊鑫
朱凌霄 张 兰 张雪鹏 李昊鑫
华北理工大学附属医院肿瘤外科,河北唐山 063000
三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌中一种难治性亚型,由于缺乏特异性受体,目前TNBC 主要采用传统的化疗和手术治疗,但预后较差,所以寻找新的治疗手段,尤其是靶向治疗是目前的研究热点[1-2]。微RNA(microRNA,miRNA)是强大的“基因调节剂”,其中miR-145 作为表达较为显著的一类抑癌基因,可抑制TNBC 的增殖、转移及侵袭[3-4]。本课题组前期发现,miR-145 通过调控解聚素-金属蛋白酶17(adisintegrin and metalloproteinase 17,ADAM17)可影响MCF-7 乳腺癌细胞的增殖和侵袭[5]。为进一步观察其在TNBC 中的作用,本研究在降低TNBC 细胞中miR-145 的表达水平后,通过测定和分析下游ADAM17 及与其密切相关的表皮生长因子受体(epidermal growth factor receptor,EGFR)相关指标的变化后,观察其对TNBC 细胞增殖和侵袭的影响,并探讨其作用机制,为TNBC 的靶向治疗提供新思路。
1 材料与方法
1.1 材料
人TNBC MDA-MB-231 细胞株(CL-0150)购于武汉普诺赛生命科技有限公司;miR-145 无义序列(miR2N0000001-1-1)、miR-145 inhibitors(miR20000)以及引物(miR01101)均由广州锐博生物科技有限公司设计与合成;Leibovitz L-15 培养基(10-045-CVR)购于美国Corning 公司;胎牛血清(A0100-3210)购于德国Cegrogen 公司;实时聚合酶链反应试剂盒(RK21 203)购于武汉爱博泰克生物科技有限公司;Lipofec tamine 2000 试剂(11668027)购于美国Invitrogen 公司;ADAM17(GTX101358)购于美国GeneTex 公司;EGFR抗体(ARG66204)购于上海Arigo 公司。
1.2 细胞培养及分组
使用L-15 完全培养基(含10%胎牛血清和1%双抗)培育本研究的目标细胞,MDA-MB-231 细胞置于37℃、无CO2的饱和湿度培养箱中培养,实验分为空白组(细胞无特殊处理)、miR-145 NC 组(转染miR-145 无义序列)、miR-145 inhibitors 组(转染miR-145 inhibitors)。转染后分析确定各组miR-145 的表达水平以及转染效率。
1.3 实时聚合酶链反应检测各组miR-145 和ADAM17、EGFR mRNA 的表达
细胞转染后继续在细胞培养箱中培养48 h,Trizol 法提取各组的总RNA,利用逆转录试剂盒(锐博生物,ZR102-2)合成cRNA。以U6 和β-actin 分别作为miR-145 和ADAM17、EGFR 的内参,进行PCR 扩增。在电脑上预先设置好反应需要的相关程序,并按顺序进行45 个循环,过程主要包括:预变性(95℃,10 min)、变性(95℃,10 s)、退火(56℃,25 s)、延伸(72℃,1 min)。反应完毕后收集各组数据,各组mRNA 的表达量用相对定量法表示。实验所需引物序列如表1所示。

表1 引物序列
1.4 Western blot 检测各组ADAM17 及EGFR 蛋白的表达
不同处理组细胞转染48 h 后,提取各组细胞的总蛋白并测定蛋白浓度。配制SDS-PAGE 胶并进行凝胶电泳,而后进行电转以及封闭,置于一抗工作液中,4℃冰箱中孵育过夜。次日置于二抗工作液中孵育,凝胶成像仪对条带进行显像并分析光密度(optical density,OD)值。
1.5 CCK-8 法测定细胞增殖活性
不同处理组细胞转染成功后接种于96 孔板中培养,每组可设3 个复孔。分别在转染后24、48、72 h 时加入CCK-8 试剂,并检测各孔的OD 值(450 nm)并记录。
1.6 Transwell 实验检测各组细胞的侵袭能力
转染成功后的各组细胞培养24 h 后进行消化重悬,加入提前铺好Matrigel 基质胶的小室中(约5×105个细胞/孔)。同时Transwell 下室加入L-15 完全培养基,36 h 后对侵袭细胞进行固定以及着色。待其明显着色后在显微镜下进行计数,记录各组细胞的穿膜数目。
1.7 细胞划痕实验观察细胞的迁移能力
各组MDA-MB-231 细胞转染成功6 h 后,用100 μl 无菌枪头对三组细胞划3 条直线,此时记为划痕实验0 h,计时24 h,观察并记录转染后显微镜下细胞的形态以及分布。
1.8 统计学方法
使用SPSS 23.0 软件对数据进行分析,计量资料用均数±标准差()表示,两组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 Lipofectamine 2000 介导的miR-145 转染率比较
miR-145 inhibitors 组miR-145 表达量低于miR-145 NC 组,差异有统计学意义(P<0.05);miR-145 NC组与空白组miR-145 表达量比较,差异无统计学意义(P >0.05)。见图1。
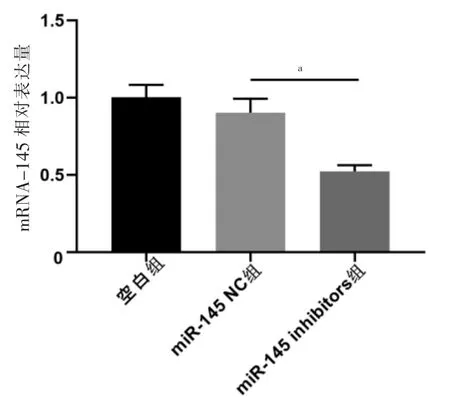
图1 Lipofectamine 2000 介导的miR-145 转染率比较
2.2 各组MDA-MB-231 细胞增殖情况比较
空白组与miR-145 NC 组比较:转染后时间比较,差异有统计学意义(P <0.05),而组间、交互作用比较,差异无统计学意义(P >0.05)。进一步两两比较,组内比较:转染后72 h,空白组、miR-145 NC 组OD值均大于转染后24 h,差异有统计学意义(P <0.05)。组间比较:转染后24、48、72 h,miR-145 NC 组与空白组OD 值比较,差异无统计学意义(P >0.05)。见表2。
miR-145 NC 组与miR-145 inhibitors 组比较:转染后时间、组间、交互作用比较,差异有统计学意义(P <0.05)。进一步两两比较,组内比较:转染后72 h,miR-145 inhibitors 组OD 值大于转染后24、48 h;差异有统计学意义(P <0.05)。组间比较:转染后72 h,miR-145 inhibitors 组OD 值大于miR-145 NC 组,差异有统计学意义(P <0.05)。转染后24、48 h,miR-145 inhibitors 组与miR-145 NC 组比较,差异无统计学意义(P >0.05)。见表2。
表2 各组转染后不同时间点OD 值比较(,n=3)

表2 各组转染后不同时间点OD 值比较(,n=3)
注:空白组与miR-145 NC 组比较:F时间=1059.059,P时间<0.001;F组间=0.442,P组间=0.543;F交互=5.109,P交互=0.087。miR-145 NC组与miR-145 inhibitors 组比较,F时间=281.070,P时间<0.001;F组间=20.413,P组间=0.011;F交互=73.391,P交互=0.001。与本组转染后24 h比较,aP <0.05;与本组转染后48 h 比较,bP <0.05;与miR-145 NC 组同期比较,cP <0.05
2.3 各组细胞侵袭能力比较
miR-145 inhibitors 组跨膜细胞数多于miR-145 NC 组,差异有统计学意义(P<0.05);miR-145 NC 组与空白组跨膜细胞数比较,差异无统计学意义(P >0.05)。见图2~3。

图2 各组细胞的跨膜结果(200×)
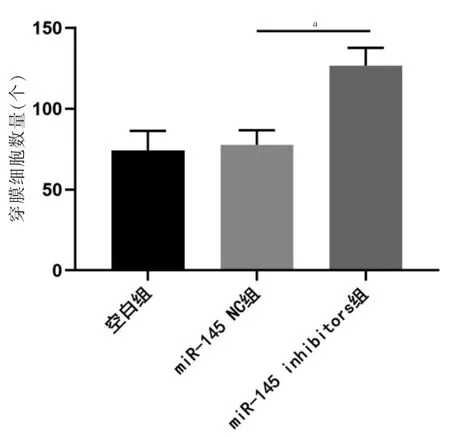
图3 各组细胞侵袭能力比较(n=3)
2.4 各组细胞的迁移能力比较
miR-145 inhibitors 组划痕愈合率高于miR-145 NC 组,差异有统计学意义(P <0.05);miR-145 NC 组与空白组细胞愈合率比较,差异无统计学意义(P >0.05)。见图4~5。
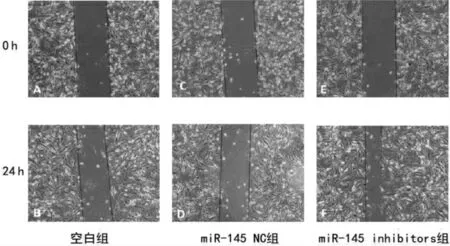
图4 各组细胞的迁移情况(200×)

图5 各组划痕愈合率比较(n=3)
2.5 各组ADAM17、EGFR mRNA 的表达情况比较
miR-145 inhibitors 组ADAM17 mRNA 相对表达量高于miR-145 NC 组,差异有统计学意义(P<0.05);miR-145 NC 组与空白组ADAM17 mRNA 相对表达量比较,差异无统计学意义(P >0.05)。miR-145 inhibitors 组 和miR-145 NC 组EGFR mRNA 的 相 对表达量比较,差异无统计学意义(P >0.05);miR-145 NC组与空白组EGFR mRNA 相对表达量比较,差异无统计学意义(P >0.05)。见图6。

图6 各组ADAM17、EGFR mRNA 的表达情况比较(n=3)
2.6 各组ADAM17、EGFR 蛋白表达情况比较
miR-145 inhibitors 组ADAM17、EGFR 蛋白相对表达量高于miR-145 NC 组,差异有统计学意义(P <0.05);miR-145 NC 组与空白组ADAM17、EGFR 蛋白相对表达量比较,差异无统计学意义(P >0.05)。见图7~8。

图7 Western blot 检测各组ADAM17、EGFR 蛋白条带
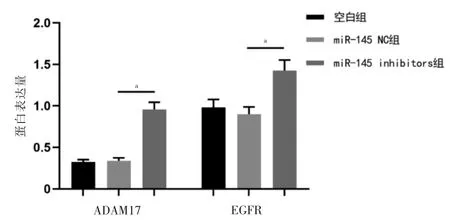
图8 各组ADAM17 和EGFR 的蛋白表达量比较(n=3)
3 讨论
临床上TNBC 生存率低,复发率高,早期容易发生转移且侵袭性较其他亚型强[6]。由于TNBC 特殊的生物学特性(多种受体表达明显缺陷),现有的分子靶向治疗并不能获得较好的临床效果。而目前主要采用传统的化疗和手术治疗方式在大约30%的TNBC 患者中可以有效地发挥作用,但许多患者对于上述治疗方式没有反应或只有部分反应,且最终以远处转移的形式复发,可以说目前临床上患者的预后及生存期仍然不甚理想,所以寻找TNBC 的治疗靶点迫在眉睫[7-8]。已有研究证明,在miRNA 家族中存在很多与肿瘤发生发展息息相关的miRNA,他们通过与目标mRNA 结合并激发原癌基因或者抑癌基因的表达,参与了肿瘤的发生发展乃至预后的过程,即有的miRNA 促进肿瘤的增殖与侵袭,而有的miRNA 则参与负向调控肿瘤的生物学进程[9-10]。众所周知,miR-145 作为抑癌效果显著的miRNAs 之一,已经被证明与许多恶性肿瘤的病理进程有紧密的联系,比如在甲状腺恶性肿瘤中,miR-145 主要是靶向抑制PI3K/AKT3 信号通路,从而抑制甲状腺癌细胞的多种生物学特性[11]。当然,miR-145 靶向调控不同的信号通路来影响恶性肿瘤细胞增殖、侵袭等生物学行为的这一特性在胃癌、结直肠癌等疾病中亦有显著表现[12-13]。所以miR-145 有可能作为乳腺癌的治疗靶点[14]。本课题组前期研究证实,miR-145 过表达抑制MCF-7 乳腺癌细胞的增殖及侵袭[15-16]。我们进一步研究抑制miR-145 的表达对TNBC 细胞的影响,主要应用增殖实验(CCK-8 实验)以及Transwell 实验和细胞划痕实验证明miR-145 在TNBC 细胞中表达明显受到抑制时,可以有效促进细胞的生长增殖以及侵袭和迁移能力。
本实验还探究了miR-145 在TNBC 中可能存在的作用机制,通过分别检测ADAM17 和EGFR 在细胞中的表达变化,发现ADAM17 mRNA 和蛋白质水平均上调;而EGFR mRNA 水平无变化,但蛋白表达水平上调。提示miR-145 可能直接调控ADAM17,但不直接调控EGFR。查阅文献发现,在许多恶性肿瘤的发生发展过程中,miR-145 均可通过靶向调控ADAM17 来参与病理进程[17-18]。前期研究发现,miR-145 与ADAM17 存在碱基互补序列,这一信息主要来源于生物学信息库(TargetScan、PicTar 及miRanda),并据此预测了二者的关联性[16]。提示miR-145 靶向调控ADAM17 的信号通路在TNBC 中存在合理性。研究显示,EGFR 在恶性肿瘤发生发展的信号通路中,是通过被上游的ADAM17 锚定以及激活后,经历自身的二聚化以及磷酸化的过程,进而继续激活下游的差异信号通路,从而调控多种肿瘤发生机制[19-20]。本研究中EGFR 蛋白水平上调,可能是因为ADAM17 上调,其作为下游,蛋白表达亦升高,查阅相关文献亦支持这一结论[21]。
综上,miR-145 inhibitor 通过靶向激活ADAM17/EGFR 通路,促进TNBC 细胞的增殖、侵袭和迁移。这可能为未来TNBC 的临床治疗提供新的分子靶点和治疗思路。
