背俞指针疗法对GERD大鼠胃起搏区MLCK及PMLC20表达水平的影响❋
2021-12-24黄美祯谭金晶宋庆增刘礼剑韦金秀周晓玲黎丽群岑前丽李建锋
黄美祯, 谭金晶, 宋庆增, 刘礼剑, 韦金秀, 周晓玲, 黎丽群, 岑前丽, 李建锋, 谢 胜△
(1.广西中医药大学, 南宁 530001;2.广西中医药大学第一附属医院, 南宁 530023;3.柳州市中医院,广西 柳州 545001)
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃或十二指肠内容物反流入食管,从而引起反酸、烧心等与反流相关症状或并发症的疾病[1]。GERD为多发性疾病,其全球总体发病率为13%并呈上升趋势[2]。研究发现,GERD具有病程长、复发率高等特点,可增加肺癌、食管癌、冠心病等多种疾病的发病风险,严重影响患者的身心健康和生活质量[3]。因此,积极防治GERD对公共卫生事业具有重大意义。本团队前期研究发现,背俞指针疗法治疗GERD疗效确切,可显著改善食管下括约肌压力及胃电节律,明显减少酸反流[4-6]。然而,该疗法治疗GERD作用的分子机制尚未完全明确。
食管、胃动力障碍是GERD的主要发病机制之一,而胃动力障碍与平滑肌结构、功能异常密切相关[7-9]。研究表明,胃平滑肌细胞内肌球蛋白轻链激酶(myosin light chain kinase,MLCK)通过使肌球蛋白调节性轻链(20kD Myosin light chain phosphorylation, MLC20)磷酸化,形成磷酸化肌球蛋白调节性轻链(phosphorylation 20kD Myosin light chain phosphorylation, PMLC20),从而活化肌球蛋白ATP酶,引起平滑肌的收缩,故MLCK- PMLC20信号通路在调控平滑肌细胞运动功能中起重要作用[10,11]。因此,本研究以GERD大鼠为研究对象,探讨MLCK-PMLC20信号通路异常是否为GERD的发病机制,并观察背俞指针疗法对该信号通路的影响,明确该疗法治疗GERD的分子作用机制。本研究已通过广西中医药大学实验动物伦理委员会审查,伦理学批准号DW20180101-25。
1 材料与方法
1.1 动物
适龄清洁级SD大鼠124只,雌雄各半,体质量220~250 g,购于湖南斯莱克景达实验动物有限公司,实验动物许可证号SCXK(湘)2016-0002。饲养于广西中医药大学第一附属医院动物实验中心动物房,温度20~25 ℃,相对湿度50%~65%。
1.2 主要试剂及仪器
荧光定量PCR试剂盒(货号RR047A、RR820A)TaKaRa公司;MLCK(货号bs-4705R)及PMLC2(货号bs-19149R)抗体,北京博奥森公司;IgG免疫组化试剂盒(货号SABC-POD),武汉博士德公司。
展烤片机TY-7FB(天津爱华);超速低温离心机1730R(美国 Sigma 公司);光学显微镜Olympus-BH2(日本Olympus公司);显微摄像仪 Olympus-C35AD-2(日本 Olympus 公司);病理切片机 LEICA RM2135(德国RM公司);分光光度计 722 型(四川仪表九厂);7000型荧光定量PCR仪(美国Applied Biosystems公司);紫外透射仪 ZF-90 (上海顾村电光仪器厂);紫外分光光度计 752型(上海精密科学仪器有限公司);图像分析系统Image-Pro Express(日本 Olympus 公司)。
1.3 造模及分组方法
将购回的124只SD大鼠进行标记,采用随机数字表法随机抽取30只作为空白组(开腹后不手术即缝合,无反流对照组),其余94只SD大鼠建立GERD模型。大鼠购回后适应环境7 d,手术前禁食24 h。采用经食管支架植入术造模[12]:大鼠麻醉后备皮,碘伏消毒术区后开腹,将钢圈 (直径0.31 mm, 内径3.5 mm, 长5~6 mm) 套在鞘芯上, 从口腔经食管送于贲门处, 先退出鞘芯再退出鞘, 用鱼线 (0.4号, 0.10 mm)将钢圈固定于贲门处, 腹腔内注入青霉素后关腹。空白组进入腹腔前的操作同模型组,开腹后使用0.9% NaCl溶液灌洗腹腔,缝合线逐层关腹。所有大鼠术后禁食24 h不禁水,4周后随机抽取4只大鼠的食管标本进行病理检测,明确造模成功后根据随机数字表法随机分为模型组、指针组及西药组各30只。
1.4 干预方法
1.4.1 西药组 西药组参考《动物与人体的每公斤体质量剂量折算系数表》[13]计算出每只大鼠干预所需剂量。给予枸橼酸莫沙必利分散片(成都康弘药业集团股份有限公司,批号H20031110,1.56 mg/kg)每日均分灌胃3次,每次1 mL;兰索拉唑肠溶片(汕头经济特区鮀滨制药厂,批号H10980136,3.125 mg/kg)每日均分灌胃2次。空白组和模型组给予等量纯水灌胃,各组均干预14 d。
1.4.2 背俞指针组 参照文献选取大鼠双侧足太阳膀胱经肝俞、胆俞、脾俞、胃俞穴,于每天上午9~11点进行干预[14]。先将大鼠固定于俯卧位,左手罩住头部,右手轻抚背部4 min。指针操作如下:不同穴位从上到下、相同穴位由左至右,对每个穴位进行相应点压、按揉等手法操作,刺激量以大鼠无挣扎为度,频率为120~160次/min,时间为3 min/穴,每只大鼠每天手法操作24 min,疗程为2周。干预前对相关人员进行2周培训,在电子天平仪上练习,力求达到按揉质量200~250 g、点压质量300~350 g的标准。
1.5 标本采集
实验周期结束大鼠禁食不禁水12 h后,采用放血法将麻醉(25%乌拉坦6 mL/kg腹腔注射)后大鼠处死,随后进行食管组织及胃组织标本取材,于食道贲门上缘处取出食管组织约3 cm,于大鼠胃窦处(距幽门约0.5 cm)取10×10×5 mm3的平滑肌条,切取实验所需的胃起搏区组织-80 ℃保存。
1.6 检测指标
1.6.1 各组大鼠一般情况 观察各组大鼠的精神状态、反应、毛色、粪便、饮食、饮水量等,观察各组大鼠存活率和手术造模伤口愈合情况。
1.6.2 光镜下观察食管中下段组织病理变化 各组均随机抽取8只大鼠作为观察样本,将取出的食管组织经HE染色后在光镜下观察组织的鳞状上皮、上皮细胞层、黏膜固有层的病理变化,并进行对比分析。
1.6.3 荧光定量PCR法检测胃起搏区组织MLCK mRNA的表达情况 取出胃起搏区平滑肌组织,切取实验所需量(30~50 mg),采用Trizol法提取总RNA,紫外-分光光度计测定所提取RNA浓度及含量,采用TaKaRa公司试剂盒行常规逆转录聚合酶链反应,逆转录所用的引物根据GenBank登录的MLCK核苷酸序列设计引物,委托宝生物工程(大连)技术服务有限公司进行合成,上游引物5’-GTGGTGGTAGCGGAGAGAAG-3’,下游引物5’-CCTTGTGGCCAGTTCATCCT-3’,引物长度为144bp。反应条件:预变性(94 ℃,5 min);变性(95 ℃,30 s);退火(60 ℃,30 s),延伸(72 ℃,30 s),共进行40个循环的扩增,以上反应流程均参照TaKaRa公司试剂盒说明书进行。反应完成后采用SYBRGreenⅠ法进行扩增产物定量检测,扩增反应于ABI 7000荧光定量PCR仪上进行,并采用2-ΔΔCT法比较各组MLCK mRNA表达水平的差异。
1.6.4 免疫组化法观察胃起搏区组织MLCK及PMLC20的表达 切取大鼠胃起搏区(胃体中部距贲门1/3处)组织约1.0 cm3,石蜡切片4 μm,烤片后脱蜡至水,高压抗原修复,依次滴加3%过氧化物酶阻断液(室温10 min)、5% BSA封闭液(室温30 min)、一抗(1∶300,4 ℃过夜),二抗(37 ℃孵育30 min)及SABC(37 ℃孵育30 min),DAB显色,苏木素复染,脱水透明,中性树胶封片。用已知阳性切片作阳性MLCK及PMLC20对照,用PBS代替一抗作阴性对照。每张切片随机选取5个视野,采用image-Pro图像分析系统,测定并计算出平均光密度值(mean optical density, MOD),用于各组MLCK及PMLC20表达水平的比较。
1.7 统计学方法
2 结果
2.1 各组大鼠一般情况
空白组大鼠反应敏捷,毛色光泽,粪便正常;模型组大鼠反应较迟钝,毛色无光泽,粪质干硬,每日饮食、饮水量稍减少,可见少量反流物;指针组及西药组大鼠反应较模型组敏捷,毛色较光泽,指针组大便正常,西药组大便偏烂。各组大鼠均无死亡,造模组大鼠伤口愈合良好。
2.2 GERD大鼠干预后食管中下段组织病理变化
图1示,各组食管黏膜组织病理变化,空白组食管黏膜组织形态正常,未见黏膜糜烂及溃疡,黏膜上皮未见增生,固有层未见炎性细胞浸润;模型组食管鳞状上皮基底细胞中度增生,基底细胞层增厚,固有层乳头延长,固有层内炎性细胞浸润,以嗜酸性粒细胞为主,细胞间隙增宽;指针组食管黏膜结构基本恢复正常,鳞状上皮修复完整,基底细胞呈单层排列,黏膜固有层未见明显的乳头增生及炎性细胞浸润;西药组食管黏膜结构基本恢复正常,黏膜固有层未见明显的炎性细胞浸润。
图1 各组大鼠食管黏膜中下段组织鳞状上皮、黏膜固有层、上皮细胞层病理变化比较(HE×200)
2.3 GERD大鼠干预后胃起搏区组织MLCK及PMLC20表达结果
剔除异常数据后,空白组、模型组、西药组、模型组分别纳入11、12、11、14个样本分析MLCK mRNA表达水平。表1示,与空白组比较,模型组大鼠MLCK mRNA表达水平明显降低(P<0.05);西药组与模型组比较差异无统计学意义(P>0.05);指针组较模型组及西药组明显升高(P<0.05)。
图2、3示,MLCK及PMLC20阳性表达细胞分布于胃起搏区组织内环外纵肌层间,呈棕黄色染色。表1示,与空白组比较,模型组MLCK及PMLC20的表达水平有所下降(P<0.05);与模型组比较,西药组及指针组MLCK及PMLC20的表达水平有显著上升(P<0.01);与西药组比较,指针组的MLCK表达水平降低(P<0.05),而西药组和指针组PMLC20表达水平差异无统计学意义(P>0.05)。
表1 MLCK mRNA、MLCK阳性产物及PMLC20阳性产物表达比较
图2 各组大鼠胃起搏区组织肌球蛋白轻链激酶(Myosin Light Chain Kinase,MLCK)免疫组化阳性表达(200×)
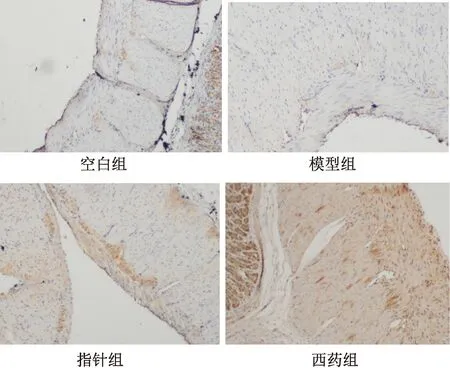
图3 各组大鼠胃起搏区组织磷酸化肌球蛋白调节性轻链(Phosphorylation 20kD Myosin light chain phosphorylation,PMLC20)免疫组化阳性表达(200×)
3 讨论
目前国内大部分学者认为,GERD的基本病机为脾胃升降功能失常,胃气上逆[15]。本团队多年来致力于GERD的实践与研究,认识到“脾胃气机失衡是GERD发病的表象,而任督二脉经气升降交会失衡是脾胃升降失衡GERD的病机本质”[16,17]。督脉为阳脉之海,与膀胱经交会于大椎等穴位及巅顶部,故膀胱经之经气可通诸阳之会,调达一身之阳气。背俞穴是五脏六腑之精气输注于膀胱经上的穴位。本团队前期研究发现,在背俞穴处施予背俞指针疗法可调节任督二脉经气的交会,改善多个脏腑的功能,从而达到治疗GERD的目的[4-6]。基于此,笔者团队提出“以俞调枢”的观点,构建了“以俞调枢”理论体系[16,17]。同时前期临床研究表明,背俞指针疗法可以促进胃肠收缩及蠕动,降低食管括约肌压力和减少酸反流,治疗GERD效果确切[4-6]。本次研究的病理结果显示,与模型组比较,指针组食管黏膜结构基本恢复正常,食管组织炎症消失,提示背俞指针疗法可以改善GERD模型大鼠的食管黏膜病理改变,促进炎症消退。这可能与此疗法能调节任督二脉穴位的皮温,调节二脉经气的交会,进而改善脾胃之气机升降功能有关[18]。
MLCK是一种广泛表达的丝氨酸/苏氨酸激酶[19]。MLCK使肌球蛋白调节性轻链磷酸化并控制骨骼肌、平滑肌和心肌的收缩[20]。胃排空障碍与胃平滑肌收缩密切相关。在调节平滑肌收缩机制中, MLCK可使 MLC20磷酸化,磷酸化后的MLC20为PMLC20,可以使肌球蛋白ATP酶活化,触发肌动蛋白-肌球蛋白交叉桥接机制,引起平滑肌的收缩。在平滑肌的MLCK-PMLC20通路中,MLC20磷酸化水平在一定程度上决定着平滑肌收缩的功能。MLC20磷酸化的程度取决于MLCK活性,而MLCK mRNA是合成MLCK的模板[20]。本研究发现,模型组大鼠在胃起搏区的MLCK mRNA、MLCK及PMLC20蛋白表达水平均低于空白组大鼠,说明GERD大鼠胃动力障碍可能与MLCK及PMLC20表达量降低有关,且与其他胃动力障碍性疾病大鼠模型的胃平滑肌MLCK和PMLC20表达水平变化相一致[21-23]。
本次研究中,干预后指针组中MLCK mRNA水平较模型组升高,且MLCK及PMLC20阳性蛋白表达均高于模型组,说明背俞指针疗法能上调GERD大鼠胃起搏区MLCK mRNA、MLCK及PMLC20阳性蛋白表达,从而达到治疗GERD的目的。于上午脾经当令之巳时(9~11点)进行背俞指针疗法,可激发膀胱经经气, 从而使任督二脉经气升降交会,以恢复脾胃之气机升降,调畅五脏六腑脏腑枢机,恢复MLCK-PMLC20通路的“枢机”。结合病理结果说明,背俞指针疗法治疗GERD可能是通过上调胃起搏区MLCK mRNA、MLCK及PMLC20这一机制起作用。然而,西药组的MLCK mRNA表达与模型组比较差异无统计学意义,其蛋白表达水平却高于模型组,说明2组虽然以同等水平mRNA为模板合成的MLCK没有增加,但是用药后可能使合成MLCK的其他相关因子增加,或者使蛋白相较模型组分解减少,从而提高西药组MLCK的表达,具体机制尚未明确。西药组的MLCK蛋白表达水平高于指针组,但是最后2组间的PMLC20蛋白表达水平无明显差异,可能与指针组还能通过其他途径增加MLC20磷酸化有关,值得进一步探讨。
综上所述,GERD的发病可能与MLCK mRNA、MLCK、PMLC20蛋白表达水平下降有关。背俞指针疗法可明显改善GERD大鼠食管病理改变,其机制可能与上调MLCK mRNA、MLCK、PMLC20蛋白表达水平有关。然而目前尚有许多问题,如背俞指针疗法是如何上调MLCK mRNA及其蛋白表达,其是否会通过除MLCK的其他通路影响MLC20磷酸化,均有待今后进一步的研究。
