鱼腥藻藻华水体一株溶藻菌BWFA55的鉴定及溶藻特性
2021-12-24范德朋胡亚冬杨敏志雷明科
范德朋,胡亚冬,杨敏志,雷明科,王 琦
鱼腥藻藻华水体一株溶藻菌BWFA55的鉴定及溶藻特性
范德朋1,2,胡亚冬1,2,杨敏志2,雷明科1,王 琦3
(1. 碧沃丰生物科技 (广东) 股份有限公司,广东 佛山 528200;2. 碧沃丰工程有限公司,广东 佛山 528200;3. 广东海洋大学水产学院,广东 湛江 524088)
【】鉴定一株鱼腥藻藻华水体的溶藻菌,分析菌株的溶藻特性。从佛山近郊湖泊鱼腥藻水华水体中分离到一株溶藻菌BWFA55,通过菌株生理生化鉴定和16S rDNA 基因序列分析鉴定菌种。将该菌株培养4 d,分析菌株的生长特征和溶藻活性。将BWFA55发酵上清液与水华鱼腥藻()共培养168 h,通过扫描电镜观察藻细胞形态。将BWFA55菌悬液接种至不同浓度的水华鱼腥藻()藻液,另按不同接种量将BWFA55接种至同浓度藻液,分析藻液浓度及接种量对溶藻效果的影响。测定BWFA55无细胞上清液、菌体悬液、菌株原发酵液的溶菌活性,分析BWFA55的主要溶藻方式。采用透析和有机溶剂萃取分离溶藻物质,在不同温度、pH条件下研究溶藻活性物质的特性。经鉴定,溶藻菌株BWFA55为地衣芽孢杆菌()。该菌株24 h发酵液的溶藻活性最高,在接种量(体积分数)为10%的条件下,水体中水华鱼腥藻的叶绿素a(Chl-a)含量在7 d内下降80%以上。该菌通过分泌溶藻化合物间接攻击水华鱼腥藻,使丝状群体的藻细胞数量明显降低,群体连接结构被破坏。BWFA55主要的溶藻活性物质存在于发酵上清液中,分子质量大于3 ku,且可被乙酸乙酯萃取,在高温下保持60%以上的溶藻率,且不受pH影响,有良好的酸碱、温度耐受性。
水华;水华鱼腥藻;芽孢杆菌;溶藻细菌
近年来,由水体富营养化引起的有害藻华(Harmful Algal Blooms,HAB) 时有发生,严重破坏水生环境。学界试图理清HAB的暴发及衰退与诸如营养物质、光照、温度以及生物因素等环境条件之间的联系[1-2]。在HAB动态发展过程中往往伴随明显的细菌群落交替[3-6],尤其是红细菌目、黄杆菌目和假单胞菌目等通常与藻华有关[5,7-8]。这些细菌促进或抑制HAB相关物种的生长,通过共生或相互竞争方式调节藻华形成、持续时间和衰退[7,9-11]。在藻华衰退阶段细菌丰度往往增加[12],表明部分细菌可能介导HABs的周期性交替,尤其在营养资源有限时,甚至导致藻类细胞死亡[7]。虽已证实溶藻细菌与目标藻类的共存现象[13],但细菌调节HABs的动力学过程以及相应的细胞和分子机制仍有待探索[8]。
溶菌细菌与有害藻类间的关系极为复杂[14-15],其在调节有害藻类生长、代谢和毒素产生方面有潜在作用[14,16],最突出和最重要的作用是抑制或溶解有害藻类[17]。目前已分离大量的溶藻细菌,多属于假交替单胞菌属()、交替单胞菌属()、弧菌属()、噬细胞菌属()和腐螺旋菌属()。目前,有害藻类主要是甲藻、硅藻和蓝藻[14-15,18]。目前,已提出几种物理和化学方法应对HAB的暴发,但这些方法不仅代价高昂,且可能对水生生态系统有害[19]。以溶藻微生物为代表的生物防治方法有经济、实用、物种特异性和环境友好性等特点[20-21]。本研究从佛山南海区近郊湖泊的鱼腥藻水华中分离鉴定出一株溶藻细菌,并研究该溶藻细菌的溶藻效果及其溶藻机理,为蓝藻水华的防治提供参考。
1 材料与方法
1.1 藻种、菌种及其培养条件
水华鱼腥藻()FACHB-245取自中国科学院水生生物研究所淡水藻种库。藻类细胞用无菌BG11培养基(青岛海博生物技术有限公司),在光暗周期为12 hL/12 hD、照度为2 000 lx、温度为(30±1)℃的光照培养箱中培养。
实验菌株BWFA55分离自佛山潭边村有鱼腥藻水华的景观池(23.174°N,113.126°E)。用新鲜的营养肉汤培养基[Nutrient Broth (NB),广东环凯生物科技有限公司]与15 mg/mL的琼脂制成固体斜面培养基,将BWFA55接种于固体培养基上,30℃下培养1 d得到菌种斜面。从新制备的菌种斜面上挑取菌落接种于营养肉汤培养基,于恒温震荡箱(30℃、150 r/min)中培养,得到该菌株的发酵液。
1.2 细菌菌株鉴定
取1 mL培养16 ~ 20 h的待测菌液,采用酚氯仿法提取纯菌总DNA。以所提取DNA作为模板,用16S rDNA通用引物对细菌基因组进行PCR扩增。其上游引物为27F (5′-AGAGTTTGATCCTGG CTCAG-3′),下游引物为1492R (5′-GGTTACCTT GTTACGACTT-3′)。扩增条件:95℃5 min;95℃40 s,55℃1 min,72℃1 min,循环25次;72℃10 min。PCR产物在约1 500 kb处有条带者为阳性。将阳性样品送至广州艾基生物科技有限公司测序。用Chromas判断16S rDNA测序结果的序列有效长度,并通过BioEdit将序列剪切和拼接完整。将拼接后序列通过Eztaxon网站进行同源性分析。下载与待测菌株最相近的模式菌株16S rDNA序列,利用ClustX和MEGA6软件对待测菌株序列及下载序列进行对齐剪切[22],采用Neighbor-Joining法构建系统进化树[22],用重样抽样法(Bootstrap)计算出进化树各分支置信度。根据系统发育树确定待测菌株的进化位置。
用API 50 CHB/E试剂盒(法国生物梅里埃)对BWFA55进行不同碳源的生化分析。培养期间,糖发酵产酸,pH下降,因而以指示剂颜色变化表示菌株对不同碳源的利用情况,组成该菌株的生化图谱,导入bioMerieux软件进行菌株鉴定或分型。
1.3 藻密度与Chl-a浓度的相关性分析
取长势良好的水华鱼腥藻,用培养基BG11配制成5个不同水平倍增藻密度的藻液,分别采用细胞计数法和Chl-a含量测定法测定藻细胞的丰度。鉴于水华鱼腥藻藻体为单一丝状,或不定形胶质体,采用细胞计数方法易造成较大的偶然误差,根据以上2种测定方法的结果,以细胞密度对Chl-a含量进行线形回归分析,以探究藻密度与Chl-a浓度的相关性。
1.4 细菌菌株的生长特性和溶藻活性
BWFA55按照1.1节菌种培养方法培养4 d。用紫外-可见分光度计定时测量600 nm的光密度(600 nm),监测细菌生长。
采集BWFA55各阶段生长的菌液,按体积分数10%接种到Chl-a质量浓度为(3 178.16±146.92)μg/L的水华鱼腥藻培养液中,按照1.1节水华鱼腥藻培养方式进行光照培养,定期取培养液,用热乙醇法提取Chl-a,测定663、647、630、750 nm处光密度值,计算Chl-a浓度,并根据下式计算溶藻率(%)。以培养7 d的溶藻率表征溶藻活性,并以相同体积NB作为对照。
溶藻率= (0-ρ) /0, (1)
式中,ρ和0分别为时间和初始Chl-a质量浓度。
后续相关实验均以培养24 h的发酵液,用BG11培养液将发酵液稀释至(600 nm) 为1.0,作为统一的菌浓度。BWFA55上清液则是将上述稀释后的发酵液以10 000 r/min、室温条件离心10 min,收集离心上清液制得。
1.5 藻浓度及接种量对溶藻效果的影响
按1.4节方法配制(600nm)为1.0的BWFA55悬液。取培养至稳定期的水华鱼腥藻(培养条件见1.1节),以BG11培养液依次稀释成(710.89±27.13)、(1 440.84±77.76)、(2854.77 ± 120.50)、(7139.62 ± 90.22)、(13 772.57 ± 571.70)μg/L,分别记为I、II、III、IV、V组。各组分别按体积分数10%接种BWFA55悬液;另取BWFA55悬液按体积分数1%、5%、10%、20%的接种量添加至对数生长期的水华鱼腥藻培养液 [初始Chl-a质量浓度为(965.00 ± 9.81)μg/L] 中。按照1.4节方法测试各组溶藻活性。
1.6 BWFA55的溶藻方式
BWFA55按照1.1节菌种培养方法培养24 h。发酵液以转速4 000 r/min离心20 min,收集上清液和沉淀。离心上清液用0.22 μm滤膜过滤收集无细胞上清液。沉淀用BG11培养液重悬得到细菌悬液。按照1.4节的方法分别测定发酵液、无细胞上清液、菌体悬液、NB和BG11培养基的溶藻活性。其中NB组作为控制对照组, BG11组作为空白对照。每组设3个平行。溶藻活性测试的初始藻细胞Chl-a质量浓度为(968.69 ± 21.24) μg/L。比较BWFA55发酵液及其无细胞上清液和细菌菌体的溶藻活性,以判断菌株BWFA55的主要溶藻方式是产生的代谢产物,还是微生物与藻竞争营养或者侵染破坏藻细胞结构。
1.7 BWFA55上清液作用下的藻细胞形态观察
将溶藻菌BWFA55上清液按体积比10%加至水华鱼腥藻藻液中,加入等体积NB培养基组为空白对照组,每组样本设置3个平行,按1.1节藻培养方式培养168 h后取样,以10 000 r/min、室温条件离心10 min,收集细胞,用0.1 mol/L 磷酸盐缓冲液(PBS,pH 7.4)洗涤3次,重悬于体积分数2.5%戊二醛溶液中,置于4℃下12 h以上。以10 000 r/min、室温条件离心10 min,收集细胞,用PBS洗涤2次,分别在体积分数30%、50%、70%、90%、95%、100%乙醇,以及乙醇、叔丁醇体积比为2∶1、1∶1、1∶2的溶液中依次脱水3次,每次脱水10 min。置于4 ℃下12 h以上,用真空冷冻干燥机干燥样品。将样品表面镀金,于扫描电镜下观察藻细胞形态。
1.8 BWFA55上清液的溶藻稳定性测定
按1.4方法制备的BWFA55上清液在-40、0、40、60、80和100水浴2 h,同时用高压灭菌锅在121℃高温处理2 h,恢复至室温 (25℃)。用2 mol/L的HCl或NaOH将BWFA55上清液的pH值调整为4、5、6、7、8、9、10和11,在室温下维持2 h,调整为pH 7.2 (原pH值)。所有处理的上清液均以体积分数10%接种到水华鱼腥藻藻液中,按1.7方法测定其溶藻活性。NB经与BWFA55上清液相同的处理后作为对照。
1.9 溶藻物质的乙醇沉淀、萃取及透析
取按1.4节方法制备的BWFA55上清液50 mL,加入150 mL无水乙醇,常温下静置10 min,以转速4 000 r/min离心20 min,收集上清液和沉淀。取离心的上清液,经65℃真空旋蒸浓缩至50 mL,重复上述加乙醇、静置、离心和真空旋蒸浓缩的步骤3次。浓缩液继续真空蒸发至干后,用少量蒸馏水溶解残留固体,得溶解相。将上述各沉淀用蒸馏水溶解后合并,经65 ℃真空蒸发掉残留的乙醇,得沉淀相。用无菌水定容到相同体积,采用1.4的方法测定比较两相的溶藻效果,测试的初始Chl-a质量浓度为(3 022.90 ± 234.12)μg/L。
将BWFA55上清液冷冻干燥,依次加入一倍体积的石油醚、乙酸乙酯、正丁醇,反复萃取3次,每次静置30 min,分别收集水相与有机相,经65℃真空旋蒸浓缩,用无菌水定容至原体积,采用1.4节方法测定溶藻效果。将乙酸乙酯萃取得到的溶藻物质于100 ~ 500 u(截留物质分子质量)的透析袋中除盐,转入3 ku的透析袋中,于20倍体积的BG-11缓冲液中,震荡透析3 h,连续3 ~ 5次,合并透析液,将100 ~ 500 u和3 ku两次透析的透析液分别浓缩,采用1.4节方法测定溶藻效果。
1.10 数据整理与统计分析
采用Excel 2013、SPSS 19.0分析数据,所有数据均用单因素方差分析 (One-way ANOVA) 方法。用GraphPad Prism 8.0.2绘图。
2 结果
2.1 溶藻细菌的鉴定
菌株BWFA55经16S rDNA序列扩增,获得1 451 bp的片段。将BWFA55 16S rDNA基因序列与EzBioCloud数据库中16S rDNA基因序列进行同源性检索,所得邻接法系统发育树(图1)显示,BWFA55与地衣芽孢杆菌()在同一分支,自展值为96,结果可靠。与BWFA55亲缘关系最近的是F 6,相似性为99.85%。将49种碳源利用结果(表1)与梅里埃的API芽孢杆菌鉴定数据库进行比对,结果表明BWFA55为地衣芽孢杆菌,同源性为99.20%。
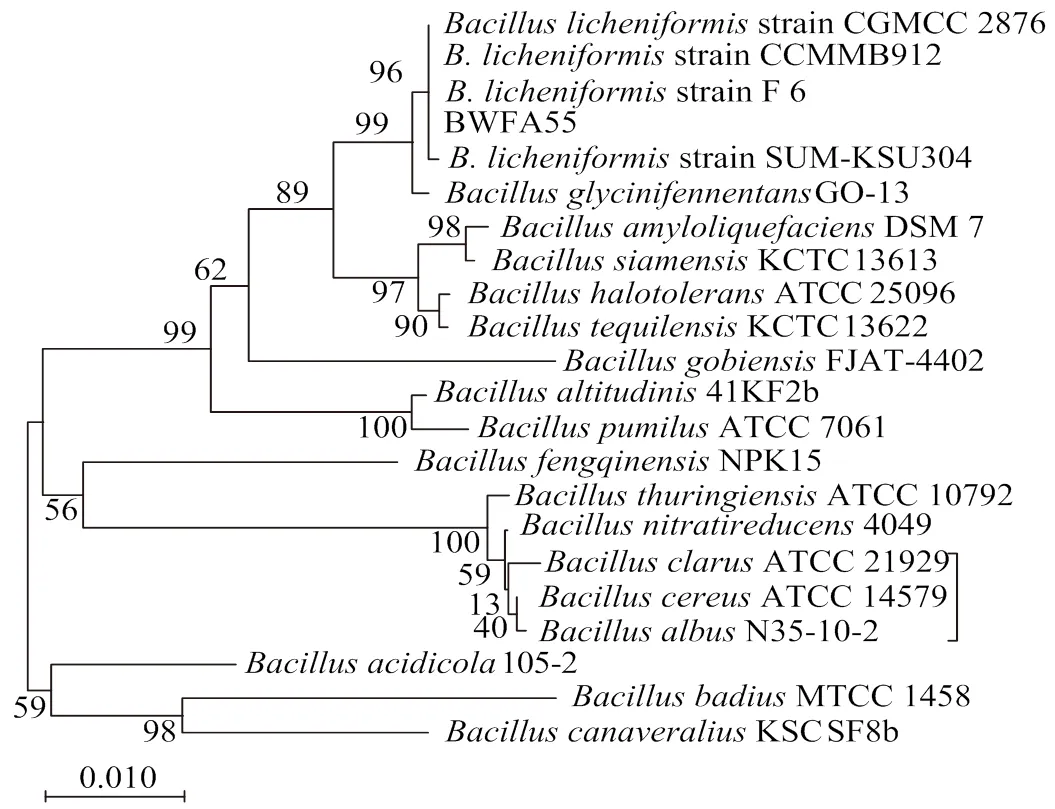
图1 基于16S rDNA序列的邻接法系统发育树
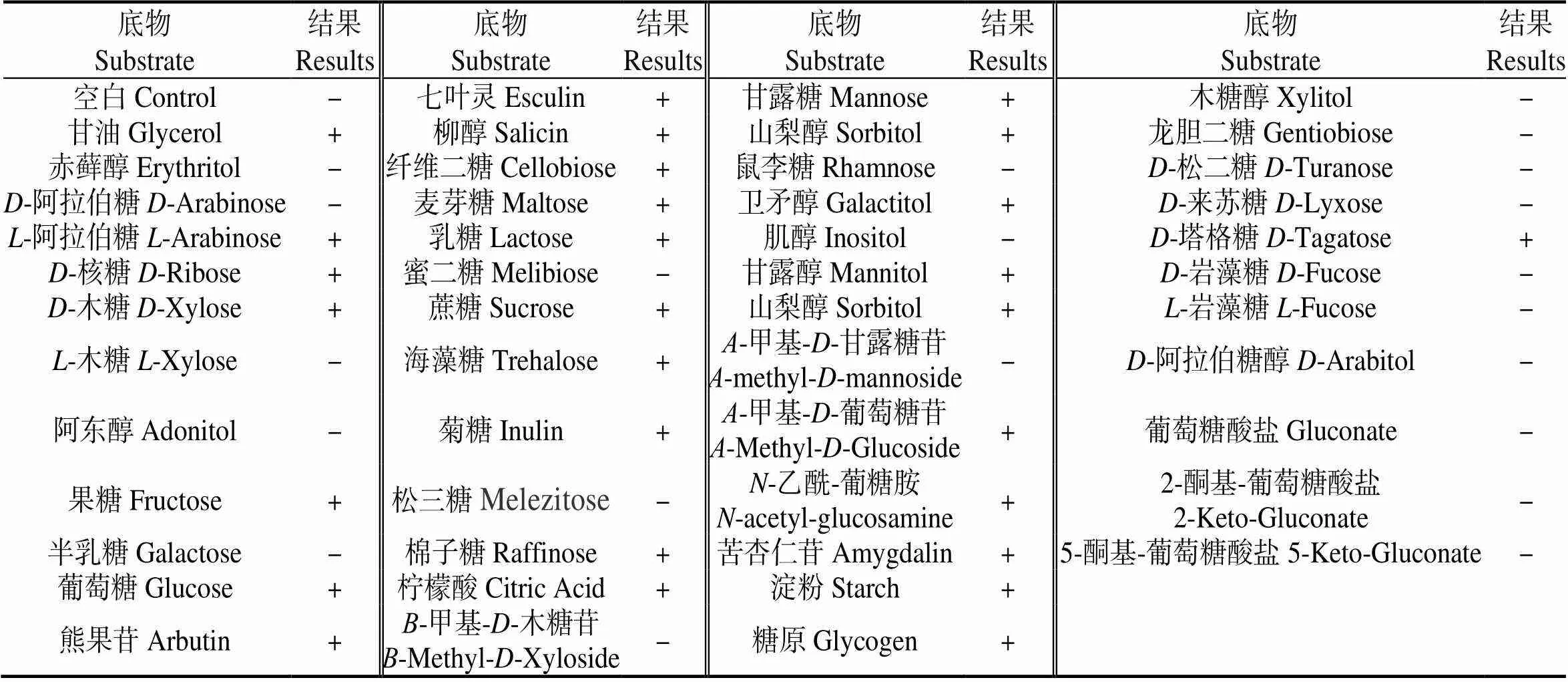
表1 菌株BWFA55的碳源利用结果
说明:-,阴性;+,阳性。
Notes: -, negative; +, positive.
2.2 藻密度与Chl-a浓度的相关性
图2显示,藻密度与Chl-a浓度的线性回归关系良好(2= 0.997 3),故以Chl-a浓度表征藻细胞生物量,通过计算Chl-a浓度变化表征溶藻率。
2.3 细菌菌株的生长特性和溶藻活性
BWFA55的生长曲线(图3(A))显示,溶藻菌在接种24 h后进入稳定期。不同发酵时间BWFA55发酵液溶藻活性的结果表明,各时间段的发酵液在与水华鱼腥藻共培养7 d后均表现出溶藻活性(图3(B)),且发酵24 ~ 48 h的发酵液溶藻效果最佳,为88.44% ± 1.29%和83.32% ± 3.00%,两者间无显著性差异,发酵时长超过48 h时,溶藻活性明显下降(<0.05),96 h时为58.65% ± 4.78%。
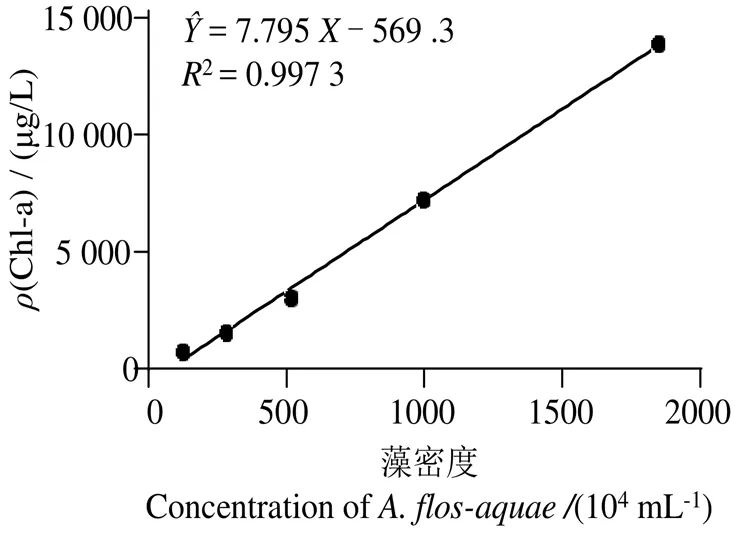
图2 水华鱼腥藻细胞密度与质量Chl-a浓度之间的关系
Fig. 2 Relationship between algal density and Chl-a mass concentration
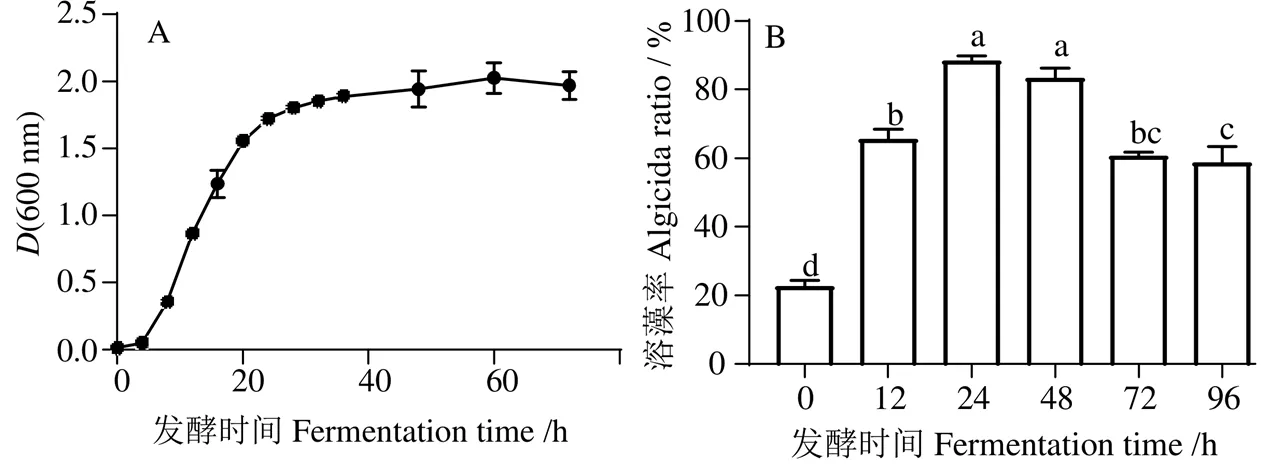
凡含一个相同字母则表示差异不显著(P > 0.05)
2.4 BWFA55上清液作用下藻细胞的形态变化
扫描电镜(SEM)观察结果(图4)显示,正常水华鱼腥藻细胞腰鼓形,单一丝状体,表面平滑,细胞完整(图4(A、B、C))。与BWFA55共培养168 h后,藻细胞形态发生明显变化。丝状群体的藻细胞数量明显降低,群体连接结构被破坏(图4(D、E)),细胞表面皱缩,细胞壁下陷,细胞膜破裂,细胞内含物外溢(图4(F、G、H、I))。
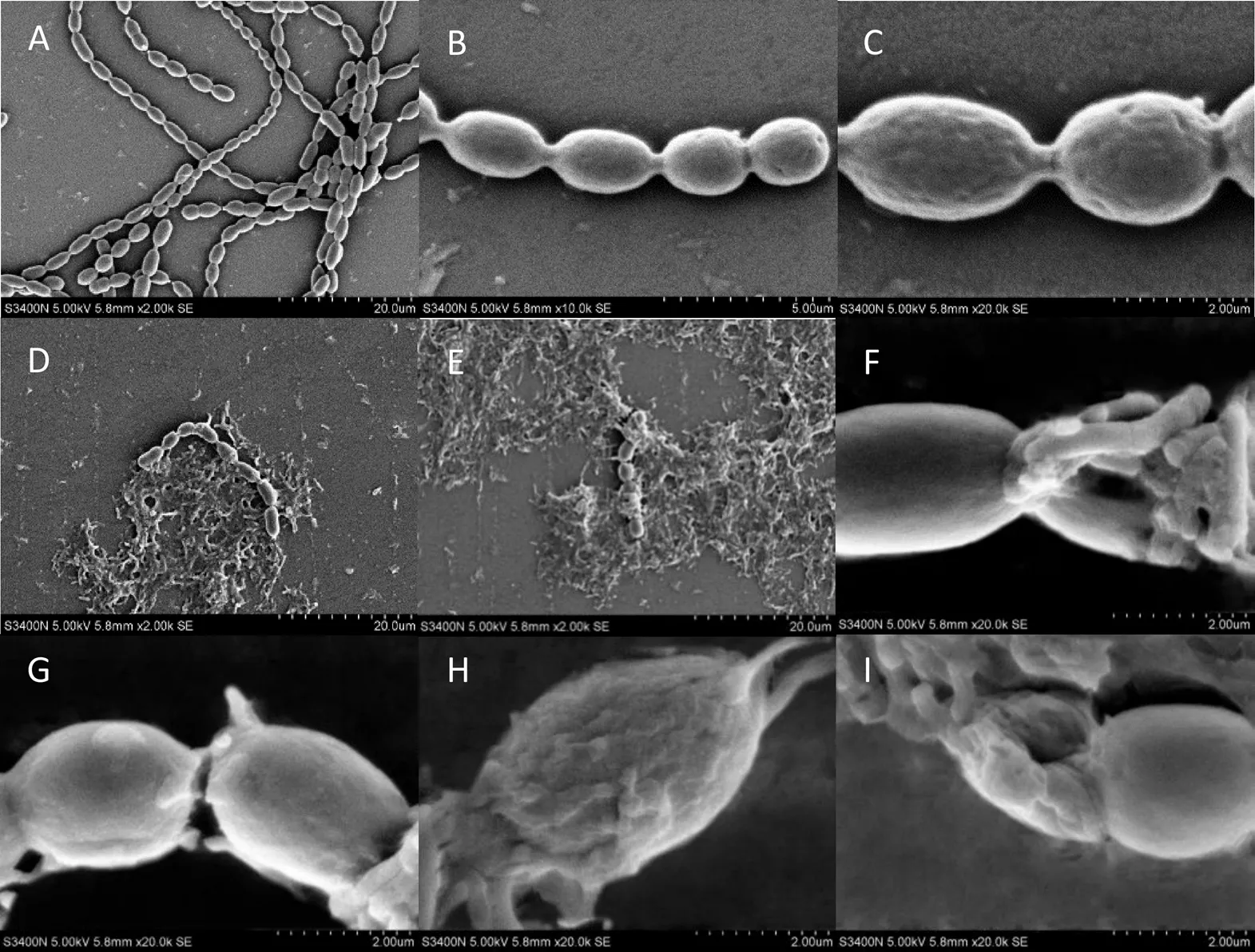
A – C,正常藻细胞;D – I,共培养168 h后的藻细胞。
2.5 BWFA55发酵液接种量及藻初始浓度对溶藻效果的影响
图5显示,接种量1%(体积分数)处理组藻细胞Chl-a浓度变化与空白组(CK)相近,在7 d时,两者Chl-a质量浓度分别为(3 472.59 ± 116.7)μg/L和(4 124.56 ± 179.38)μg/L,1%处理组有一定抑制作用;接种量5%、10%、20%处理组藻细胞Chl-a浓度前2 d变化趋势与对照组相近,3 d后有明显抑制作用,共培养7 d时Chl-a质量浓度从 (965.76 ± 11.15) μg/L分别降至 (197.71 ± 52.73)、(74.35 ± 21.32)、(97.33 ± 15.79) μg/L,溶藻效果显著(< 0.05),溶藻率分别为78.98% ± 6.56%、90.72% ± 1.35%和89.81% ± 2.46%。基于溶藻效果与应用可行性,选用体积分数10%的接种量开展下一步研究。
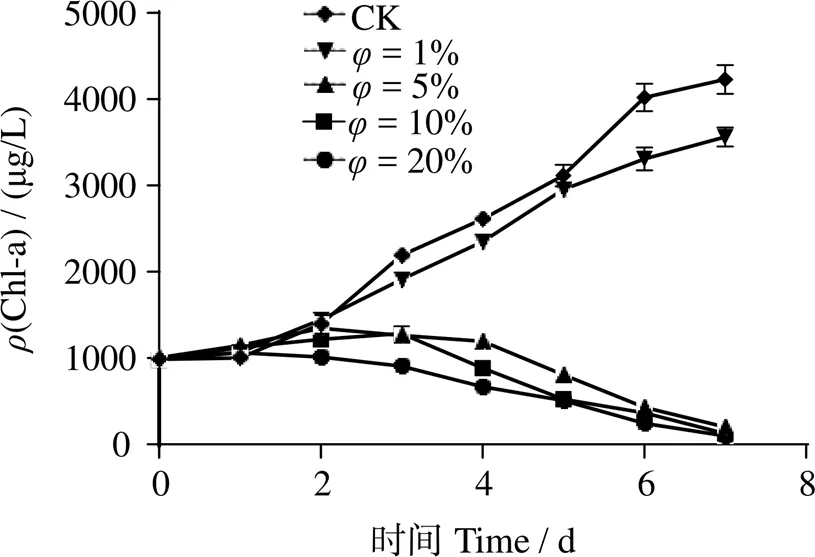
图5 不同体积分数BWFA55发酵液的溶藻活性
由图6可知,上清液体积分数为10%时,溶藻效果均显著高于对照组(< 0.05),且在初始Chl-a质量浓度较高时 [≥(1 440.84±77.76) μg/L] 溶藻效果随初始Chl-a质量浓度的增加而降低(< 0.05)。5个处理组在7 d时的溶藻率依次为78.01% ± 0.74%、88.10% ± 0.45%、75.12% ± 1.00%、62.57% ± 2.27%、54.96% ± 0.70%。NB对水华鱼腥藻也呈现一定溶藻效应,但溶藻效果随着初始藻浓度的升高逐渐降低,当初始Chl-a浓度为13 772 μg/L时,溶藻率为-10.14% ± 0.61%。各处理组溶藻率与各NB对照组均有显著差异(< 0.05)。
2.6 BWFA55的溶藻方式
图7为不同试验组与水华鱼腥藻共培养7 d的溶藻效果。图7 (A)表明,菌体重悬液与空白对照组(BG11)的Chl-a浓度均呈上升趋势,菌体重悬液组5 ~ 7 d Chl-a浓度低于空白对照组,说明菌体悬液无明显的溶藻作用,对藻的生长有一定抑制作用。控制对照组(NB)、无细胞上清液组和原发酵液组Chl-a浓度均呈下降趋势,说明这3个组分有溶藻作用,其7 d溶藻率见图7 (B),无细胞上清液的溶藻率是原发酵液的90.3%,说明发酵液的溶藻作用主要通过其上清液起作用。同时NB培养基虽有一定的溶藻作用,但远低于无细胞上清液,说明BWFA55发酵过程中产生胞外代谢产物有较强的溶藻作用。综上,BWFA55的主要通过分泌溶藻物质达到溶藻的效果。
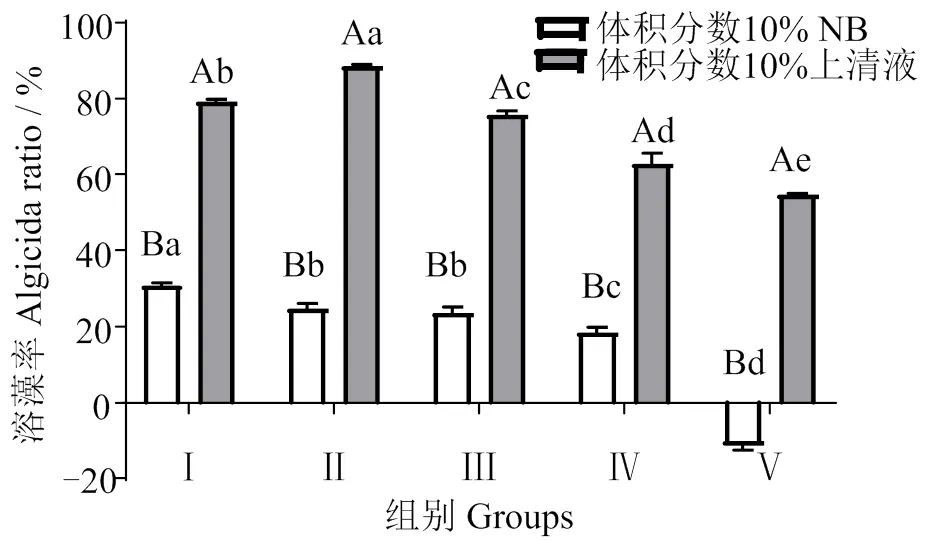
凡含一个相同字母,则差异不显著(P > 0.05),大写字母表示不同处理样品间的差异,小写字母表示不同初始Chl-a浓度组间的差异;Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ组初始Chl-a质量浓度分别为(710.89 ± 27.13)、(1 440.84 ± 77.76)、(2 854.77 ± 120.50)、(7 139.62 ± 90.22)、(13 772.57 ± 571.70)μg/L。
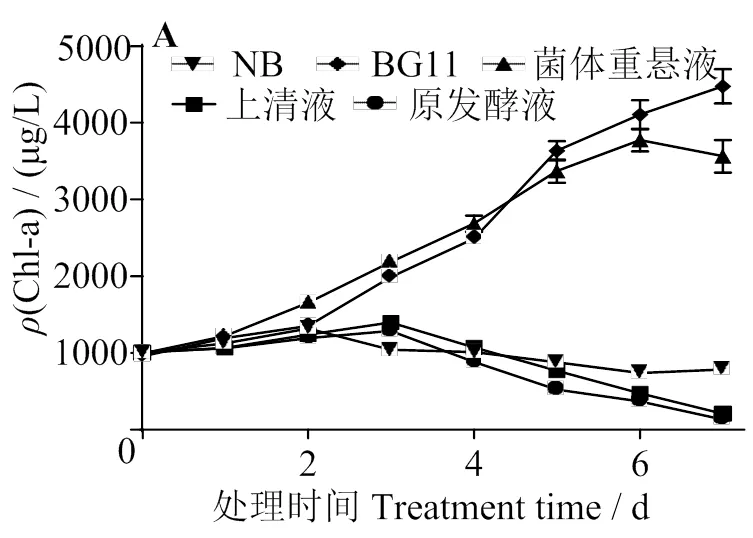
2.7 BWFA55上清液的溶藻稳定性
图8显示,不同温度和pH处理后的BWFA55上清液,其溶藻率均远高于同样浓度的NB培养基。由图8(A)可知,-40 ~ 40 ℃处理后溶藻活性无显著变化,40℃后溶藻活性有所下降,但121℃处理仍保留0℃处理的81.9%±3.0%,说明BWFA55上清液中的主要溶藻物质有较高的热稳定性。由图8(B)可知,不同pH条件处理后,各组溶藻活性保留pH 7时的96.6% ~ 99.9%,说明BWFA55上清液中的主要溶藻物质有较好的酸碱耐受性。
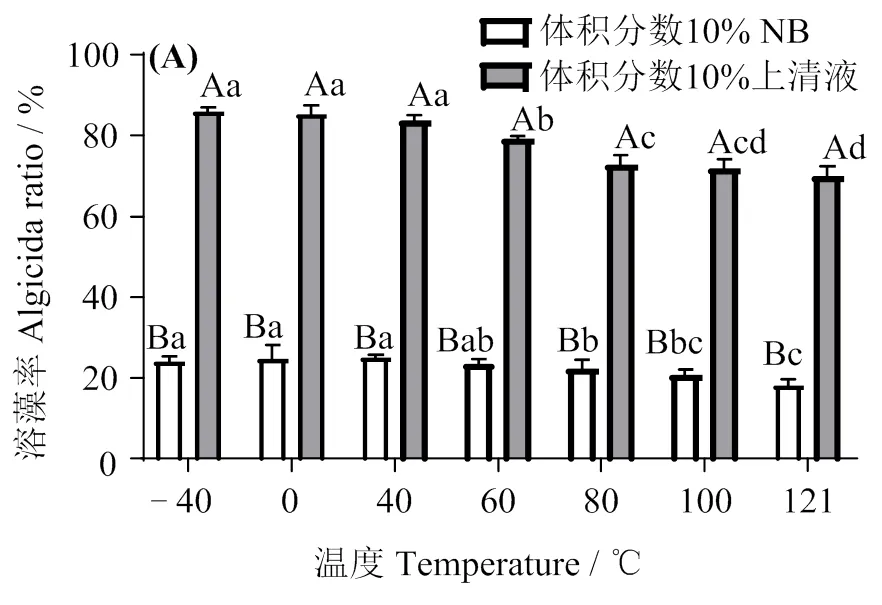
凡含一个相同字母,则差异不显著(> 0.05),大写字母表示不同处理样品间的差异,小写字母表示不同温度或pH间的差异
The data with a same letter indicate no significant difference between them (> 0.05), and the capital letters indicate the difference from treated samples, and different small letters indicate the difference from different temperature or pH
图8 BWFA55的溶藻热稳定性(A)和酸碱稳定性(B)
Fig. 8 Algicidal thermostability (A) and pH stability (B) of BWFA55
2.8 溶藻物质的乙醇沉淀、萃取与透析
图9表明,沉淀相比溶解相溶藻效果更佳,沉淀相溶藻率为63.57%±3.36%,溶解相为13.50% ± 3.11%,溶藻活性物质不能用乙醇沉淀法完全分离。
图10表明,石油醚、乙酸乙酯和正丁醇有机相处理组的叶绿素a质量浓度分别为 (3 460.63 ± 61.83) μg/L、(1 185.83 ± 44.01) μg/L和(2 251.95 ± 66.52)μg/L,水相叶绿素a质量浓度降至(2 629.51 ± 109.62) μg/L,表明乙酸乙酯可有效萃取溶藻物质,溶藻率为60.77% ± 1.46%。
乙酸乙酯萃取的各分子质量溶藻物质的溶藻效果如图11所示。图11可见,主要溶藻物质被截留在3 ku的透析袋中,溶藻率为72.43% ± 1.82%。
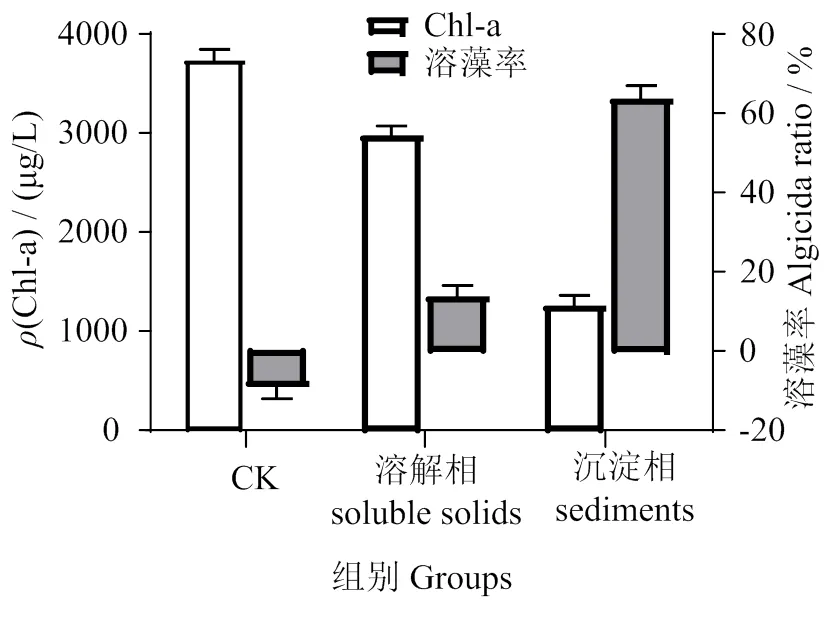
图9 溶解相和沉淀相的溶藻活性
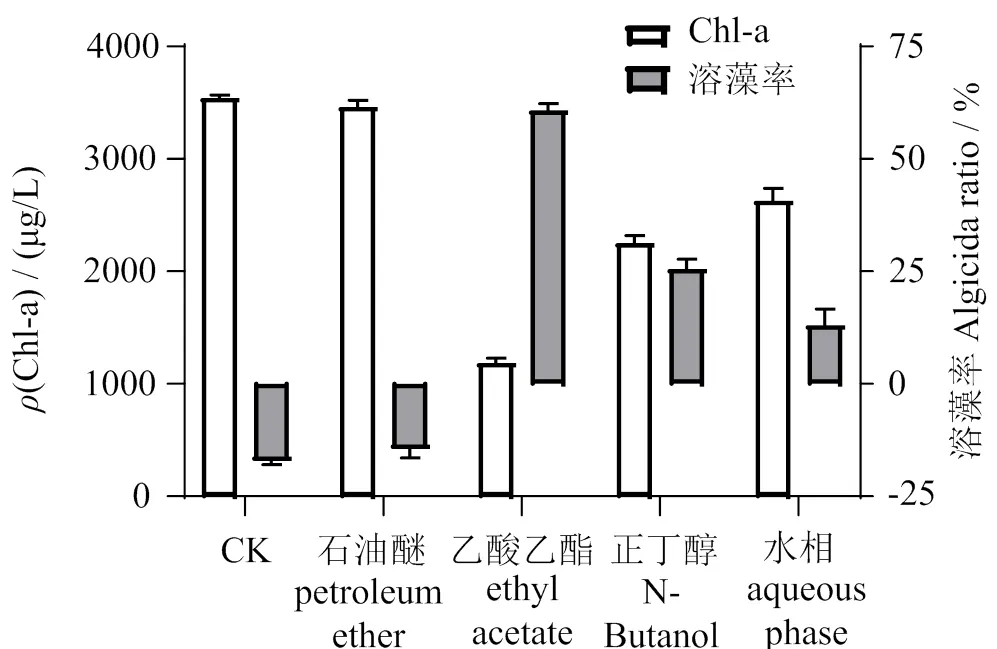
图10 有机溶剂萃取对溶藻效果的影响
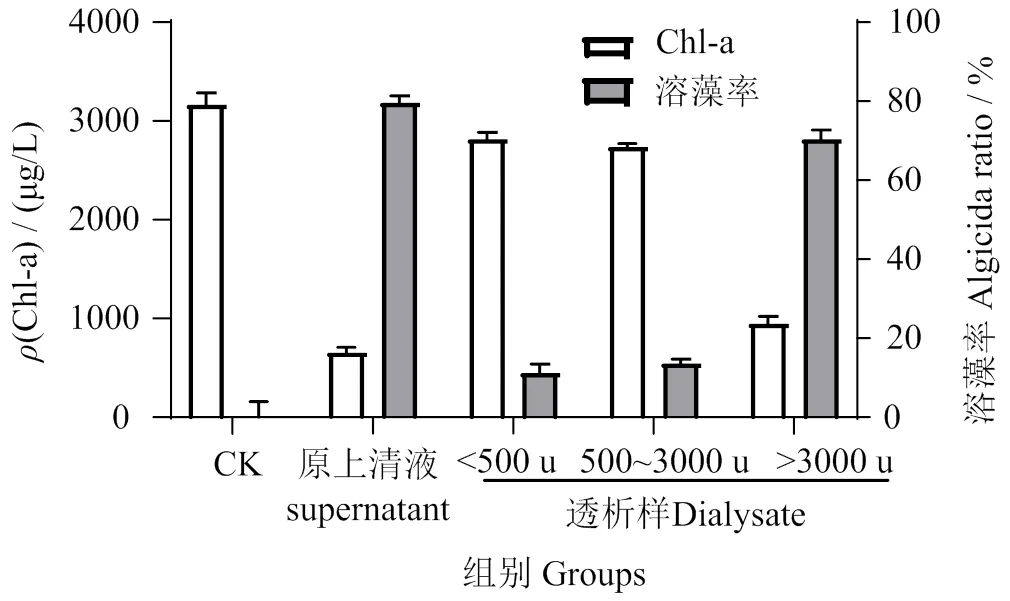
图11 无菌上清液和透析样的溶藻效果
3 讨论
近年来,由于社会经济和工业的迅速发展,大量氮磷无序排放导致江河湖泊有害藻华频发,不仅造成巨大的经济和生态损失,藻类毒素也通过食物链严重威胁着人类健康,因此迫切需要有效、环保的方法来控制有害藻华。研究表明,有害藻华提供了利于细菌生长繁殖的微环境[3,23]。而这些细菌的某些类群可抑制藻华物种生长[8],有效去除水体中的藻华物种[24,25],导致有害藻华衰退,因此是控制藻华的优选手段[17, 22]。
地衣芽孢杆菌()可产生氨基酸类、核酸类、脂类、磷酯类、多烯类等多种抗生素物质,对多种动植物和人类病原菌有良好的抑制作用[26],有应用于调节HAB的潜力。目前,关于地衣芽孢杆菌抑制蓝藻生长鲜有报道。水华鱼腥藻是原核生物,因此其对BWFA55的代谢产物应有敏感性。本研究中,水华鱼腥藻与BWFA55共培养过程中,其丝状群体的藻细胞数量明显降低,群体连接结构被破坏,随着藻细胞壁和细胞膜的破裂,藻细胞内含物外溢,细胞死亡,与细菌S7[27]对水华鱼腥藻的溶藻过程类似。
本研究中,BWFA55发酵液对水华鱼腥藻有良好的抑制作用,菌体重悬液也表现出一定的抑制作用,可能由BWFA55菌体与水华鱼腥藻竞争水体中的营养成分所致;上清液的溶藻率略低于原发酵液,均显著高于NB组(< 0.05),表明溶藻活性物质主要存在于上清液中,间接抑藻。BWFA55抑藻作用与菌液添加量呈正相关,但10%添加量的抑藻率与20%相差不大,说明溶藻活性物质有一定的抑藻饱和浓度。
细菌的次级代谢产物类型较多,有抑藻能力的胞外物质有蛋白质、脂肪酸、多糖、色素等[28-32]。有报道称,细菌的胞外抑藻物质为大分子物质,张小倩等[33]发现,短短芽孢杆菌(Brevibacillus brevis)可分泌一种耐高温的大分子物质对铜绿微囊藻()生长有明显的抑制效果。本研究的无菌上清液分别在不同温度、pH条件下处理后均仍有良好的抑藻效果,说明该抑藻物质有较高的热稳定性、酸碱稳定性,是非蛋白类物质。经不同极性大小的有机溶剂萃取后,仅乙酸乙酯、正丁醇萃取的无菌上清液有抑藻效果,表明该抑藻物质极性在乙酸乙酯和正丁醇之间。经透析后,抑藻物质的分子质量大于3 ku。因此推测,该抑藻物质不是蛋白质、核酸等易变性的大分子物质,可能是一种亲脂的短肽类物质。
目前报道的大多数溶藻菌研究中,初始Chl-a浓度一般较低(500 ~ 1 000 μg/L)[34-35],而自然水体水华严重时可达2 000 μg/L[36]。水华鱼腥藻在培养后期,藻体大量漂浮在水体上层,本研究的供试藻初始Chl-a质量浓度为724.47 ~ 13 447.86 μg/L,可代表水华鱼腥藻藻华各阶段的表层水Chl-a浓度。BWFA55在实验中对各浓度的水华鱼腥藻均能在较短时间达到较高的溶藻率,表明菌株BWFA55对防治自然水体鱼腥藻藻华暴发有较高的应用前景。
[1] SMETACEK V, CLOERN J E. On phytoplankton trends[J]. Science, 2008, 319(5868): 1346-1348.
[2] BEHRENFELD M J. Abandoning sverdrup’s critical depth hypothesis on phytoplankton blooms[J]. Ecology, 2010, 91(1): 977-989.
[3] RIEMANN L, STEWARD G F, AZAM F. Dynamics of bacterial community composition and activity during a mesocosm diatom bloom[J]. Applied and Environmental Microbiology, 2000, 66(2): 578-587.
[4] 薛银刚, 刘菲, 孙萌, 等. 太湖竺山湾春季浮游细菌群落结构及影响因素[J]. 环境科学, 2018, 39(3): 1151-1158.
[5] 李建松, 王广军, 龚望宝, 等. 蓝藻水华发生过程中细菌群落结构的动态变化[J]. 中国农业大学学报, 2017, 22(7): 134-142.
[6] LIU M, LIU L M, CHEN H H, et al. Community dynamics of free-living and particle-attached bacteria following a reservoir Microcystis bloom[J]. Science of the Total Environment, 2019, 660(3):501-511.
[7] 李建松, 姜志勇, 钟金香, 等. 蓝藻水华暴发与水体细菌关系的研究进展[J]. 湖南农业科学, 2016(10): 61-64.
[8] 焦彦凯, 严小军, 李小兵. 溶藻细菌及溶藻化合物研究进展[J]. 工业微生物, 2018, 48(4): 56-62.
[9] AMIN S A, HMELO L R, VAN TOL H M, et al. Interaction and signalling between a cosmopolitan phytoplankton and associated bacteria[J]. Nature, 2015, 522(7554): 98-101.
[10] NEEDHAM D M, FUHRMAN J A. Pronounced daily succession of phytoplankton, archaea and bacteria following a spring bloom[J]. Nature Microbiology, 2016, 1(4): 16005.
[11] TAN S, HU X L, YIN P H, et al. Photosynthetic inhibition and oxidative stress to the toxiccaused by a diketopiperazine isolated from products of algicidal bacterium metabolism[J]. Journal of Microbiology, 2016, 54(5): 364-375.
[12] CASTBERG T, LARSEN A, SANDAA R A, et al. Microbial population dynamics and diversity during a bloom of the marine coccolithophorid(Haptophyta)[J]. Marine Ecology Progress Series, 2001, 221(2): 39-46.
[13] EINAT S, P W T, HYUN K K, et al. Dynamic metabolic exchange governs a marine algal-bacterial interaction[J]. eLife, 2016, 5(1): 14-21.
[14] 唐莹莹. 产PSP链状亚历山大藻共附生细菌多样性及藻菌关系研究[D]. 上海: 上海海洋大学, 2018.
[15] AMIN S A, PARKER M S, ARMBRUST E V. Interactions between diatoms and bacteria[J]. Microbiology and Molecular Biology Reviews, 2012, 76(3): 667-684.
[16] 陈东, 黄翔鹄, 李长玲, 等. 侧孢短芽孢杆菌对铜绿微囊藻藻际微生物群落的影响[J]. 广东海洋大学学报, 2021, 41(2): 10-17.
[17] MAYALI X, AZAM F. Algicidal bacteria in the sea and their impact on algal blooms[J]. The Journal of Eukaryotic Microbiology, 2004, 51(2): 139-144.
[18] GUMBO R J, ROSS G, CLOETE E T. Biological control ofdominated harmful algal blooms[J]. African Journal of Biotechnology, 2008, 7(25): 4765-4773.
[19] ZHOU L H, CHEN X H, ZHENG T L. Study on the ecological safety of algacides: a comprehensive strategy for their screening[J]. Journal of Applied Phycology, 2010, 22(6): 803-811.
[20] SUN R, SUN P F, ZHANG J H, et al. Microorganisms-based methods for harmful algal blooms control: a review[J]. Bioresource Technology, 2018, 248: 12-20.
[21] GUO X L, LIU X L, WU L S, et al. The algicidal activity ofsp. strain GLY-2107 against bloom-formingis regulated by-acyl homoserine lactone‐mediated quorum sensing[J]. Environmental Microbiology, 2016, 18(11): 3867-3883.
[22] 柯剑, 赵飞, 罗理, 等. 广东省罗非鱼主养区无乳链球菌的分离、鉴定与致病性[J]. 广东海洋大学学报, 2010, 30(3): 22-27.
[23] ARRIETA J M, HERNDL G J. Changes in bacterial β-glucosidase diversity during a coastal phytoplankton bloom[J]. Limnology and Oceanography, 2002, 47(2): 594-599.
[24] KIM J, KIM C H, YOUN S H, et al. Isolation and physiological characterization of a novel algicidal virus infecting the marine diatom[J]. The Plant Pathology Journal, 2015, 31(2):186-191.
[25] ZHANG B Z, CAI G J, WANG H T, et al.RPS and its novel and high algicidal activity against harmful algal bloom species[J]. PLoS One, 2014, 9(3): e92907.
[26] MADSLIEN E H, RØNNING H T, LINDBÄCK T, et al. Lichenysin is produced by moststrains[J]. Journal of Applied Microbiology, 2013, 115(4): 1068-1080.
[27] 王金霞. 溶藻细菌S7溶藻特性、机理及影响因素的研究[D]. 重庆: 重庆大学, 2012.
[28] IMAMURA N, MOTOIKE I, NODA M, et al. Argimicin A, a novel anti-cyanobacterial compound produced by an algae-lysing bacterium[J]. The Journal of Antibiotics, 2000, 53(11): 1317-1319.
[29] PARK S C, LEE J K, KIM S W, et al. Selective algicidal action of peptides against harmful algal bloom species[J]. PLoS One, 2011, 6(10): e26733.
[30] LEE S O, KATO J, NAKASHIMA K, et al. Cloning and characterization of extracellular metal protease gene of the algicidal marine bacteriumsp. strain A28[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(6): 1366-1369.
[31] SAKATA T, YOSHIKAWA T, NISHITARUMIZU S. Algicidal activity and identification of an algicidal substance produced by marinesp. C55a-2[J]. Fisheries Science, 2011, 77(3): 397-402.
[32] AHN C Y, JOUNG S H, JEON J W, et al. Selective control of cyanobacteria by surfactin-containing culture broth ofC1[J]. Biotechnology Letters, 2003, 25(14): 1137-1142.
[33] 张小倩, 张炜, 卢亚萍, 等. 短短芽孢杆菌发酵液对铜绿微囊藻的抑制效应[J]. 南京农业大学学报, 2017, 40(4): 625-631.
[34] 陈莉婷, 左俊, 宋立荣, 等. 溶藻细菌筛选及溶藻活性物质对铜绿微囊藻生理活性的影响[J]. 水生生物学报, 2020, 44(3): 638-646.
[35] LI Y, LIU L, XU Y, et al. Stress of algicidal substances from a bacteriumsp. h10 on[J]. Letters in Applied Microbiology, 2017, 64(1): 57-65.
[36] 唐水水, 林炜铁, 李敬源, 等. 放线菌L74溶藻物质的分离及其溶藻特性[J]. 微生物学通报, 2011, 38(5): 654-659.
Identification and Algicidal Characteristics of an Algicidal Bacterium BWFA55 in Anabaena Bloom Water
FAN De-peng1,2, HU Ya-dong1,2, YANG Min-zhi2, LEI Ming-ke1, WANG Qi3
(1.().,.,528200,; 2..,.,528200,; 3.,524088,)
【】To identify an alginolytic bacterium from algal bloom water, and analyze its alginolytic activities.【】A strain named BWFA55 with high algolytic activity againstisolated from Anabaena bloom lakes in the suburbs of Foshan was identified by API 50 CHB/E physiological-biochemical properties and 16S rDNA sequence analysis. The strain was cultured for 4 days to analyze its growth characteristics and alginolytic activity against. The fermentation supernatant of BWFA55 was co-cultured withfor 168 h, and then, the cell morphology of the algae was observed by scanning electron microscopy. The algicidal effects of the algal concentrations and the inoculation quantity of BWFA55were analyzed. The methods for BWFA55 to dissolve the algae were analyzed by measuring the lytic activities of sterile supernatant from BWFA55cell suspension and fermentation broth. The alginolytic substances were separated by dialysis and organic solvent extraction. The characteristics of alginolytic substances were studied at different temperatures and pH conditions.【】The BWFA55 was identified asWhen 10% 24-hour fermentation broth was co cultured with Anabaena bloom, the algicidal activity was the highest. The chlorophyll a (chl-a) content was reduced by >80% in 7 days. This strainattackedindirectly by secreting alginolytic compounds. This process significantly reduced the number of cells in filamentous population and the population connection structure was destroyed. The major alginolytic compounds of BWFA55 in the fermentation supernatant had a molecular mass >3 ku, and it could be extracted by ethyl acetate. Aalginolytic rate of more than 60% could be maintained at high temperature and were not affected by pH. Therefore it was confirmed that the active substances had a good thermal stability and acid-base stability.
algal bloom;;sp; alginolytic bacteria
X52;X172
A
1673-9159(2021)06-0009-09
10.3969/j.issn.1673-9159.2021.06.002
范德朋,胡亚冬,杨敏志,等. 鱼腥藻藻华水体一株溶藻菌BWFA55的鉴定及溶藻特性[J]. 广东海洋大学学报,2021,41(6):9-17.
2021-07-12
2019年佛山市自筹经费类科技计划项目(公共服务能力提升项目)(1920001001601);国家重点研发计划(2019YFD0900200);广东省企业科技特派员项目(GDKTP2020017800)
范德朋(1976—),男,硕士,主要研究方向为环境生物计术。E-mail: derek@bio-form.com
胡亚冬(1979—),女,工程师,主要研究方向为环境生物技术。E-mail: huyadong@bio-form.com
(责任编辑:刘庆颖)
