铅锌胁迫下轮叶黑藻的吸附水平及生理响应
2021-12-24于道德郑永华唐洪玉
周 洋 于道德 胡 芯 郑永华, 唐洪玉,
(1. 西南大学水产学院, 重庆 400715; 2. 山东省海洋生物研究院, 青岛 266104;3. 西南大学, 淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715)
铅(Pb)和锌(Zn)两种重金属主要存在于人类重金属工业和矿山开采中, 它们可以通过工业废水和雨水冲刷进入水环境, 由食物链富集, 对各种生物造成伤害。2003年有研究表明淮河、黄河和松花江等十大流域重金属超标断面污染程度均为超Ⅴ类[1]。并且受矿石开采的影响, 都柳江干流存在锑(Sb)和锰(Mn)超标, 支流存在锑超标的情况[2], 广西龙江沉积物中存在镉(Cd)、铅和锌等重金属污染现象[3]。铅是一种广泛存在自然界的人体非必须元素, 可对各个器官造成伤害[4]。锌虽然是植物生长的必要元素[5], 但是过量的锌可对机体产生毒害作用[6]。铅锌之间有着较为复杂的关系, 铅可降低仔鼠的学习记忆能力, 但高浓度的锌可以降低铅的毒性[7]; 孔祥英等[8]认为适当增加锌的摄入便可以抵御铅的毒性; 马迎华等[9]认为锌对铅的拮抗作用取决于锌的浓度; 付佳佳等[10]认为铅锌复合胁迫也可加重对植物的伤害。
轮叶黑藻(Hydrilla verticillate)是渔业养殖中十分常见的一种沉水植物, 它作为鱼虾饵料的同时,也可以改善水质[11]。目前, 对轮叶黑藻净化水质方面的研究较多[12,13]。有关重金属胁迫轮叶黑藻的研究主要集中在短时间(7d和14d)、高浓度且单一的重金属污染, 得到轮叶黑藻在重金属胁迫下对重金属有良好的吸附作用[14—17], 对抗氧化系统有一定的影响[18]。低浓度、长时间和多种金属共同作用于轮叶黑藻的研究暂未见报道, 而在自然界的水体中, 重金属的污染通常是相伴、微量且较长时间的存在。因此, 本试验将探讨经过28d较低浓度(Pb2+浓度≤0.20 mg/L、Zn2+浓度≤4.00 mg/L)的铅锌胁迫, 轮叶黑藻分别对铅和锌的吸附水平及生理响应,为轮叶黑藻在重金属修复中的应用提供一定的理论基础。
1 材料与方法
1.1 供试材料
本试验所用轮叶黑藻采自西南大学水产学院校内实习实训基地。
1.2 轮叶黑藻的培养与驯化
将采集到的轮叶黑藻先用自来水清洗叶片上附着的水体中的杂质。再用曝气后的水将其洗净,移入室内水池, 用改良后的10% Hoagland营养液进行培养驯化, 温度为(25±0.4)℃, pH为6.5±0.2, 光照周期12h∶12h (L∶D), 每2天更换1次培养液, 每天用HNO3或NaOH调节pH。培养1个月后, 选取长势一致的新长茎叶黑藻进行正式试验。
正式试验容器为透明整理箱(400 mm×300 mm×200 mm), 底部采用固植板将黑藻固定住, 试验条件管理同驯化期一致。培养1周后进行铅和锌(分别以Pb(NO3)2和ZnSO4·7H2O配制重金属溶液)胁迫,试验采用二因素完全设计, 铅和锌各浓度设置参照《地表水环境质量标准》(GB 3838—2002)中的Ⅰ类、Ⅲ类、Ⅴ类标准浓度值及超过Ⅴ类标准的浓度。试验共25组, 每组3个平行(每个平行50株),铅和锌浓度皆为4个梯度(表 1), 胁迫时间参照《淡水水生生物水质基准制定技术指南》(HJ 831-2017)与谢佩君等[19]、张立娜等[20]的研究设置为28d。
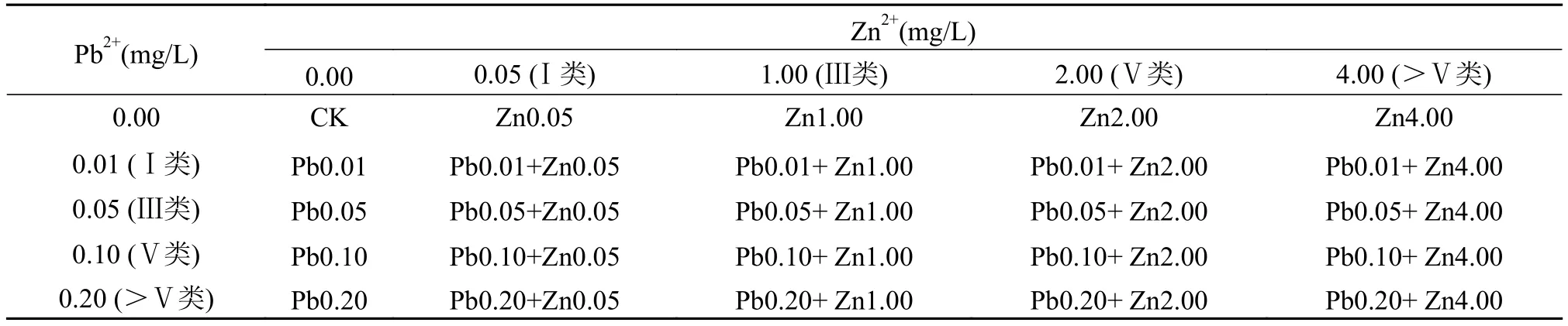
表1 试验处理组设置Tab. 1 Setting of experimental treatment group
1.3 试验指标的测定
铅锌含量的测定轮叶黑藻在胁迫28d后,将各试验组的轮叶黑藻用纯水清洗3次, 确保表面无残留后沥干。沥干后放入烘箱, 调整温度为105℃杀菌30min, 随后在65℃下烘干, 再将烘干后的轮叶黑藻用研钵彻底磨碎。称量样品1 g于50 mL三角瓶中, 做好标记, 在三角瓶中加入10 mL比例为4∶1的HNO3与HClO4的混合液, 将三角瓶置于干燥环境下24h。在95℃下消解, 直至消解液澄清透明,待样品冷却加入10%的盐酸至样品中, 使用纯水稀释、过滤, 再定容至25 mL。使用原子吸收分光光度计测定铅锌含量。
光合色素含量的测定光合色素含量使用分光光度法[21]测定。
取新鲜的黑藻叶片, 清洗干净, 剪碎后混匀, 准确称取0.2 g放入研钵中, 加入少量碳酸钙粉末和石英砂。在避光条件下, 先加入2 mL 95%乙醇进行充分研磨至匀浆, 移至10 mL离心管中, 随后再用3 mL 95%乙醇多次冲洗钵体和钵棒, 将叶绿素全部洗入离心管中, 摇匀静置3min, 在3500 r/min转速下离心10min。提取上清液, 摇匀后分别取出2 mL, 用95%乙醇定容至10 mL, 摇匀。将稀释后的叶绿素提取液倒入光经1 cm比色皿中, 以95%乙醇为空白,在波长665和649 nm下测定其吸光度值。将吸光度值代入公式中求叶绿素a和叶绿素b的含量。
生理指标的测定植物匀浆的制备同样采用研钵法进行研磨, 匀浆介质为PBS缓冲液, 匀浆过程均在冰浴条件下操作。
MDA和T-AOC含量、SOD和POD活性均严格按照试剂盒(购自中国南京建成生物有限公司)操作步骤进行测定。
1.4 数据分析
使用Excel 2016绘制图表, SPSS 22.0统计学软件进行数据的单因素方差分析, 结果用平均数±标准差(X±SD)表示。其中,P>0.05为无显著相关;P≤0.05为显著相关;P≤0.01为极显著相关。
2 结果
2.1 轮叶黑藻对铅的吸附
由图 1可得, 在Pb2+单一胁迫下, 轮叶黑藻对铅吸附的量与Pb2+浓度呈正相关, 试验组轮叶黑藻吸附Pb2+的量显著高于对照组(P<0.05)。在复合胁迫时, 在同一Pb2+浓度处理下, Pb2+吸附量随Zn2+浓度的增加而增加, 除Zn2+浓度为0.05 mg/L外, 其余与对应的Pb2+单一胁迫相比均差异显著; 在同一Zn2+处理浓度下, 轮叶黑藻对铅吸附的量随复合的Pb2+浓度升高而增大, 除Zn2+处理浓度为0.05 mg/L时,Pb0.01+Zn0.05处理与Pb0.05+Zn0.05处理差异不显著, 其余同一Zn2+处理浓度下的复合处理组之间均差异显著。
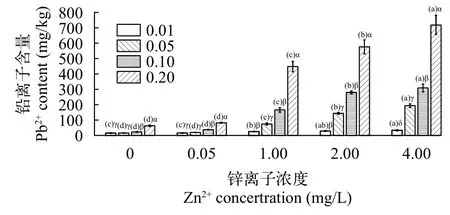
图1 铅锌胁迫下轮叶黑藻对铅的吸附效果Fig. 1 Adsorption of lead by Hydrilla verticillata under lead and zinc stress
2.2 轮叶黑藻对锌的吸附
由图 2可知, 在Zn2+单一胁迫时, 轮叶黑藻对锌吸附的量与Zn2+浓度呈正相关, Zn2+浓度≥1.00 mg/L的试验组显著高于对照组。复合胁迫时, 在同一Zn2+浓度处理下, Zn2+浓度为0.05和1.00 mg/L时, 随着Pb2+浓度增加, 吸附的Zn2+量先降后升, 同一Zn2+浓度处理下的数据之间无显著性差异(P<0.05);Zn2+浓度为2.00 mg/L时, 轮叶黑藻对锌吸附的量随复合的Pb2+浓度的升高而逐渐增加, 只有Pb0.20+Zn2.00处理与单一Zn2.00处理相比显著升高; 当Zn2+浓度为4.00 mg/L时, 复合胁迫组均显著高于单一胁迫组。在同一Pb2+浓度处理下, 黑藻体内的锌含量均随Zn2+复合浓度的升高显著增加。

图2 铅锌胁迫下轮叶黑藻对锌的吸附效果Fig. 2 Adsorption of zinc by Hydrilla verticillata under lead and zinc stress (mg/kg)
2.3 叶绿素的含量变化
由图 3和图 4可得, 在Zn2+单一胁迫下, 随着Zn2+浓度增加, 叶绿素a和叶绿素b含量先升后降, 试验组与对照组相比, 除Zn0.05胁迫外均显著降低(P<0.05)。复合胁迫, 在同一Pb2+浓度处理下, Pb2+浓度为0.01 mg/L, 除Pb0.01+Zn0.05胁迫组叶绿素含量显著高于单一Pb0.01胁迫组外, 其余复合胁迫组均显著低于单一Pb0.01胁迫组; Pb2+浓度为0.05、0.10和0.20 mg/L, Zn2+复合浓度为0.05 mg/L时, 复合胁迫组的叶绿素含量比对应的单一铅处理组有所降低, 但差异不显著, 但Zn2+浓度≥1.00 mg/L的复合处理组与对应的单一铅胁迫相比叶绿素含量显著降低。

图3 铅锌胁迫下轮叶黑藻叶绿素a的含量Fig. 3 Chlorophyll a content of Hydrilla verticillata under leadzinc stress

图4 铅锌胁迫下轮叶黑藻叶绿素b的含量Fig. 4 Chlorophyll b content of Hydrilla verticillata under leadzinc stress
在Pb2+单一胁迫下, 叶绿素含量先增后降, Pb0.05胁迫组与对照组相比显著增加, Pb2+浓度≥0.10 mg/L时显著降低。复合胁迫, 在同一Zn2+浓度胁迫下,Zn2+浓度为0.05 mg/L时, 叶绿素先增后降, Pb0.01+Zn0.05处理组比单一Zn0.05胁迫显著增加, Pb2+浓度≥0.10 mg/L的复合胁迫比单一Zn0.05胁迫显著降低; Zn2+浓度为1.00、2.00和4.00 mg/L时, 复合的Pb2+浓度为0.01 mg/L时与对应的Zn2+单一胁迫相比显著升高, 然后随着复合的Pb2+浓度增大, 叶绿素含量逐渐降低, 但仍高于对应的Zn2+单一胁迫组。
2.4 丙二醛(MDA)含量和总抗氧化能力(T-AOC)的变化
由图 5可知, 在轮叶黑藻在Zn2+单一胁迫下,MDA的含量先增后降再升, 试验组与对照组相比显著升高(P<0.05)。复合胁迫, 在同一Pb2+浓度处理下, Pb2+浓度为0.01 mg/L时, 只有Pb0.01+Zn0.05比对应的Pb2+单一胁迫显著升高, 其余复合胁迫组与Pb2+单一胁迫差异不显著; Pb2+浓度为0.05 和0.10 mg/L, 复合的Zn2+浓度为0.05 mg/L时, 复合胁迫组的MDA含量和对应的单一铅处理无显著性差异, 但复合的Zn2+浓度≥1.00 mg/L时, 复合胁迫组的MDA含量比对应的Pb2+单一胁迫显著降低; Pb2+浓度为0.20 mg/L时, 复合胁迫组与Pb2+单一胁迫相比差异不显著。

图5 铅锌胁迫下轮叶黑藻MDA的含量Fig. 5 MDA content of Hydrilla verticillate under lead-zinc stress
轮叶黑藻在Pb2+单一胁迫下, MDA含量先增后降, 试验组的MDA含量比对照组均显著升高。复合胁迫, 在同一Zn2+浓度处理下, Zn2+浓度为0.05 mg/L时, 复合胁迫组除Pb0.20+Zn0.05比单一Zn0.05胁迫MDA含量降低但差异不显著外, 其余复合胁迫组MDA含量均显著升高; Zn2+浓度为1.00、2.00和4.00 mg/L, 复合的Pb2+浓度为0.01 mg/L时, 复合胁迫组比对应的Zn2+单一胁迫显著升高, 在复合Pb2+浓度为0.05和0.10 mg/L时有所降低, 而Pb0.20+Zn2.00和Pb0.20+Zn4.00处理组又出现一定的上升趋势。
由图 6可知, 在Zn2+的单一胁迫下, 轮叶黑藻的T-AOC呈上升趋势, 在Zn2+处理浓度≥1.00 mg/L时比对照组显著升高。复合胁迫, 在同一Pb2+浓度处理下, 当Pb2+浓度为0.01和0.05 mg/L, Zn2+浓度≥1.00 mg/L时, 轮叶黑藻T-AOC的复合胁迫组比对应的Pb2+单一胁迫显著增加; Pb2+浓度为0.10 mg/L时,轮叶黑藻T-AOC先降后升, 复合胁迫与Pb2+单一胁迫相比无显著性差异, 但Zn2+浓度≥1.00 mg/L的复合胁迫组比Pb0.10+Zn0.05显著增加; 当Pb2+浓度为0.20 mg/L时, 轮叶黑藻的T-AOC除Pb0.20+Zn4.00外其他的复合处理组比Pb2+单一胁迫均显著增加,Pb0.20+Zn4.00胁迫组比Zn2+的单一胁迫高, 但差异不显著。
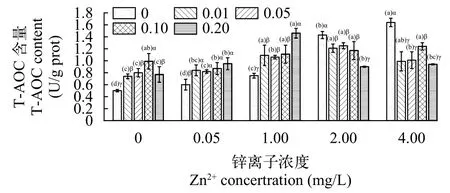
图6 铅锌胁迫下轮叶黑藻T-AOC含量的变化Fig. 6 Changes of T-AOC of Hydrilla verticillata under lead and zinc stress
在Pb2+的单一胁迫下, 试验组比对照组的轮叶黑藻的T-AOC均显著升高。复合胁迫, 在同一Zn2+浓度处理下, Zn2+浓度为0.05 和1.00 mg/L时, 复合胁迫组比Zn2+的单一胁迫显著升高, 复合的Pb2+浓度为0.20 mg/L时, T-AOC急剧上升; Zn2+浓度为2.00和4.00 mg/L时, 复合胁迫组比对应的Zn2+单一胁迫显著降低, 复合的Pb2+浓度为0.20 mg/L时出现大幅度降低。
2.5 超氧化物歧化酶(SOD)和抗氧化酶(POD)的变化
由图 7可知, 在Zn2+的单一胁迫下, 各试验组轮叶黑藻的SOD活性均显著高于对照组(P<0.05)。复合胁迫, 在同一Pb2+浓度处理下, Pb2+浓度为0.01、0.05和0.10 mg/L时, 复合的Zn2+浓度≥1.00 mg/L时,复合胁迫组的SOD活性均比对应的Pb2+单一胁迫显著升高; Pb2+浓度为0.20 mg/L时, SOD活性随Zn2+复合浓度的增高而增加, 但只有Pb0.20+Zn4.00胁迫组比单一Pb0.20胁迫显著增加。

图7 铅锌胁迫下轮叶黑藻SOD活性的变化Fig. 7 Changes of SOD activity in Hydrilla verticillata under lead and zinc stress
在Pb2+单一胁迫下, 试验组轮叶黑藻的SOD活性比对照组显著升高, 在同一Zn2+浓度处理下,Zn2+浓度为0.05、1.00 和2.00 mg/L时, 复合胁迫组的SOD活性比对应的Zn2+单一胁迫无显著性差异;Zn2+浓度为4.00 mg/L时, 只有Pb0.01+Zn4.00轮叶黑藻的SOD活性比单一Zn4.00胁迫显著升高。此外,Pb2+浓度为0.20 mg/L时的复合处理与对应的Zn2+单一胁迫相比有降低的趋势。
由图 8可知, 在Zn2+的单一胁迫下, POD的活性逐渐升高, Zn2+浓度≥2.00 mg/L时与对照组相比显著升高。在同一Pb2+浓度胁迫下, Pb2+浓度为0.01 mg/L时, Pb0.01+Zn2.00与Pb0.01+Zn4.00复合胁迫组和Pb0.01单一胁迫组相比显著降低; Pb2+浓度为0.05、0.10和0.20 mg/L时, 复合胁迫组与对应的Pb2+单一胁迫组相比POD活性均显著降低。

图8 铅锌胁迫下轮叶黑藻POD活性的变化Fig. 8 Changes of POD activity in Hydrilla verticillata under lead and zinc stress
在Pb2+的单一胁迫下, 试验组和对照组相比POD活性均显著升高。在同一Zn2+浓度胁迫下, Zn2+浓度为0.05和1.00 mg/L, 复合的Pb2+浓度为0.01 mg/L时, 复合胁迫比对应的Zn2+单一胁迫显著升高, 随后在复合Pb2+浓度≥0.05 mg/L时均有所降低; Zn2+浓度为2.00和4.00 mg/L时, 复合胁迫组与对应的Zn2+单一胁迫组相比POD的活性均显著降低。
3 讨论
3.1 铅锌胁迫对黑藻光合作用的影响
轮叶黑藻在水体中对各种营养盐类和重金属都有很强的吸附能力[22]。本研究结果表明, 随着水体中Pb2+、Zn2+浓度的增加, 轮叶黑藻体内富集的Pb2+、Zn2+均增加, 在Zn2+存在时, 可促进轮叶黑藻对Pb2+的吸收; 在Zn2+浓度≥2.00 mg/L时, Pb2+的存在也可促进轮叶黑藻对Zn2+的吸收。这说明植物吸收重金属离子时, 它们之间存在一定的相互作用[23],与周强英等[24]的研究结果相似。
叶绿素是衡量植物进行光合作用强弱的指标,在植物受到外界胁迫时, 叶绿素含量也可以作为植物遭受重金属毒害的程度的指标[25]。本试验结果表明, 在Pb2+、Zn2+的胁迫下叶绿素a、b出现“低促高抑”的现象, 且受Zn2+影响较大, 尤其是Zn2+浓度≥1.00 mg/L时, 而Pb2+对叶绿素的影响不明显。这与之前报道的Pb2+可使轮叶黑藻失绿、叶片腐烂的研究结果有所不同[18], 可能与其使用的Pb2+浓度显著大于本试验有关。
3.2 铅锌胁迫对黑藻质膜过氧化的影响
在生物体内, 自由基作用于脂质发生过氧化反应, 反应终产物为丙二醛(MDA), 它是膜脂过氧化最重要的产物之一, 它能加剧膜脂的损伤, 故可以通过MDA了解膜脂过氧化的程度, 以间接测定膜系统受损程度以及植物的抗逆性[26]。在本试验中,轮叶黑藻在Pb2+单一胁迫下, 随着Pb2+浓度的增加,MDA含量逐渐升高, 说明其受到的损伤会增大, 这点与刘朝荣等[27]的研究结果相似; 在Zn2+单一胁迫下, MDA含量在Zn2.00胁迫时开始出现下降的现象, 可能是机体抗氧化能力增强, 进而清除了大量的活性氧自由基, 说明植物可以通过自身的调节机制以对抗外界的胁迫, 这点与周际海等[28]的研究结果相似。在铅锌复合胁迫下, Pb2+浓度为0.01 mg/L,MDA含量先升后降, 复合胁迫组MDA含量均比对应的Zn2+单一胁迫高。其原因可能是低浓度(0.01 mg/L)的铅离子加剧了对轮叶黑藻的胁迫, 导致MDA含量上升。当复合胁迫的Pb2+浓度≥0.05 mg/L, Zn2+浓度≥1.00 mg/L时, 复合胁迫组的MDA含量均比对应的单一铅胁迫低, 与史雅甜等[29]的研究结果相似, 说明此时植物抗氧化能力在被诱导后加强。以上均说明轮叶黑藻在受到铅锌胁迫后, 其体内会产生活性氧自由基, 通过过氧化反应生成MDA, 但随着铅锌离子浓度升高, MDA含量出现差异, 可能是与自身的抗氧化机制有关。
3.3 铅锌胁迫对黑藻抗氧化效应的影响
生物机体代谢过程中产生的活性氧, 是一种对生物有害的自由基, 是氧元素的另一种存在形式,有时自由基可发挥消灭入侵的微生物的作用[30], 这些自由基可由抗氧化系统清除。T-AOC可以直接反应植物的抗氧化能力的强弱。本试验研究得出,在单一铅胁迫时, T-AOC先上升后下降, 说明低浓度(≤0.10 mg/L)的铅胁迫可促进轮叶黑藻抗氧化系统的运转, 高浓度(0.20 mg/L)Pb2+胁迫时抗氧化系统的运转将会受到抑制。在单一锌胁迫时, Zn2+浓度逐渐增加, 轮叶黑藻的T-AOC也不断上升, Zn2+浓度≥2.00 mg/L时, T-AOC会急剧上升, 说明高浓度的Zn2+(≥2.00 mg/L)胁迫会使轮叶黑藻抗氧化反应更加剧烈。在复合胁迫下, 当复合的Zn2+浓度达到1.00 mg/L以上时, T-AOC均比对应的单一铅胁迫显著升高, 说明浓度≥1.00 mg/L的Zn2+与Pb2+复合后有利于轮叶黑藻抗氧化系统的运作, 其原因有可能是随着Zn2+复合浓度的增加, 轮叶黑藻体内铅锌含量均有所增加, 对机体的刺激增大, 导致其抗氧化能力的增强。在同一Zn2+浓度胁迫下, 当Zn2+浓度为0.05和1.00 mg/L时, 与Pb2+进行复合后轮叶黑藻T-AOC比对应的单一锌胁迫高, 说明Pb2+可协同促进Zn2+(浓度≤1.00 mg/L)对黑藻T-AOC提升的促进作用; 而当Zn2+浓度为2.00和4.00 mg/L时, 与Pb2+进行复合后黑藻T-AOC反而比对应的单一锌胁迫低, 其原因可能是相比单一锌胁迫, Pb2+与浓度≥2.00 mg/L的Zn2+复合后, 由于铅锌重金属的含量均有所升高, 对机体内的抗氧化酶和抗氧化物等造成了不同程度的影响, 使得抗氧化系统出现一定程度的紊乱, T-AOC有所下降。
一定浓度的重金属可以激活各种酶促和非酶促抗氧化[31,32]。植物在受到胁迫时, SOD和POD是植物抵御外界胁迫, 抗氧化系统的重要组成, SOD作为金属酶[33], 也可以吸收部分金属, 增强植物的抗氧化能力。SOD将毒性较强的超氧阴离子自由基转化为毒性较弱的H2O2和O2, 随后由POD等酶进一步将H2O2转化为无害的H2O和O2。在正常情况下机体产生的活性氧(ROS)浓度低, 机体抗氧化系统可以有效地将其清除, ROS浓度和抗氧化系统的运作处于动态平衡, 避免机体受到损伤[34]。但随着机体受到外界胁迫加强, 机体会受到一定损害,体内的抗氧化酶和抗氧化物质可能会受到抑制。Cd处理浓度的增加轮叶黑藻体内的SOD和POD活性呈先升后降的趋势[35]。本试验的结果表明, 在铅和锌单一或复合胁迫下, 黑藻体内的SOD活性整体上随着处理浓度的增加而增强。POD活性在铅锌单一胁迫时也随着处理浓度的增加而增强, 其中,在Pb2+浓度为0.10 mg/L、Zn2+浓度为2.00和4.00 mg/L时出现急剧上升; 而在复合胁迫中, 只有在Pb2+浓度为0.01 mg/L且Zn2+浓度为0.05和1.00 mg/L时, 铅锌复合胁迫下POD活性比Zn2+单一胁迫时强, 其余的铅锌胁迫组合下POD活性均比单一胁迫时弱; 并且MDA与T-AOC此时在整体上略微呈现下降趋势,这与王婷[36]的研究结果相似, 说明铅锌的复合在一定程度上可以抑制单一胁迫对植株的危害。
综上所述, 在铅和锌单一胁迫下, 经过28d处理,低浓度的Pb2+(浓度≤0.05 mg/L)和Zn2+(浓度为0.05 mg/L)均对轮叶黑藻叶绿素的合成有一定的促进作用,植物产生的活性氧以叶绿素为靶分子, 致使叶绿素结构破坏[37], 此时机体快速产生叶绿素以抵抗外界胁迫, 而Pb2+(浓度≥0.10 mg/L)和Zn2+(浓度≥1.00 mg/L)可明显抑制叶绿素的合成; 轮叶黑藻MDA、T-AOC含量和SOD、POD活性在铅和锌单一胁迫下, 均显著高于对照组CK。在铅锌复合胁迫中, 在Pb2+同一胁迫浓度下, 当Zn2+浓度达到1.00 mg/L以上时, 铅锌复合胁迫组的叶绿素含量、MDA含量和POD活性比相应的Pb2+单一处理组低, T-AOC含量和SOD活性比相应的Pb2+单一处理组高; 在同一Zn2+浓度胁迫下, 当复合的Pb2+浓度为0.01 mg/L时, 铅锌复合胁迫组的叶绿素含量和MDA含量比相应的Zn2+单一胁迫组高; 在Zn2+处理浓度为0.05 mg/L和1.00 mg/L下, 与Pb2+进行复合后黑藻T-AOC比相应的Zn2+单一胁迫高, 而在Zn2+胁迫浓度为2.00 mg/L和4.00 mg/L下, 与Pb2+进行复合后黑藻T-AOC和POD活力比相应的Zn2+单一处理低。故而, 轮叶黑藻对Pb2+的吸附同时受Pb2+与Zn2+影响, 对Zn2+的吸附主要受Zn2+处理浓度的影响; 低浓度Pb2+和Zn2+可以促进叶绿素的合成, 高浓度的胁迫则会抑制叶绿素的合成; 受到胁迫时其抗氧化系统会迅速作出反应, 但一定浓度的Pb2+与Zn2+在单一和复合胁迫下,MDA含量依然较高, 但POD活性呈现下降趋势, 说明抗氧化系统受限, 不能正常运转, 机体将受到损伤, 同时T-AOC出现的下降趋势也可印证。
