一株除臭乳酸菌的筛选及应用效果
2021-12-23潘慧青,张炎达,杨荣平,赵齐
潘慧青,张炎达,杨荣平,赵齐

摘要:为获得具有除臭功能的养殖用微生态制剂备用菌株,从畜禽养殖场粪便富集培养后分离的乳酸菌中,筛选出一株除臭乳酸菌BDLC-3,经16S rDNA测序分析,鉴定为短乳杆菌(lactobacillus brevis),通过大鼠经口毒性试验结果表明该菌株安全无毒。对菌株发酵制备获得的菌剂进行应用效果检验,结果显示,菌剂BDLC-3以3%的接种量处理新鲜猪粪7d可达到最优的除臭效果,对氨气和硫化氢的去除率分别为73.8%±2.6%和55.8%±3.1%。结果表明该菌株具有良好的生长性能、安全性和除臭性能,具备在畜禽养殖中作为益生、除臭一体微生态制剂的潜在应用价值。
关键词:乳酸菌;除臭;氨气;硫化氢
Isolation of a Deodorizing Lactic Acid Bacteria and its Application Effect
PAN Huiqing, ZHANG Yanda*, Yang Rongping, Zhao Qi
(Municipal Enterprise Technical Center of Fujian Beidi Pharmaceutical Co., Ltd., Ningde, Fujian, 355300)
Abstract: In order to obtain probiotics strains for breeding with deodorization function, a deodorizing lactic acid bacterium BDLC-3 was selected from the lactic acid bacteria isolated from the feces of livestock farms. According to the analysis of 16S rDNA gene sequencing, strain BDLC-3 were identified as Lactobacillus brevis. The results of oral toxicity test in rats showed that the strain was safe and non-toxic. Application effect test of the bacteria BDLC-3 agent showed that the treatment of fresh pig manure with 7 d at 3% inoculation, with the removal rates of ammonia and hydrogen sulfide were 73.8%±2.6% and 55.8%±3.1%, respectively. The results showed that the strain had good growth performance, safety and deodorization performance, and had potential application value as probiotic and deodorizing probiotics in livestock breeding.
Key words:Lactobacillus; deodorization; NH3; H2S
隨着近年来我国畜禽养殖业规模化、集约化的发展,养殖产生的粪污成为农业面源污染的主要来源,产生的恶臭气体不仅对养殖动物产生危害,更严重影响周边环境和人体健康,由此带来的环境污染成为限制产业绿色、高质量、可持续发展的关键问题,是整个产业需要重点控制的核心问题[1]。国内外对恶臭气体主要采用物理、化学和生物法进行处理[2],其中生物法主要利用微生物除臭,具有低投资、高效率和生态环保等优点,成为研究和应用的热点[3-5]。与此同时,微生态制剂在畜禽健康养殖过程中具有促生产和促生长,提高饲料利用率和养殖效益等作用,也可使粪污显著减量[6-10]。因此,既具备益生菌功能又兼具除臭效果的微生物菌剂的研究和开发受到重视。乳酸菌是最常用的益生菌,具备产酸抑制腐败微生物生长的性能,也可有效去除恶臭气体,是益生除臭菌研究和应用的重点[11-13]。基于此,本研究从福建宁德规模养猪场粪污中富集、分离乳酸菌,并从中筛选具备较好除臭性能的菌株,为适于区域畜禽养殖用多功能微生态制剂的开发和应用奠定基础。
1 材料与方法
1.1 样品采集
选择位于福建省宁德市和柘荣县的两个养猪场,从堆积的粪便中间和底层共采集约30g样品,装入无菌自封袋后置于冰盒中保存,3h内送至实验室,用于目标菌株分离和筛选。
1.2 菌株的分离和筛选
取5g采集的样品于装有100mL无菌水的250mL三角瓶中,放入摇床中,在温度30℃、转速200r/min的条件下处理2h后取出,静止1h。取上清液5mL于装有50mL MRS培养基[13]的250mL三角瓶中,放入摇床中,在温度30℃、转速120r/min的摇床中处理48h。
富集处理后的样品,取样采用10倍稀释法,从10-3、10-5、10-7、10-9稀释度下吸取0.1mL于MRS固体平板上涂布,30℃恒温培养。2d后观察平板上产生透明圈的不同菌落并采用平板划线法进一步纯化,编号后移入斜面培养基上并于4℃保存备用。
1.3 除臭菌的筛选和鉴定
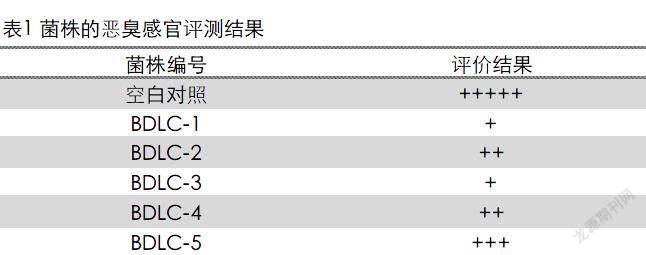
1)乳酸菌的除臭效果初筛 采用六级强度评价法[14]检验除臭效果并对分离获得的菌株进行初筛。分离获得的乳酸菌用MRS液体培养基在摇瓶中培养48h后备用。取新鲜猪粪200g置于1,000mL广口瓶中,将待测菌液以OD值稀释一致后,以5%的接种量将菌液与猪粪搅拌均匀,以不接种组为对照,每组试验设置3个重复。密封广口瓶,30℃静止培养7d后评价各菌株的除臭效果。
2)除臭菌株的复筛 经初筛获得的有较好效果的除臭菌,摇瓶发酵制备菌剂。取新鲜猪粪300g装入1,000mL的广口瓶中,按照5%的接种量接入菌液并与猪粪搅拌均匀,在广口瓶中放置2个50mL烧杯,分别装有20mL 2%的硼酸溶液和20mL 0.2%的锌铵络盐溶液。广口瓶用胶塞密封并覆盖双层保鲜膜后在30℃静置培养。以不接种组为对照,每组实验设置3个重复。培养第7天取出吸收液,分别测定氨气和硫化氢的释放量[15],计算不同菌株对氨气和硫化氢的去除率以确定效果最佳的除臭菌。
计算公式:降解率=对照组释放量-试验组释放量/对照组释放量×100%。
3)除臭菌株的16S测序和系统发育分析 确定的除臭菌株培养收集菌体后提取基因组DNA,并扩增16S rDNA。PCR反应体系为:含有15mmol/L的Mg2+的10×缓冲液2.5μL,2.5mmol/L的dNTP 2μL,引物27F和1492R(10μmol/L)各0.4μL,DNA模板约30ng,全式金DNA聚合酶0.75U,用ddH2O补至25μL。PCR条件为:94℃ 4min;94℃ 1min,55℃ 45s,72℃ 2min,30个循环;最后72℃ 5min。PCR产物经1%琼脂糖凝胶电泳检测后,送交上海生工生物技术有限公司测序。将所得的序列在GenBank中进行BLAST分析后,采用MEGA 4.0软件进行多重序列比对分析,并以N-J法构建系统发育树。
1.4 除臭菌的安全评价
参照GB15193.3—2014采用大鼠急性毒性试验对除臭菌的安全性进行评价,采用最大耐受剂量法进行。健康大鼠随机分为2组,雌雄各10只,一次经口灌胃量为2mL/100g,灌胃后连续7d观察大鼠是否有中毒、发病和死亡现象,并按照LD50剂量分级表进行判定。
1.5 除臭菌的菌剂发酵
采用既有的乳酸菌液体发酵规模生产的配方初步检验除臭菌的生产性能。所用生产用培养基配方1为:食用红糖2%;安琪蛋白胨0.4%;安琪酵母浸膏1.8%;磷酸氢二钾0.2%;硫酸镁0.05%;结晶醋酸钠1.5%;0.5%碳酸钙。配方2为:葡萄糖1.5%;蛋白胨1.0%;酵母膏2%;磷酸氢二钾0.4%;硫酸镁0.05%;碳酸钠0.5%;0.5%碳酸钙。以MRS液体培养基作为对照,每种培养基均为3个重复,采用2L的摇瓶在30℃、160r/min的摇床中处理48h后,采用平板菌落计数法测定活菌数。
1.6 除臭菌剂的应用效果试验
在养猪场用30L桶装入10kg新鲜猪粪,发酵获得的除臭菌剂,按照1%、3%和5%的接种量加入并搅拌均匀,上方放置两个250mL的烧杯,分别装有100mL 2%的硼酸溶液和100mL 0.2%的锌铵络盐溶液。随后用双层保鲜膜封口,猪场自然条件下静置培养,以不接种组为对照,每组试验设置3个重复。分别在第7天和第14天取出吸收液,测定氨气和硫化氢的释放量,计算氨气和硫化氢的去除率。
1.7 数据统计分析
统计和分析采用SPSS 18.0软件,选择单因素方差分析,采用Tukey多重比较检验,以P<0.05表示差异显著,试验数据以平均值±标准差表示。
2 结果与分析
2.1 分离乳酸菌的除臭效果初筛
经MRS培养基富集后,在MRS固体平板上对产生透明圈的菌落依大小进行划线分离,共获得5株菌,分别命名为BDLC-1、BDLC-2、BDLC-3、BDLC-4、BDLC-5。通过六级强度评价对这些菌株进行除臭效果初筛,结果显示这些菌株均有除臭效果(表1),其中BDLC-1和BDLC-3除臭能力最强,经7d的处理后,臭味等级均为表示轻微臭味的“+”。
2.2 除臭菌复筛和菌株测序分析
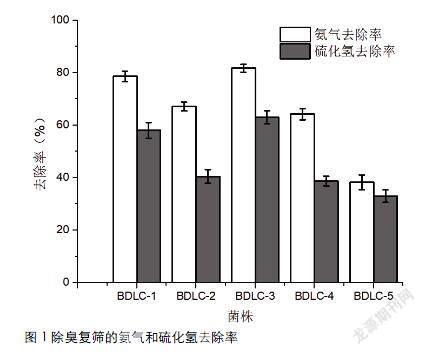
通过对各菌株去除氨气和硫化氢的能力进行复筛,各菌株7d的氨气和硫化氢去除率分别在38.3%~81.7%和33.0%~63.0%之间,对氨气的去除率显著高于对硫化氢的去除率(图1)。
所有菌株中,BDLC-1和BDLC-3对氨气和硫化氢的去除率显著高于其它3株,其中菌株BDLC-3对氨氮和硫化氢的去除率分别为81.7%±1.5%和63.0%±2.5%,显著高于BDLC-1(P<0.05)。基于此,筛选获得的BDLC-3将作为目标菌做进一步研究。
对菌株BDLC-3进行了测序分析,培养后提取基因组DNA,扩增获得16S rDNA片段后测序。测得的16S rDNA序列经比对和系统发育分析(图2),确定为短乳杆菌(Lactobacillus brevis)。
2.3 除臭菌生物安全性评价
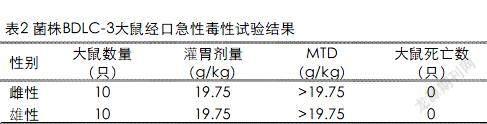
采用大鼠急性毒性试验评价菌株BDLC-3的生物安全性,灌胃后大鼠未出现中毒症状,无死亡。观察期结束后处死全部动物剖检未见异常。MTD结果(表2)显示,菌剂BDLC-3对雌、雄性大鼠的最大耐受剂量(MTD)均大于19.75g/kg,根据GB15193.3—2003中的急性毒性分级标准,属无毒级。
2.4 除臭菌剂的发酵制备
为确定菌株BDLC-3是否具备低成本规模发酵制备菌剂的可行性,采用本单位成熟用于乳酸菌液体规模发酵的两个配方,对比MRS液体培养基进行初步发酵制备。结果显示生产配方1和2的菌数分别为1.59×109±2.8×107CFU/mL和2.74×109±2.2×108CFU/mL,低于MRS培养基的4.37×109±2.7×108CFU/mL,但处于相同数量级。因此,初步确定菌株BDLC-3可以实现规模生产制备菌剂。
2.5 除臭菌剂的应用效果
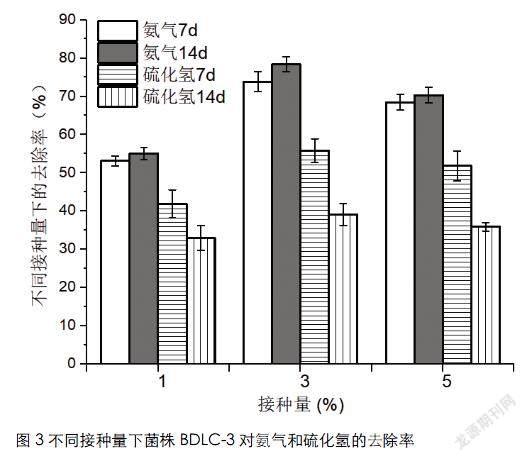
制备的BDLC-3菌剂在1%、3%和5%的接种量下,对新鲜猪粪的小试应用效果显示,接种1%菌剂的试验组氨氮和硫化氢的去除率均显著低于3%和5%的接种量(P<0.05),其中3%接种量的试验组氨氮和硫化氢的去除率均最高,继续增加接种量不能显著提高处理效果。3%接种量的试验组7d和14d的氨氮去除率分别为73.8%±2.6%和78.4%±2.0%,硫化氫的去除率分别为55.8%±3.1%和39.2%±2.8%。各试验组处理14d比7d氨氮去除率的增加不显著,相反地,各试验组处理14d比7d硫化氢去除率显著降低(P<0.05)。显然,菌剂BDLC-3对新鲜猪粪有快速的处理能力和较好的处理效果。如图3。
3 讨论
微生物除臭在畜禽养殖、垃圾处理、水污染治理、有机废弃物处理等领域均有迫切的应用需求,从这些环境中分离筛选适于特定环境的除臭功能菌已有较好的研究基础[7,16,17]。长期以来,对乳酸菌的益生功能和安全性已有足够的认识,发掘其除臭功能具有在畜禽养殖中实现一菌多用的前景。乳酸菌经常作为单菌或者复配菌成分,制备除臭菌剂在实际应用中也取得了较好的效果[4,18,19]。挖掘具有除臭效果的乳酸菌并进行评价应用,是一项长期的重要工作。已有研究中常见的具有除臭功能乳酸菌如植物乳酸菌(lactobacillus plantatum)、嗜热链球菌(streptococcus thermophilus)、干酪乳杆菌(lactobacillus casei)、副干酪乳杆菌(lactobacillus paracasei)、布氏乳杆菌(lactobacillus buchneri)和发酵乳杆菌(lactobacillus fermentum)等。本研究分离鉴定的短乳杆菌作为除臭菌在实际应用中尚比较罕见,仅有个别以该类菌株去除特定恶臭物质的试验研究[12],具有丰富除臭乳酸菌种类,并进一步开发菌剂实际应用的价值。
已发现的除臭乳酸菌制备的菌剂,在实验室除臭效果测试中显示出较好的效果。邱艳君等[13]从泡菜厂污水处理系统中分离的植物乳杆菌和嗜热链球菌对氨氮和硫化氢的最大去除率分别达到54.87%、37.35%和41%、22.47%。许丽娟等[20]从生活垃圾中筛选获得的一株干酪乳杆菌对氨氮和硫化氢的最大去除率分别达到90%和46.8%。本研究获得的菌株短乳杆菌BDLC-3在实验条件下对氨气和硫化氢的去除率分别为81.7%±1.5%和63.0%±2.5%,针对两种主要臭源气体的综合除臭性能较好。功能菌株是否能成为具有应用价值的菌剂产品,还涉及安全性、生产成本和实用效果。菌株BDLC-3经生物安全评价为无毒无害。采用用于菌剂生产的培养配方,仍能获得较高的发酵水平,表明其具备低成本生产的潜质。而已发酵的菌剂在现场小试的环境条件下,对氨气和硫化氢的去除率分别为73.8%±2.6%和55.8%±3.1,具有良好的实用效果。综合考虑上述因素,本研究分离筛选的菌株BDLC-3具有良好的生长性能、安全性和除臭性能,在进一步研究菌株益生性能,优化生产、应用条件的基础上,具有开发成为在畜禽养殖中作为益生、除臭一体微生态制剂的潜在价值。
参考文献:
[1] Xiao-Zhong Zhong, Shi-Chun Ma, Shi-Peng Wang, et al. A comparative study of composting the solid fraction of dairy manure with or without bulking material: Performance and microbial community dynamics[J]. Bioresource Technology, 2018(247):443-452.
[2] Kimberley Tang, Vikrama Baskaran, Mehdi Nemati. Bacteria of the sulphur cycle: An overview of microbiology, biokinetics and their role in petroleum and mining industries[J]. Biochemical Engineering Journal, 2008,44(1):73-94.
[3] 丁飞,尹红梅.微生物除臭菌剂在猪舍中的应用试验[J].中国猪业,2019,14(5):105-106+110.
[4] 杨柳,邱艳君.除臭菌株对畜禽养殖场恶臭气体的控制研究[J].中国沼气,2014,32(3):36-39.
[5] 刘裕慧,赵萍,李林杰,等.微生物除臭剂发酵工艺条件优化及硫素转化的研究[J].生物资源,2020,42(4):397-403.
[6] 温家姝,胡彩虹,崔世豪,等.微生态制剂对家禽肠道健康影响的研究进展[J].动物营养学报,2021,33(4):1851-1858.
[7] 蔡文瑜.微生态制剂在畜禽养殖污染防治方面的应用[J].现代畜牧科技,2019(1):11-13.
[8] 朱万宝,常志州,叶小梅,等.益生菌饲喂断奶仔猪促生长作用与除臭效果[J].江苏农业科学,2000(1):66-67.
[9.] Ding Sujuan, Yan Wenxin, Ma Yong, et al. The impact of probiotics on gut health via alternation of immune status of monogastric animals[J]. Animal Nutrition, 2021, 7(1):24-30.
[10] Chuang Wen Yang, Hsieh Yun Chen, Lee Tzu-Tai. The Effects of Fungal Feed Additives in Animals: A Review[J]. Animals: an open access journal from MDPI, 2020, 10(5):805.
[11] 刘延英.乳酸菌在畜禽养殖中的功能及其应用[J].中国动物保健,2021,23(1):49-50.
[12] 孟晓,贺稚非,李洪军.短乳杆菌1.12发酵过程中去除粪臭素的条件优化(英文)[J].食品工业科技,2013,34(16):218-223+238.
[13]邱艳君,龙炳清,闫志英,等.两株乳酸菌的分离及其除臭性能[J].应用与环境生物学报,2013,19(3):511-514.
[14] 汪开英,魏波,罗皓杰.畜禽规模养殖场的恶臭检测与评估方法[J].中国畜牧杂志,2009,45(24):24-27.
[15] 刘春梅,徐凤花,曹艳花,等.除臭菌株对NH3和H2S释放及物质转化的影响[J].农业环境科学学报,2011,30(3):585-590.
[16] 马梅荣,王光玉,宣世伟,等.微生物菌剂对生活污水的除臭实验[J].环境科学与技术,2004(1):22-24+111.
[17] 李清飞,赵承美,余国忠.微生物在农村有机生活垃圾堆肥中的作用[J].信阳师范学院学报(自然科学版),2011,24(2):278-280.
[18] 徐锐,唐昊,文娅,等.新型微生物菌剂对垃圾渗滤液的除臭效果[J].环境工程学报,2014,8(5):2110-2116.
[19] 陳进斌,谢翼飞,李旭东,等.一种除臭复合菌剂的功能菌鉴定[J].环境工程学报,2015,9(3):1507-1512.
[20] 许丽娟,王震,贺月林,等.一株生活垃圾除臭乳酸菌的筛选与鉴定[J].安徽农业科学,2012,40(28):13770-13772.
