基于网络药理学和分子对接研究芪金合剂治疗肾结石的作用机制
2021-12-23贺潇蒋伟平刘起立黄丽玲毛璟弢蔡蔚
贺潇 蒋伟平 刘起立 黄丽玲 毛璟弢 蔡蔚




〔摘要〕 目的 利用网络药理学和分子对接技术预测芪金合剂(黄芪、金钱草)治疗肾结石的作用机制及潜在靶点。方法 利用多个数据库获取药物有效成分、疾病靶点,取两者交集基因;使用Cytoscape 3.8.0软件构建“中药-成分-靶点”调控网络,将交集靶基因导入STRING数据库,构建蛋白质相互作用网络;并对交集基因进行拓扑分析、GO和KEGG富集分析;将有效成分与核心基因分子对接,计算最低结合能,制作分子对接模型图。结果 获得黄芪有效成分21种,金钱草有效成分10种,黄芪作用靶点396个,金钱草作用靶点263个,交集基因109个;根据KEGG富集分析结果获得作用通路9条;“中药-成分-靶点”网络图中芪金合剂的有效成分为槲皮素、山柰酚、异鼠李素;槲皮素与核心基因分子对接结合稳定。结论 芪金合剂可通过多靶点、多通路、多成分治疗肾结石,槲皮素、山柰酚、异鼠李素可能是其治疗作用的主要有效成分,其潜在的作用机制与炎症、氧化应激反应、代謝、激素及免疫等通路密切相关,其作用靶点可能与AKT1、MAPK1、MAPK14、TNF、ESR1、JUN、FOS、TP53、MYC等多个基因有关。
〔关键词〕 芪金合剂;肾结石;网络药理学;分子对接;作用机制
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.12.015
Mechanism of Qijin Mixture in the Treatment of Kidney Stones Based on Network
Pharmacology and Molecular Docking
HE Xiao1, JIANG Weiping1, LIU Qili1, HUANG Liling1, MAO Jingtao1, CAI Wei2*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Affiliated Hospital of
Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective The mechanism and potential targets of Qijin Mixture [Huangqi (Astragali Radix), Jinqiancao (Lysimachiae Herba)] in the treatment of kidney stones were predicted by network pharmacology and molecular docking technology. Methods Multiple databases were used to obtain drug active ingredients and disease targets, their intersection genes were selected; Cytoscape 3.8.0 software was used to construct a “traditional Chinese medicine-component-target” regulatory network, and the intersection target genes were imported into the STRING database to construct a protein-protein interaction network; and topological analysis, GO and KEGG enrichment analysis were performed for the intersection genes; the active ingredients and the core gene molecules were docked, the lowest binding energy was calculated, and a molecular docking model diagram was made. Results 21 kinds of active ingredients of Huangqi (Astragali Radix) were obtained, 10 kinds of active ingredients of Jinqiancao (Lysimachiae Herba) were obtained, 396 targets of Huangqi (Astragali Radix) were obtained, 263 targets of Jinqiancao (Lysimachiae Herba) were obtained, and 109 intersection genes were obtained. According to the results of KEGG enrichment analysis, 9 action pathways were obtained; the effective ingredients of Qijin Mixture in the network diagram of “traditional Chinese medicine-component-target” were quercetin, kaempferol and isorhamnetin; quercetin was stable in docking and binding with core gene molecules. Conclusion Qijin Mixture can treat kidney stones through multiple targets, multiple pathways, and multiple components. Quercetin, kaempferol and isorhamnetin may be the main active components of its therapeutic effect, and its potential mechanism of action is closely related to inflammation, oxidative stress response, metabolism, hormone and immune pathways, and its targets may be related to multiple genes such as AKT1, MAPK1, MAPK14, TNF, ESR1, JUN, FOS, TP53, MYC.
〔Keywords〕 Qijin Mixture; kidney stones; network pharmacology; molecular docking; mechanism
肾结石是泌尿外科常见的疾病之一,其发病率已达到1%~20%,呈逐年上升趋势,治疗后其复发率超过50%[1],且复发结石患者再发的可能性更大[2]。现其手术治疗多以微创为主,包括体外冲击波碎石术、经皮肾镜取石术、输尿管软镜取石术等。随着腔镜微创技术的不断成熟,肾结石的治疗手段也在不断增多,但如何减少术后残石、结石复发率高的现状依然是众多学者研究的热点。
肾结石属于中医学“石淋”范畴,《诸病源候论·诸淋病候》中认为“石淋者,淋出而石也。肾主水,水结则化为石,故肾客砂石”。中医药治疗肾结石历史悠久,且临床疗效显著,芪金合剂是由三金排石汤化裁而来,组成成分为金钱草、黄芪两味中药,可有效改善上尿路结石术后症状,提高手术清石率,减少术后残石及结石复发的可能性[3-4]。
现代研究发现,广金钱草提取物可抑制肾组织草酸钙结晶的形成与沉积,保护肾小管细胞,减轻扩张程度,减轻肾间质慢性炎症,对肾功能起到保护作用[5],黄芪具有调节免疫功能、改善炎症反应和微循环障碍、改善多器官损伤等作用[6]。
目前,对于金钱草、黄芪单药药理药效研究较多,但对于二者联合用药的药效研究较少,基于芪金合剂联合应用治疗上尿路结石术后的临床疗效,故本研究利用网络药理学和分子对接技术探讨芪金合剂治疗肾结石的作用机制及潜在靶点,现将结果报道如下。
1 材料与方法
1.1 有效成分的获取及靶点名称规范化
以“金钱草”“黄芪”为检索词,通过中药系统药理学数据库与分析平台(TCMSP)(https://old.tcmsp-e.com/tcmsp.php)进行检索,将口服生物利用度(oral bioa⁃
vailability, OB)≥30%、类药性(drug-likeness, DL)≥0.18作为活性成分筛选条件,筛查出符合条件的活性成分和其相对应的靶点。将物种设置为人,使用UniProt(http://www.uniprot.org/)数据库将靶点基因名称校正。
1.2 肾结石相关靶点的获取
以“kidney stones”为检索词,通过GeneCards、OMIM、PHARMGKB、DrugBank等数据库获取肾结石相关靶点,利用R语言R-4.0.5软件将肾结石的相关靶点取交集合并,将疾病靶点与药物有效成分的作用靶点进行映射取交集,制作Venn图。
1.3 中药-成分-靶点交互网络构建
利用Cytoscape 3.8.0软件构建“中药-成分-靶点”调控网络,此网络图中,节点代表关键化合物和靶点,边代表节点之间相互作用的关系。
1.4 蛋白質相互作用(PPI)网络与拓扑分析
考虑到交集靶基因之间的相互作用,将其导入STRING数据库(https://string-db.org/cgi/input.pl),物种选择“人类”,并以互动分数“>0.9”的评分筛选蛋白的相互作用关系,隐藏离散点,构建PPI网络。利用Cytoscape 3.8.0软件,下载插件Cyto-NCA,根据其网络中心度进行拓扑分析。
1.5 GO和KEGG富集
利用R语言R-4.0.5软件及DOSE、clusterProfiler、enrichplot、pathview等程序包对交集基因进行GO、KEGG富集分析,选择显著富集的的生物过程(biological process, BP)、细胞组分(cell component, CC)、分子功能(molecular function, MF)前10项绘制柱状图。选择显著富集的前30条通路绘制气泡图。
1.6 分子对接
选择“中药-成分-靶点”调控网络中含有最多相关靶基因的有效成分,利用PubChem CID数据库(https://pubchem.ncbi.nlm.nih.gov/)下载有效成分的3D结构。选择交集基因拓扑分析的核心基因,利用PDB数据库(http://www1.rcsb.org/)下载核心基因相关蛋白的3D结构。使用AutoDock Tools 1.5.6软件为受体蛋白添加氢原子和设置对接参数,所有配体和受体文件均保存为pdbqt格式。使用Autodock Vina软件进行分子对接,并计算最低结合能,使用PyMol软件生成分子对接模型图。
2 结果
2.1 活性成分和靶基因的筛选
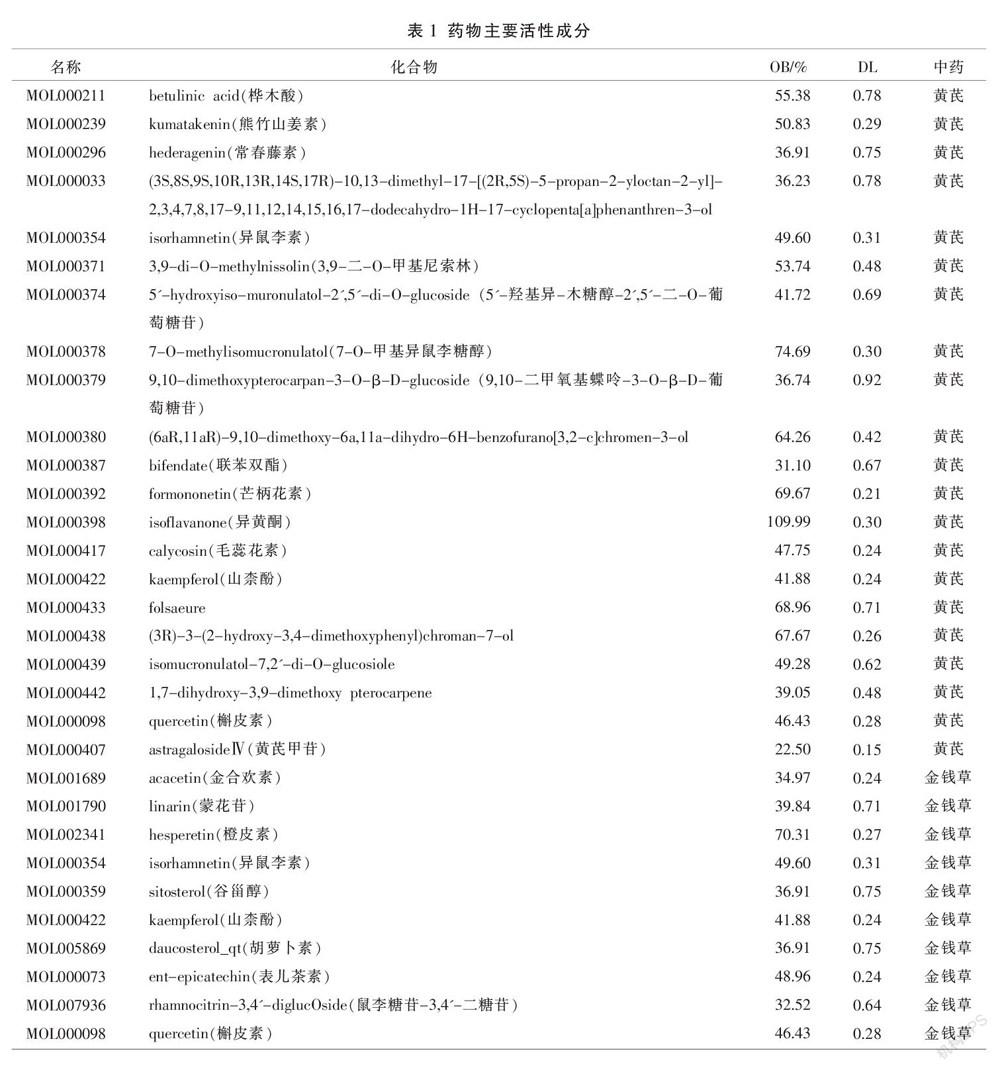
在TCMSP数据库中,以OB≥30%、DL≥0.18为条件进行筛选,得到活性成分共30种,黄芪甲苷虽不满足上述OB值与DL值的筛选条件,经查阅文献发现[6],黄芪甲苷为黄芪的主要活性成分,予以补充,故黄芪的活性成分有21种,金钱草11种(见表1)。将有效成分对应的靶点利用UniProt数据库预测,选择人的已证实的数据进行基因名称标准化,最终获得659个靶点,其中黄芪396个、金钱草263个。
2.2 “中药-成分-靶点”网络构建
如图1所示,药物作用靶点与肾结石的靶点基因交集为109个。将中药、有效成分、交集靶点基因导入Cytoscape 3.8.0软件中,设置节点与边线将其相互关系绘制成可视化“中药-成分-靶点”网络图(图2)。黄芪与金钱草均含有的有效成分为槲皮素(MOL000098)、山柰酚(MOL000422)、异鼠李素(MOL000354),他们分别与84、31、16个靶基因相关。其中关联度较高的靶基因为PTGS2基因(16个节点),其次是NCOA2、HSP90AB1、PRSS1、ESR1、MAPK14、JUN、AKT1、TNF、TP53、MAPK1、FOS、MYC、RB1等。
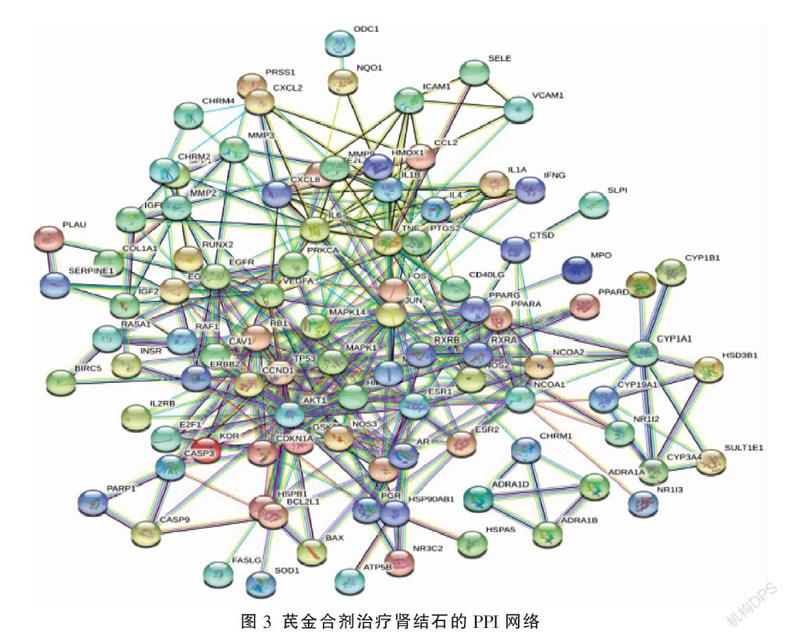
2.3 PPI网络和拓扑分析
通过STRING数据库获PPI网络见图3,共98个蛋白质节点和377条边。利用Cytoscape插件CytoNCA进行拓扑分析,选择相关指标:介度中心性 (betwee-nness centrality, BC)、接近中心性(closenesscentrality, CC)、借助度中心性(degree centrality, DC)、特征向量中心性(eigenvector centrality, EC)、局部边连通性(localaverage connectivity, LAC)和网络中心性(network centrality, NC),选择大于所有指标中位数的基因进行筛选,经过2次筛选,最终获得核心基因10个,分别是ESR1、AKT1、JUN、FOS、MAPK1、MAPK14、TNF、TP53、MYC、RB1。见图4。
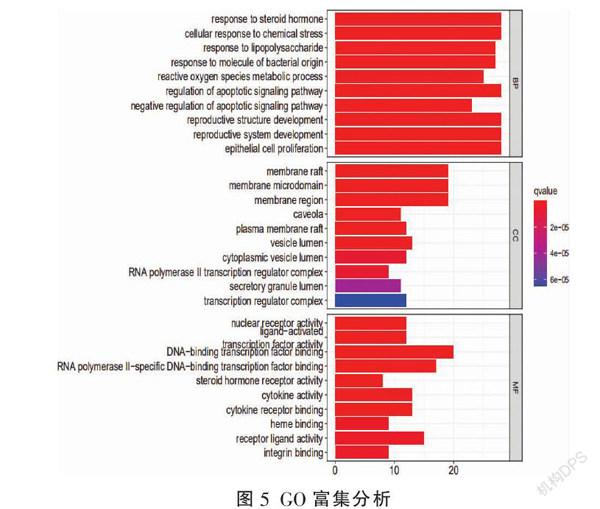
2.4 GO和KEGG富集
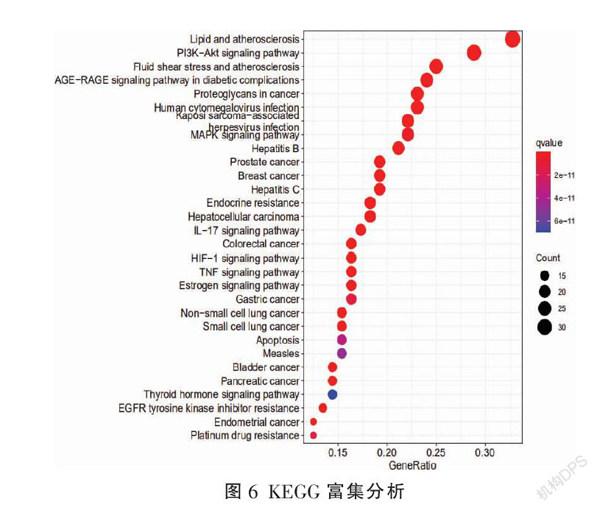
GO富集分析从生物过程(BP)、细胞成分(CC)和分子功能(MF)3个水平阐明基因功能。BP主要涉及类固醇激素反应、细胞化学应激反应、脂多糖反应、对细菌起源分子的反应、活性氧代谢过程、凋亡信号通路的调节、凋亡信号通路的负调控等;CC主要与膜筏、膜微区、膜区、质膜筏、囊泡内腔、细胞质囊泡腔、RNA聚合酶II转录调节复合物、分泌颗粒内腔、转录调节复合物等相关。MF主要涉及核受体活性、配体激活、转录因子活性、DNA结合转录因子、RNA聚合酶II特异的DNA结合转录因子、类固醇激素受体活性、细胞因子活性、细胞因子受体结合、血红素结合、受体配体活性、整联蛋白结合等(图5)。查阅国内外相关文献研究发现,黄芪-金钱草治疗肾结石的作用机制主要与脂质和动脉粥样硬化、PI3K(磷脂酰肌醇-3-激酶)/Akt(蛋白激酶B)信号通路、流体剪切应力与动脉粥样硬化、AGE-RAGE(晚期糖基化产物-晚期糖基化终末产物受体)信号通路、MAPK(丝裂原活化蛋白激酶)信号通路、IL-17(白介素-17)信号通路、HIF-1(缺氧诱导因子-1)信号通路、TNF信号通路、雌激素信号通路等相关(图6)。
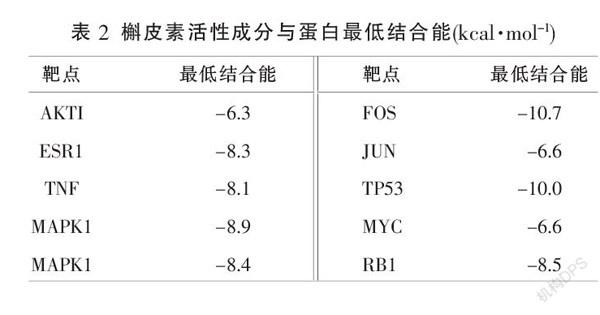
2.5 分子对接
选择中药-成分-靶点调控网络中含最多相关靶基因的有效成分作为小分子配体:槲皮素。选择交集基因拓扑分析的核心基因:AKTI、ESR1、TNF、MAPK1、MAPK14、FOS、JUN、TP53、MYC、RB1共10个,分别与小分子配体进行分子对接。使用Autodock Vina软件进行分子对接,并计算各个蛋白与小分子配体的最低结合能(表2),结合能小于0表示两个分子自发结合,结合能越小,构象越稳定,使用PyMol软件进行可视化(图7)。
3 讨论
3.1 芪金合剂治疗肾结石的关键靶点
本研究通过交集基因拓扑分析获得AKT1、MAPK1、MAPK14、TNF、ESR1、JUN、FOS、TP53、MYC、RB1等核心基因。AKT1的缺失会加剧肾脏损害,其机制与AKT1参与肾缺血再灌注损伤中肾小管的凋亡和炎症反应有关[7]。ESR1通过调节脂肪组织的VEGF-A,增强血管生成,减少炎症和改善脂肪组织功能[8]。Jun和Fos这2个原癌基因是MAPK信号通路的下游成员。c-Jun调节与动脉粥样硬化有关的各种载脂蛋白和促炎分子的转录[9],在先天免疫中起重要作用[10],c-Fos可激活先天免疫信号传导级联以清除细菌,同时还参与了宿主防御机制[11]。MAPK1可以减轻脂多糖诱导的肾小球上皮细胞细胞损伤[12]。MAPK14可被促炎细胞因子激活,参与炎症介质细胞因子(TNF-α、IL-1、IL-6、IL-1b)的生物合成,诱导相关炎癥蛋白。MYC原癌基因可通过对先天性和适应性免疫效应细胞以及免疫调节细胞因子的影响来调节肿瘤微环境[13]。TNF是健康生物体和患病条件下免疫反应的关键介质,可增强巨噬细胞活化和抗原呈递,通过不同机制调节免疫。TNF耐受性可能代表了一种涉及终止炎症和防止过度或长期炎症的保护机制。否则,耐受性也可能是免疫麻痹的触发因素,从而导致严重的炎症性疾病,如败血症[14]。RB1是肿瘤抑制基因,经查阅文献发现与本次研究无明显关联性。故芪金合剂治疗肾结石与AKT1、MAPK1、MAPK14、TNF、ESR1、JUN、FOS、TP53、MYC等靶点相关。
3.2 芪金合剂有效成分
“中药-成分-靶点”网络图中,芪金合剂的有效成分为槲皮素、山柰酚、异鼠李素。槲皮素可有效预防尿石症,主要潜在机制包括利尿、解痉和抗氧化活性,以及对结晶、成核和晶体聚集的抑制作用[15]。槲皮素通过上调PI3K/AKT通路降低组织炎症和氧化应激反应[16]。还可下调脂多糖诱导的相关蛋白表达,减少血清中促炎因子的生成,改善脓毒血症相关的急性肾损伤[17]。高尿酸血症早期在肾脏尚未形成尿酸盐沉积时亦导致肾损伤,但槲皮素降尿酸、抗炎、抗氧化的作用可以减少这种肾损伤[18]。
山柰酚具有抗菌、抗炎、抗氧化、抗肿瘤和抗糖尿病等多种药理作用[19]。山柰酚能减少肾脏中AGE积累和ROS(活性氧)产生所引起的线粒体凋亡[20]。山柰酚能减少ROS和亚硝酸盐生成,减少尿液中草酸钙晶体的形成,具有急性和长期利尿作用以及保护肾脏的特性[21],同时可减少草酸钙晶体沉积和晶体诱导的肾氧化和炎症损伤[22]。异鼠李素能够减少ROS、脂质堆积,有抗动脉粥样硬化、减少巨噬细胞凋亡的作用,其作用途径与PI3K/AKT通路相关[23],还可通过抑制TNF-α达到抗菌消炎作用[24]。故芪金合剂可通过上述有效成分发挥抗炎、抗氧化应激反应以及减少晶体代谢沉积、保护肾脏的作用从而治疗肾结石。
3.3 芪金合剂作用通路
芪金合剂治疗肾结石的作用通路可分为两类:(1)炎症与氧化应激反应通路:PI3K-Akt信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路、HIF-1信号通路;(2)免疫、代谢与激素相关通路:脂质和动脉粥样硬化、AGE-RAGE信号通路、雌激素信号通路。PI3K/Akt信号通路的失活抑制了肾结石中肾小管上皮细胞间质转化的发展和草酸钙晶体的形成[25],对肾草酸钙晶体诱导的氧化应激、炎症反应和细胞凋亡也有抑制作用[26]。MAPK信号通路介导了草酸钙-水晶体诱导的晶体黏附变化[27],抑制MAPK磷酸化,增强Akt磷酸化,可减轻肾小管上皮细胞的氧化应激损伤和凋亡,达到减少肾结石形成的可能性[28]。TNF、IL-17信号通路与炎症反应有关,其中,IL-17信号通路在对损伤、生理应激和感染的反应中维持健康方面具有重要作用[29]。TNF信号通路不仅介导多种炎症反应,同时参与免疫应答。HIF-1是细胞对缺氧适应性反应的主要调节因子,在调节肾小管上皮细胞的多个细胞过程中起着关键作用,包括凋亡、自噬、炎症和代谢模式改变[30]。炎症效应机制在脂质和动脉粥样硬化通路中亦发挥着重要作用,严重的内质网应激可诱导下游TNF等炎症细胞因子释放,从而引发血管内皮细胞损伤后的炎症细胞活化和一系列慢性炎症反应[31]。AGEs通过与rage受体结合,通过产生促炎细胞因子、ROS等来诱导炎症和免疫抑制,这些病理分子导致肾系膜、内皮和足细胞损伤[32]。雌激素信号可起到保护肾脏的作用[34],雌激素β受体可通过减少草酸合成及草酸引起的肾脏氧化应激损伤,从而抑制草酸钙结石的形成[33]。故芪金合剂可通过上述通路起到抗炎、抗氧化应激损伤、减少结石晶体的代谢沉积、调节机体免疫等作用治疗肾结石。
本研究通过网络药理学分析了芪金合剂的有效成分,并对药物作用靶点及通路进行功能分析,以分子对接技术验证药物有效成分与肾结石靶点的结合,预测芪金合剂治疗肾结石潜在的作用机制与炎症、氧化应激反应、代谢、激素及免疫等通路密切相关,其作用靶点与AKT1、MAPK1、MAPK14、TNF、ESR1、JUN、FOS、TP53、MYC等多个基因有关,说明芪金合剂可通过多靶点、多通路、多成分的途径治疗肾结石。肾结石的发病原因与多种因素相关,中医理论中讲究“异病同治”,有望在今后的研究中找到多种疾病的协同作用靶点,发挥中药治疗的最大效果。此外,通过本次研究,可对中药复方的作用机制、有效成分提取、药物溶石等方面进一步深入到实验研究中。
参考文献
[1] 叶章群,周 辉.泌尿系结石基础研究及临床新进展[J].中华泌尿外科杂志,2017,38(9):644-649.
[2] ZHANG J, WANG G Z, JIANG N, et al. Analysis of urinary calculi composition by infrared spectroscopy: A prospective study of 625 patients in Eastern China[J]. Urological Research, 2010, 38(2): 111-115.
[3] 蔡 蔚,狄 奇,谢 晓,等.芪金合剂联合输尿管软镜碎石术治疗上尿路结石的疗效观察[J].湖南中医药大学学报,2020,40(11):1409-1412.
[4] 狄 奇,谢 晓,谢海平,等.芪金合剂联合硕通镜治疗上尿路结石的疗效及安全性研究[J].湖南中医药大学学报,2021,41(7):1110-1114.
[5] 刘 英,王志勇,杨德慧,等.廣金钱草提取物对尿石症大鼠肾功能的保护作用[J].中国老年学杂志,2018,38(10):2467-2470.
[6] 谢 静,龚易昕悦,丁立生,等.黄芪及其活性成分对脓毒症临床和药理作用的研究进展[J].中草药,2021,52(8):2502-2510.
[7] KIM I Y, PARK Y K, SONG S H, et al. Akt1 is involved in tubular apoptosis and inflammatory response during renal ischemia-reperfusion injury[J]. Molecular Biology Reports, 2020, 47(12): 9511-9520.
[8] FATIMA L A, CAMPELLO R S, SANTOS R D S, et al. Estrogen receptor 1 (ESR1) regulates VEGFA in adipose tissue[J]. Scientific Reports, 2017, 7(1): 1-14.
[9] MOYANO A J, RACCA A C, SORIA G, et al. C-Jun proto-oncoprotein plays a protective role in lung epithelial cells exposed to staphylococcal α-toxin[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 170.
[10] REN Y P, ZHANG J Q, DONG W H, et al. Evolutionary and functional analysis of Cyclina sinensis c-Jun AP-1 gene in response to LPS stimulation[J]. Developmental & Comparative Immunology, 2018, 88: 1-7.
[11] HOP H T, ARAYAN L T, HUY T X N, et al. The key role of c-fos for immune regulation and bacterial dissemination in Brucella infected macrophage[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 287.
[12] ZHAO D, LIU Z, ZHANG H. The protective effect of the TUG1/miR-197/MAPK1 axis on lipopolysaccharide-induced podocyte injury[J]. Molecular Medicine Reports, 2019, 20(1): 49-56.
[13] CASEY S C, BAYLOT V, FELSHER D W. The MYC oncogene is a global regulator of the immune response[J]. Blood, 2018, 131(18): 2007-2015.
[14] HUBER R, BIKKER R, WELZ B, et al. TNF tolerance in monocytes and macrophages: Characteristics and molecular mechanisms[J]. Journal of Immunology Research, 2017, 2017: 1-9.
[15] NIRUMAND M, HAJIALYANI M, RAHIMI R, et al. Dietary plants for the prevention and management of kidney stones: Preclinical and clinical evidence and molecular mechanisms[J]. International Journal of Molecular Sciences, 2018, 19(3): 765.
[16] 吴 柳,蒋永艳,刘 微,等.槲皮素通过PI3K/AKT/mTOR通路减轻脓毒症小鼠心肌损伤[J].中国急救医学,2021,41(3):238-243.
[17] 谭继翔,何 进,秦文熠,等.槲皮素通过抑制TLR4/NF-κB通路缓解脂多糖诱导的急性肾损伤[J].南方医科大学学报,2019,39(5): 598-602.
[18] 彭 艳,邱慧磊,史为伍,等.槲皮素对非沉积高尿酸血症肾损伤的保护作用[J].中医药学报,2013,41(3):63-66.
[19] IMRAN M, SALEHI B, SHARIFI-RAD J, et al. Kaempferol: A key emphasis to its anticancer potential[J]. Molecules, 2019, 24(12): 2277.
[20] ZHANG N, ZHAO S Y, HONG J N, et al. Protective effects of kaempferol on D-ribose-induced mesangial cell injury[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 1-10.
[21] CECHINEL-ZANCHETT C C, BOLDA MARIANO L N, BOEING T, et al. Diuretic and renal protective effect of kaempferol 3-O-alpha-l-rhamnoside (afzelin) in normotensive and hypertensive rats[J]. Journal of Natural Products, 2020, 83(6): 1980-1989.
[22] YUAN P, SUN X F, LIU X, et al. Kaempferol alleviates calcium oxalate crystal-induced renal injury and crystal deposition via regulation of the AR/NOX2 signaling pathway[J]. Phytomedicine, 2021, 86: 153555.
[23] LUO Y, SUN G B, DONG X, et al. Isorhamnetin attenuates atherosclerosis by inhibiting macrophage apoptosis via PI3K/AKT activation and HO-1 induction[J]. PLoS One, 2015, 10(3): e0120259.
[24] 王 科,龐 辉,梁春梅,等.不同剂量异鼠李素对炎症损伤小鼠巨噬细胞RAW264.7增殖能力的影响及其机制探讨[J].山东医药,2018,58(39):48-51.
[25] WANG X F, ZHANG B H, LU X Q, et al. Gastrin-releasing peptide receptor gene silencing inhibits the development of the epithelial–mesenchymal transition and formation of a calcium oxalate crystal in renal tubular epithelial cells in mice with kidney stones via the PI3K/Akt signaling pathway[J]. Journal of Cellular Physiology, 2019, 234(2): 1567-1577.
[26] YUAN H B, ZHANG J H, YIN X S, et al. The protective role of corilagin on renal calcium oxalate crystal-induced oxidative stress, inflammatory response, and apoptosis via PPAR-γ and PI3K/Akt pathway in rats[J]. Biotechnology and Applied Biochemistry, 2020: bab.2054.
[27] QI S Y, WANG Q, XIE B, et al. P38 MAPK signaling pathway mediates COM crystal-induced crystal adhesion change in rat renal tubular epithelial cells[J]. Urolithiasis, 2020, 48(1): 9-18.
[28] LIU Q, LIU Y L, GUAN X F, et al. Effect of M2 macrophages on injury and apoptosis of renal tubular epithelial cells induced by calcium oxalate crystals[J]. Kidney and Blood Pressure Research, 2019, 44(4): 777-791.
[29] MCGEACHY M J, CUA D J, GAFFEN S L. The IL-17 family of cytokines in health and disease[J]. Immunity, 2019, 50(4): 892-906.
[30] BUCHHOLZ B, ECKARDT K U. Role of oxygen and the HIF-pathway in polycystic kidney disease[J]. Cellular Signalling, 2020, 69: 109524.
[31] 郭晓坤,王 林.炎症因素与动脉粥样硬化病变发病机制关系的研究进展[J].医学综述,2020,26(16):3160-3166.
[32] SHEN C Y, LU C H, WU C H, et al. The development of Maillard reaction, and advanced glycation end product (AGE)-receptor for AGE (RAGE) signaling inhibitors as novel therapeutic strategies for patients with AGE-related diseases[J]. Molecules, 2020, 25(23): 5591.
[33] GUTHRIE G, ALMUTLAQ R, BUTT M, et al. G protein-coupled estrogen receptor 1 is required for greater endothelin-1 excretion in female mice[J]. The FASEB Journal, 2021, 35(S1): fasebj.2021.35.S1.04264.
[34] 朱 瑋.雌激素β受体在草酸钙结石形成中作用及机制研究[D].广州:广州医科大学,2017.
〔收稿日期〕2021-06-19
〔基金项目〕湖南中医药大学校级科研基金项目(2018XJJJ57);湖南省教育科学规划课题(XJK015BGD049);湖南省科技创新计划项目(2018SK51206)。
〔作者简介〕贺 潇,女,在读硕士研究生,研究方向:中西医结合临床-泌尿外科。
〔通信作者〕*蔡 蔚,女,博士,主任医师,硕士研究生导师,E-mail:2240430455@qq.com。
